MMR基因突变的前列腺癌16例临床病理分析
尹文莲,张孟尼,陈雪芹,聂 玲,周 桥,陈 铌
前列腺癌中错配修复(mismatch repair, MMR)基因突变比例较低,仅占2%~5%[1]。但MMR基因胚系致病突变会增加男性患前列腺癌的风险,且与前列腺癌的不良预后有关,如分化低、远处转移和晚期前列腺癌等[2-3]。在2023版NCCN指南中,MLH1、MSH2、MSH6和PMS2被推荐作为遗传性前列腺癌的候选基因[4]。近年来,美国食品和药物管理局(food and drug administration, FDA)已批准PD-1抑制剂用于治疗错配修复缺陷(mismatch repair deficiency, dMMR)或高度微卫星不稳定性(microsatellite instability-high, MSI-H)的相关实体肿瘤[5]。在MMR突变的前列腺癌研究中,PD-1抑制剂也被证实具有潜在的免疫治疗价值[3,6-7]。此外,MMR缺陷的前列腺癌患者对新型内分泌治疗也较敏感[3],因此检测前列腺癌患者的MMR缺陷具有重要临床指导意义。结直肠癌中MSI-H/dMMR的诊断主要通过MSI-PCR分析或免疫组化染色检测MMR蛋白表达作为MMR缺陷的初筛手段[8]。目前,前列腺癌中MMR基因突变和蛋白表达相关性的研究较少,本研究总结了16例NGS检出MMR基因突变的前列腺癌的临床病理特征,并探讨MMR基因突变与蛋白表达的相关性。
1 材料与方法
1.1 一般资料收集2014年6月~2021年12月四川大学华西医院行基因检测的前列腺癌患者249例。患者年龄43~91岁,平均(67.7±8.6)岁,中位年龄68岁;超过80%的患者初诊PSA>20 ng/mL。收集肿瘤石蜡样本或血液样本进行NGS检测,其中16例检出MMR基因突变。对检出MMR基因突变患者的石蜡组织样本进行MMR蛋白免疫组化染色。所有患者的样本采集和检查均签署书面知情同意书。
1.2 基因检测准备好的组织样本(肿瘤组织和配对癌旁组织)或血液样本送思路迪医学检验有限公司实验室进行NGS测序。NGS检测使用定制的NGS panel对156个前列腺癌相关基因进行高通量测序,包括与癌症遗传风险相关的38个基因,本研究主要关注MMR通路的相关基因变异。
1.3 免疫组化16例中有14例获得石蜡组织样本,另2例(例4、5)为外院会诊病例,未获得石蜡组织样本。采用免疫组化EnVision法检测MLH1(ES05)、PMS2(EP51)、MSH2(RED2)、MSH6(EP49)的表达,一抗均购自北京中杉金桥公司。MMR蛋白免疫组化阳性信号均定位于细胞核。所有病例切片均由2位泌尿男性生殖病理亚专业组医师复片。
2 结果
2.1 临床特征、病理组织学分级及形态特征16例MMR基因突变的前列腺癌患者年龄55~79岁,中位年龄69岁。患者多因排尿不畅、腹痛或发现PSA升高就诊。1例(6.3%)初诊PSA<10 ng/mL,1例(6.3%)初诊PSA为10~20 ng/mL,14例(87.5%)初诊PSA>20 ng/mL;4例(25%)为局限性前列腺癌,12例(75%)有远处转移,其中11例为骨转移,1例为多部位转移(骨、肺、肝及淋巴结转移);12例(75%)患者为去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)。
本组16例MMR基因突变病例的组织学形态以经典的腺泡腺癌为主。组织学分级:2例(12.5%)为Gleason评分4+3=7分,ISUP/WHO 2016分级分组第3组;5例(31.2%)为Gleason评分4+4/3+5=8分,ISUP/WHO 2016分级分组第4组;9例(56.3%)为Gleason评分9/10分(4+5/5+4/5+5),ISUP/WHO 2016分级分组第5组。其中7例(43.8%)伴有前列腺导管内癌(intraductal carcinoma of the prostate, IDC-P)成分,包括1例疏松筛状型IDC-P和6例致密筛状型/实体型IDC-P;2例(28.6%)IDC-P成分占比<10%,5例(71.4%)IDC-P成分占比≥10%。除此之外,1例(6.3%)伴有导管腺癌成分,3例(18.8%)局灶有神经内分泌表型,6例(37.5%)查见神经或血管侵犯,4例(25%)查见前列腺外累及。
2.2 MMR基因突变16例MMR基因突变中,包括8例MMR基因致病性突变和8例临床意义不明变异。8例致病性突变包括:4例MSH2(2例胚系和2例体系)、3例MSH6(1例胚系和2例体系)和1例MLH3体系突变。8例临床意义不明变异包括4例MSH6(2例胚系和2例体系)、2例PMS2(1例胚系和1例体系)、2例MLH1(1例胚系和1例体系)和2例MSH2胚系突变,其中有2例分别同时检出MSH6、MLH1突变和MSH2、MSH6突变。总体而言,MSH6突变率最高(7/16,43.8%),其次是MSH2突变(6/16,37.5%)(表1)。
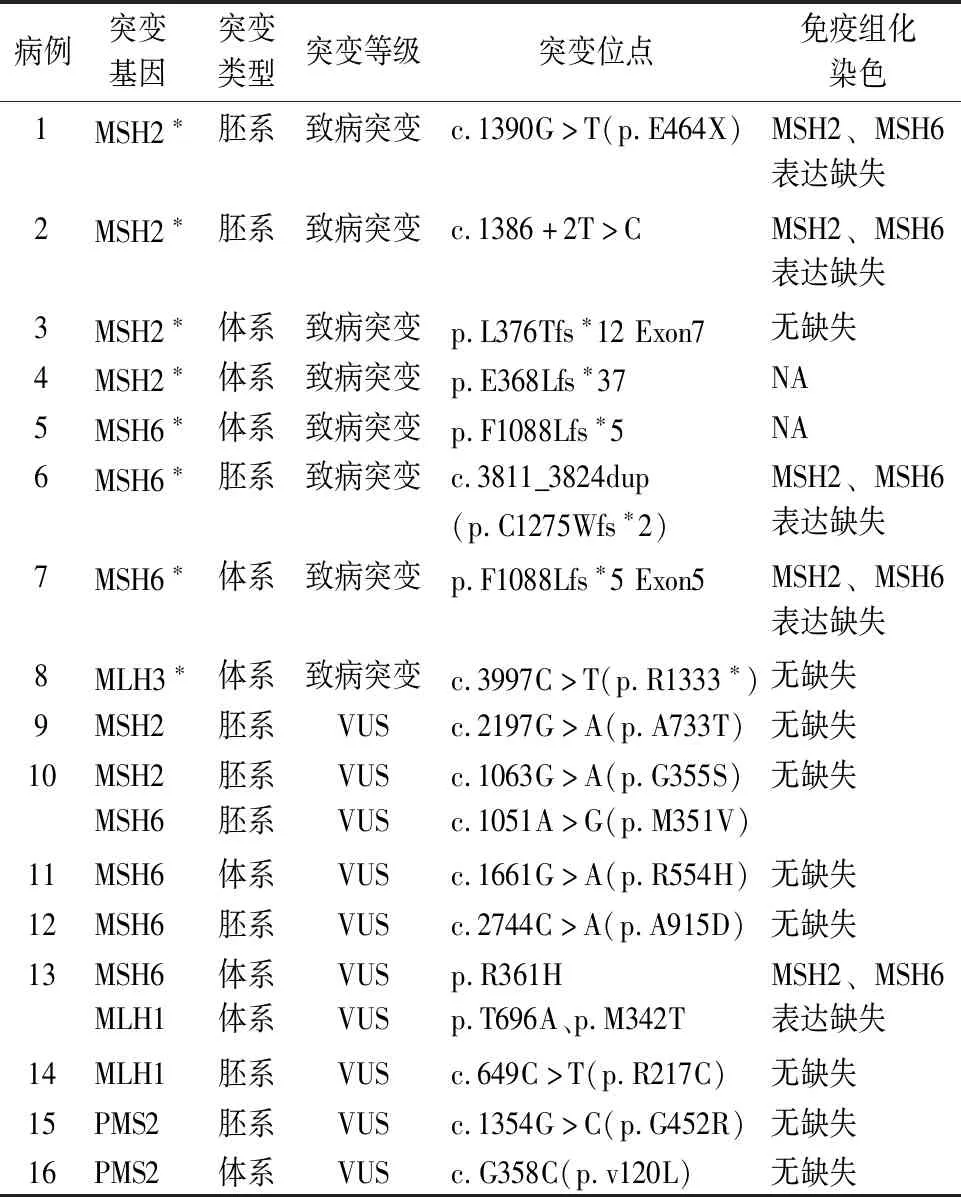
表1 16例前列腺癌患者的MMR基因突变和蛋白表达
2.3 MMR基因突变与蛋白表达的相关性14例石蜡组织样本进行MMR免疫组化染色,其中5例(35.7%)检出MMR蛋白表达缺失,均表现为MSH2和MSH6蛋白缺失,MLH1和PMS2蛋白无缺失。5例蛋白表达缺失病例中,2例为MSH2致病突变、2例为MSH6致病突变(图1),1例为MSH6和MLH1临床意义不明变异。其余2例MMR基因致病突变(例3、8)(图2)和7例MMR基因临床意义不明变异未检出MMR蛋白表达缺失。致病突变病例中NGS与免疫组化结果匹配率为4/5(80.0%),而意义不明变异中NGS与免疫组化结果匹配率仅为1/8(12.5%)(表1)。进一步对致病突变中NGS与免疫组化结果不匹配的例3进行MSI-PCR验证,结果证实该例为微卫星稳定型,与免疫组化结果一致。
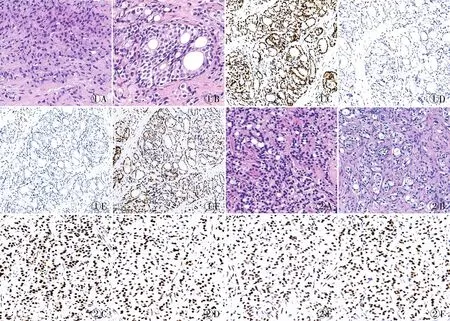
图1 MMR基因突变患者(例6)的HE和MMR免疫组化染色:A. Gleason评分为5分的区域;B. 前列腺导管内癌形态;C. 肿瘤细胞核表达MLH1,EnVision法;D.肿瘤细胞MSH2表达缺失,血管内皮和淋巴细胞为阳性内对照,EnVision法;E.肿瘤细胞MSH6表达缺失,血管内皮和淋巴细胞为阳性内对照,EnVision法;F.肿瘤细胞核表达PMS2,EnVision法 图2 MMR基因突变患者(例3)的HE和MMR免疫组化染色:A、B. HE形态;C.肿瘤细胞核表达MLH1,EnVision法;D.肿瘤细胞核表达MSH2,EnVision法;E.肿瘤细胞核表达MSH6,EnVision法;F.肿瘤细胞核表达PMS2,EnVision法
2.4 特殊病例例2,69岁,分别于2020年4月和5月在我院确诊为前列腺癌和右侧肾盂低级别尿路上皮癌。前列腺癌为T2期,行前列腺癌根治术。病理诊断为腺泡腺癌,Gleason评分4+3=7分(ISUP/WHO 2016分级分组第2组),肿瘤间质可见较多淋巴细胞浸润;免疫组化显示MSH2和MSH6表达缺失,MLH1和PMS2无缺失(图3)。右侧肾盂癌肿瘤最大径约2.5 cm,右肾盂活检标本病理诊断为乳头状尿路上皮癌(WHO低级别),间质可见灶性坏死和钙化;免疫组化同样显示MSH2和MSH6表达缺失,MLH1和PMS2无缺失(图4)。基因检测结果显示该患者为MSH2胚系致病突变(c.1386+2T>C),但患者无结直肠癌病史及家族史,而是罕见的以前列腺癌和肾盂尿路上皮癌为临床表现。

图3 例2的前列腺癌HE形态和MMR免疫组化染色:A. HE示前列腺腺癌;B.间质见大量淋巴细胞浸润;C.肿瘤细胞核表达MLH1,EnVision法;D.肿瘤细胞MSH2表达缺失,血管内皮和淋巴细胞为阳性内对照,EnVision法;E.肿瘤细胞MSH6表达缺失,血管内皮和淋巴细胞为阳性内对照,EnVision法;F.肿瘤细胞核表达PMS2,EnVision法 图4 例2的尿路上皮癌HE形态和MMR免疫组化染色:A. HE示尿路上皮癌(WHO低级别);B.间质可见灶性坏死和钙化;C.肿瘤细胞核表达MLH1,EnVision法;D.肿瘤细胞MSH2表达缺失,血管内皮和淋巴细胞为阳性内对照,EnVision法;E.肿瘤细胞MSH6表达缺失,血管内皮和淋巴细胞为阳性内对照,EnVision法;F.肿瘤细胞核表达PMS2,EnVision法
3 讨论
DNA损伤修复相关基因异常是遗传性前列腺癌发生的重要诱因之一[9-12]。多数DNA损伤可通过同源重组和MMR通路得到纠正。其中,MMR机制能修复大部分DNA复制过程中的碱基错配,MMR基因的正常功能保证了DNA复制的高度保真[13]。MMR系统由一系列特异性修复DNA错配的修复蛋白组成,包括MLH1、MSH2、MSH6和PMS2等家族成员[14]。dMMR是指参与MMR途径的修复基因发生突变导致MMR功能下降或缺失,使肿瘤细胞获得微卫星不稳定性(microsatellite instability, MSI)表型,这是多种肿瘤发展的重要机制,最具代表性的是结直肠癌和子宫内膜癌。MMR基因(MLH1、MSH2、MSH6和PMS2)的胚系致病突变与Lynch综合征相关,此类患者易患结直肠癌、子宫内膜癌、卵巢癌、胃癌和胰腺癌等[15-17]。本研究发现1例罕见的表现为尿路上皮癌和前列腺癌的MSH2胚系致病突变患者。
Barrow等[18]的研究发现MMR基因胚系致病突变可使男性患前列腺癌的风险增加2~10倍。在晚期前列腺癌中,MMR基因胚系突变率为2%~5%[1,19]。本组病例中,6.4%(16/249)的病例检出MMR基因突变,其中3.2%为胚系突变,仅1.2%为MSH2或MSH6的胚系致病突变。经随访,本组病例MMR基因胚系突变患者及其直系家属均无结直肠癌病史,并不属于Lynch综合征患者。有研究显示,MMR基因突变的前列腺癌可能具有某些侵袭性的临床特征,如较高的Gleason评分、淋巴血管侵犯或较晚的临床分期[20],本研究结果也支持该结论。鉴于PD-1抑制剂能有效治疗dMMR/MSI-H的相关实体肿瘤[21],虽然dMMR在前列腺癌中很少见,其检测结果也具有较好的临床指导价值[5]。
临床检测MSI主要通过PCR和免疫组化两种方法。MSI-PCR用于检测微卫星重复序列的不稳定性,而免疫组化用于检测一种或多种MMR蛋白表达缺失[22-23]。由于免疫组化成本低、检测方便快捷,且与MSI-PCR检测具有相似的敏感性和较高的一致性[24],因此实际工作中通常由病理医师通过免疫组化评估MMR蛋白表达情况作为检测dMMR的初筛手段。MLH1、MSH2、MSH6和PMS2是参与MMR系统的主要蛋白,它们形成MLH1/PMS2(MutLα)和MSH2/MSH6(MutSα)的异二聚体发挥功能[25]。通过免疫组化检测到相应的蛋白表达缺失可以准确地预测发生突变或失活的MMR基因。
前列腺癌中MMR的致病突变具有严格的判读标准:只有蛋白质截断突变(移码、错义突变或剪接变异)以及基因组缺失或结构重排被认为是有害突变[3]。关于前列腺癌中MMR基因突变与蛋白表达缺失关系的研究较少,Antonarakis等[3]的回顾性研究显示,13例有MMR基因致病突变的前列腺癌中仅8例检出MMR蛋白缺失或MSI,表明并非所有MMR基因致病突变都会导致MMR蛋白缺失或MSI。本研究也显示,8例MMR致病突变的前列腺癌中,4例检测出对应的MSH2和MSH6蛋白表达缺失;另外4例中有2例为外院会诊病例无法获取石蜡组织,1例MLH3致病突变的病例(例8)未检出上述四项MMR蛋白缺失,还有1例MSH2致病突变(例3)病例也未检出MMR蛋白表达缺失,MSI-PCR检测结果显示该例为微卫星稳定型,与免疫组化结果一致。8例MMR临床意义不明变异患者中,1例检出MSH2和MSH6蛋白表达缺失,且MSI-NGS检测证实此病例为MSI-H。这些数据表明,前列腺癌中MMR基因突变与MMR蛋白表达不完全匹配,其中MMR致病突变与蛋白表达缺失的符合率较高,MMR临床意义不明变异病例与蛋白表达缺失的符合率较低。可能是由于部分病例MMR基因突变确实不影响功能,而保留抗原表达。也可能因为MMR基因非同义突变有时会损伤MMR功能,但却保留其抗原性,免疫组化检测无蛋白缺失。另外,MMR通路上的其它基因异常(如MLH3致病突变)也会造成dMMR,但常规免疫组化只检测常见的4个MMR蛋白,可能会漏掉其他基因突变所致的dMMR。此外,并非所有失活的MMR基因改变(尤其是结构重排)都可以通过靶向外显子测序进行检测[26]。
在前列腺癌的MSI检测中,传统的MSI-PCR检测灵敏度为72.4%,敏感性略显不足。扩展的18标记微卫星(MSI plus)和大panel NGS检测灵敏度分别为96.6%和93.1%[27]。相较于大panel NGS检测,MSI plus耗时更短,使用的材料更少,且成本更低,所以MSI plus或许可作为前列腺癌一线的MSI筛查方法[27-28]。但是由于靶向测序可能无法检测到MMR基因中的失活重排,当基于高突变负荷或MSI而怀疑存在dMMR时,应同时行免疫组化进行验证[28]。
综上所述,前列腺癌的dMMR主要由于MSH2和MSH6致病突变导致蛋白功能缺陷,多见于Gleason高分级、临床高分期和CRPC,常伴有导管内癌形态。前列腺癌的MMR基因突变与蛋白表达缺失不完全匹配,因此单纯使用免疫组化进行筛查可能会漏掉部分MMR缺陷的患者,需结合患者实际情况选择检测方法。

