焦炉煤气催化制甲烷和低碳醇研究进展
闫小凤,周晗超,闫占辉,齐大超,孟宪光
(1.华北理工大学 材料科学与工程学院,河北 唐山 063210;2.华北理工大学 以升学院,河北 唐山 063210;3.首钢京唐钢铁联合有限责任公司轧钢作业部,河北 唐山 063200;4.河北文丰实业集团唐山文丰特钢有限公司企管部,河北 唐山 063200)
0 引 言
我国钢铁行业蓬勃发展,煤炭消耗约占全国的20%,排放的CO2约占全国的15%,是典型的高耗能和高碳排行业。在钢铁行业,炼焦、炼铁和炼钢等过程中伴随大量副产煤气产生[1],包括焦炉煤气、高炉煤气、转炉煤气。随着中国焦化工业的快速扩张,焦化副产物的产能迅速增加,尤其是焦炉煤气。我国钢铁行业焦炉煤气是洗精煤在焦炉内绝氧状态下炭化或干馏而产生,其主要组分为H2(55%~60%)、CO(5%~8%)、CH4(23%~27%)、CO2(1.5%~3.0%)、N2(3%~7%)、O2(0.3%~0.8%)以及少量C2以上的烃类(2%~4%),热值在16~19 MJ/m3。焦炉煤气是我国特有的能源和化工原料气,是除生物质能和可再生能源之外的最佳来源选择。我国每年副产大量焦炉气,其综合利用对于焦化企业节能减排具有重要意义。焦炉煤气是一种富含氢气和甲烷的重要能源,传统上用于工业加热,作为燃料使用直接燃烧排放,不仅会产生大量CH4、CO2等温室气体,还会浪费优质的化工资源。比较以焦炉煤气、煤炭和天然气为原料生产甲醇的环境影响和成本,结果表明,焦炉煤气路线是对环境影响最小的路线,且生产成本比煤炭路线和天然气路线分别降低了25.1%和19.8%[2]。通过对焦化企业产生的焦炉煤气进行净化提纯,利用其富含的H2、CH4、CO等有效成分,经钢化联产工艺可将其催化转化为甲烷、甲醇、乙二醇等产物[3]。该过程不仅可减少温室气体排放,还可得到高附加值的化工产品,是一条合理、有效的减排路径。在焦炉煤气催化转化过程中,反应路径复杂、副反应多、目标产物选择性较低,因此开发高活性和高选择性的催化剂是实现焦炉煤气高效工业化利用的关键。
1 焦炉煤气制化学品途径分析
焦炉煤气中CO/CO2/H2催化制甲烷、甲酸、甲醇等低碳醇产品的合成路线如图1所示。焦炉煤气制天然气工艺旨在将焦炉产生的煤气进行处理和转化,进而生产甲烷。为满足甲烷化对反应气体的要求,首先对焦炉煤气加压、净化、精脱硫(除脱除焦炉气中无机硫外,为去除有机硫,采用加氢转化法,将有机硫转化成易去除的H2S),甲烷化过程选用工艺成熟的绝热床反应器,在高温下迅速将焦炉煤气中的CO/CO2/H2转化为CH4。甲烷主要用作燃料和化工原料,是制备天然气的主要物质。而甲醇合成首先对焦炉煤气进行低压压缩,经净化工序将多余的CO2和硫化物脱除后得到甲醇合成气,然后将空气进行氮氧分离,其中氧气与甲醇合成气融合,再通过非催化(催化)转化技术,将CH4转化成CO和H2,最后经过压缩、合成等工序得到含水粗甲醇。在合成甲醇工序后的弛放气返回脱硫脱碳工序,继续制甲醇的工序,最后经过精馏工序精制得到产品甲醇。甲醇是优良的能源和车用燃料、清洁燃料。甲醇在众多化工合成反应中发挥重要作用。在低碳醇合成路线中,一种方法是,先经过焦炉煤气压缩,再进行CO/CO2加氢反应,该反应的关键步骤是:CO和H2解离、C—C偶联、CO插入、含氧中间体加氢等。反应生成的低碳醇不仅可作为燃料添加剂,还可作为替代燃料,低碳醇的合成是实现化石能源清洁高效利用、能源可持续发展的重要途径。另一种方法是,焦炉煤气先经过压缩粗脱硫后进入压缩机,然后对精脱硫后的气体进行低温冷凝,其中一部分气体进入脱氧反应器,经换热降温后进入变压吸附(PSA)提纯CO。粗煤气在PSA塔中进行吸附分离,而弱吸附组分CO则通过床层作为CO连续稳定输出,与甲醇和催化剂在羰基反应器中生成草酸二甲酯。经过脱硫压缩,气体分离的另一部分则是粗煤气通过PSA提纯H2,将过量的H2与草酸二甲酯反应生成乙二醇,再通过分离精制获得高纯度乙二醇。乙二醇在工业中主要作为溶剂,也可在日常生活中作为汽车冷却系统的抗冻剂。甲酸合成路线是CO气体、甲醇与催化剂混合后在羰基反应器中,在一定压力和温度下发生羧基化反应生成粗甲酸甲酯,经过精馏采出甲酸甲酯,最后利用甲酸甲酯的水解生成甲酸和甲醇。甲酸在日常生活中常用作消毒剂和防腐剂,还可用于制药和有机合成。

图1 焦炉煤气制化学品工艺流程
焦炉煤气制化学品包括甲烷、甲酸、甲醇及其他低碳醇等(图2)。甲烷化在300~450 ℃、4 MPa进行,活性组分主要为Fe、Co、Ni、Ru、Rh等第Ⅷ族过渡金属,其中Ni因具有相对较高的CO2甲烷化活性、成本较低被广泛用于甲烷化。焦炉煤气制甲醇在473~573 K、5~10 MPa进行。CO2加氢合成甲醇受温度、压力、碳氢比及催化剂等多方面影响,其中催化剂是影响甲醇合成的重要因素。甲醇合成催化剂包括Cu基催化剂、Pd基催化剂和其他催化剂。其中Cu基催化剂因具有高稳定性、高选择性、低成本、抗硫中毒等优点在CO2制甲醇过程中显示出独特的活性。低碳醇合成催化体系具有代表性的有4种:① 改性甲醇合成(MS)催化剂。包括改性高温甲醇合成催化剂和改性低温合成催化剂。改性高温甲醇合成催化剂:由高温高压合成甲醇催化剂ZnO/Cr2O3加入碱性助剂(如Cs、K等)改性制得。反应条件为温度约400 ℃、压力12~16 MPa,主要反应产物为甲醇、乙醇、正丙醇和异丁醇。改性低温甲醇合成催化剂在低温合成甲醇铜基催化剂(Cu/ZnO/Al2O3或Cu/ZnO/Cr2O3)中加入磁性助剂,反应条件为温度300~350 ℃、压力6~8 MPa,主要反应产物为甲醇和异丁醇。② 改性费托合成(FTS)催化剂。Fe基催化剂在典型反应条件250~300 ℃、3~6 MPa下,CO转化率为10%~70%、低碳醇选择性在5%~50%。Co基催化剂反应温度在220~300 ℃、压力3~5 MPa下进行。③ Rh基贵金属催化剂。负载型Rh催化剂中加入1~2种过渡金属或稀土金属氧化物助剂后,对低碳醇合成有较高的活性和选择性,特别对氧化物选择性较高,反应产物以乙醇为主。④ Mo基催化剂。Mo基催化剂耐硫,不易积炭,但该催化剂需较高反应压力,总醇选择性不高。催化反应条件为温度约300 ℃,压力为10 MPa。

图2 焦炉煤气制化学品
2 焦炉煤气制甲烷
焦炉煤气合成天然气是其生产甲烷的重要途径[4](图3)。焦炉煤气中含有微量焦油、苯、萘、氨、氰化氢、H2S等物质,因此先进行脱除苯、萘、焦油等杂质,然后进入气柜进行压缩,之后进行精脱硫工序,在此工序中加氢转化,将有机硫转化成易除去的无机硫,将硫净化。进入甲烷化工序,将大部分CO、CO2、H2经过甲烷化反应生成甲烷。可进行补碳操作,加入适量CO和CO2以增加转化率,增加LNG(液化天然气)产量。甲烷化反应是强放热反应,因此经过一段甲烷化后冷却进行二段甲烷化。最终甲烷化后的混合产品气体进行变压吸附(PSA)气体分离技术,将氢气与天然气分离。甲烷是最简单的有机物,具有高度可燃性,不但可作为日常生活中的清洁燃料,也是化工行业中的基础化工原料,如氢气、乙炔及甲醛等工业产品的制备。
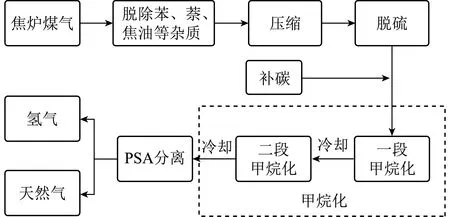
图3 焦炉煤气合成天然气工艺流程[4]
2.1 一般反应机理
甲烷化反应是费托合成中最简单的反应。焦炉煤气甲烷化过程中主要发生下列反应:
主反应:

(1)

(2)
副反应:

(3)

(4)

(5)

(6)
由甲烷化反应可知甲烷化反应为强放热反应。GHAIB等[5]利用Van′t Hoff方程计算反应的平衡常数K与温度的关系(图4)。可知除CH4裂解反应外,随温度升高,生成碳反应的平衡受抑制。由于K值较高,CH4可在较低温度下以高转化率产生,但形成不良副产物碳的方程(式(5))的K曲线介于二者之间。此外,随反应温度升高反应平衡常数呈下降趋势,但在低温条件下反应速率较低从而降低产物产率。因此,应综合考虑动力学和热力学等因素保持催化剂稳定性与选择性,选取合适的反应温度。

图4 甲烷化过程中可能反应的平衡常数随温度变化的自然对数[5]
CO甲烷化反应机理研究中,目前对于吸附态CO的解离方式及解离生成的中间物种并未形成统一认识,而被普遍接受的观点为表面碳机理。根据表面碳机理的第1步:CO中孤对电子易与活性金属中空轨道结合,形成强吸附态的CO(*),然后CO(*)在活性金属表面生成吸附态的表面碳C(*)和表面氧O(*)。第2步中:H2在活化中心生成活化H(*),表面碳C(*)与活化H(*)反应经多步加氢反应最终生成CH4。该反应机理很好地解释了CO脱氧加氢甲烷化过程[6]。

2.2 甲烷催化合成体系

Ni基催化剂在实际生产中具有价格低、性能稳定等优点。300~450 ℃,反应压力4 MPa时,转化率接近100%或超过95%,使其在甲烷化催化剂中成为主流催化剂。Ni基催化剂存在积炭现象易使催化剂失活,反应活性较贵金属催化剂低。对Ni基催化剂改良优化成为焦炉煤气甲烷化的关键,改良方法有添加助剂及选择合适催化剂载体等。
通过添加助剂可改善催化剂结构和表面性质,提高催化剂活性、选择性、抗毒性或稳定性。常用的甲烷化助剂多为稀土金属及其氧化物。LIU等[16]研究了CeO2助剂对于Ni/Al2O3甲烷化性能的影响,结果发现引入Ce可极大提高活性组分Ni的分散度,从而有效抑制镍铝尖晶石的形成,该催化剂在较低反应温度下(300 ℃),就可达到较高的催化反应效果,其中CO2转化率达90%,CH4选择性高达100%。卞玉芳[17]基于具有介孔纳米空心球状的Ni-Ce基催化剂,研究了Co、Cu、Mn金属的添加对该催化剂活性和甲烷选择性的影响。结果表明Co元素的掺入可提升催化剂活性,而Mn元素的添加收效甚微,甚至Cu元素的加入会使催化剂活性下降(图5)。同时,La2O3常作为助剂加入催化剂中,且取得较优异的催化效果。ZHI[18]研究了La2O3对Ni/SiC催化剂CO2甲烷化性能的影响,结果表明La2O能有效防止表面Ni的迁移和团聚,使催化剂具有较高的稳定性。其原因一方面可归结于活性组分Ni的分散度提高,另一方面La2O3可视为给电子体,促使Ni的d轨道上电子云密度提高,增强Ni的供电子能力。这种电子效应可削弱吸附在Ni上的C—O键,从而使反应速率加快。
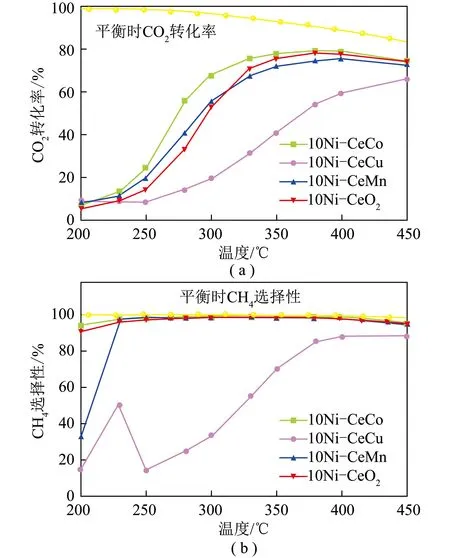
图5 不同掺杂金属的介孔Ni-CeM纳米空心球催化剂CO2甲烷化的催化性能[17]
甲烷化催化剂载体主要包括MgO、Al2O3、SiO2、TiO2、ZrO2等。TAKENAKA等[19]研究了上述5种不同载体负载Ni和Ru基的CO甲烷化催化性能,在相同反应条件下,以Ni为活性组分的活性顺序为:Ni/ZrO2>Ni/TiO2> Ni/SiO2>Ni/MgO>Ni/Al2O3;以Ru为活性组分的活性顺序为Ru/MgO>Ru/Al2O3>Ru/SiO2>Ru/ZrO2>Ru/TiO2。由此可知,载体选择对甲烷化催化性能具有重要影响。Al2O3因其低廉的价格被大规模应用于工业生产,其中γ-Al2O3提供的A13+和O2-,易与NiO中的Ni2+与O2-成键,从而促进Ni粒子均匀分散,防止Ni晶粒聚集长大,有利于形成较小Ni晶粒。然而Al2O3负载Ni催化剂高温焙烧后易形成具有较强金属载体相互作用的NiAl2O4,导致Ni还原性能下降。此外,高温环境会导致γ-Al2O3转变成α-Al2O3并降低Ni分散度引起催化活性下降,因此Al2O3载体适合在较低反应温度(约300 ℃)下进行。RAHMANI等[20]以γ-Al2O3为载体负载Ni基催化剂,探讨了不同Ni含量对催化剂性能的影响。研究发现,低负载量的Ni在催化剂表面分布更均匀,可形成高分散的小颗粒Ni粒子,而高负载量则导致Ni分散度降低,形成大颗粒表面Ni物种,从而降低催化活性。
SiO2比表面积很高,适用于CO甲烷化反应。FUJITA等[21]制备了SiO2负载Ni基催化剂,结果表明,相比CO2甲烷化反应,Ni/SiO2在CO甲烷化反应中催化活性较高。原因可能是载体SiO2与金属活性组分之间形成较强相互作用,有助于促进中间态含碳活性物种CHx的形成,从而提高反应速率。然而,由于SiO2通常为无定形形式,机械强度相对较低,易在强放热的甲烷化反应中发生烧结团聚,失活迅速。SHI等[22]采用浸渍法制备了Ni/SiO2催化剂,并考察了该催化剂等离子处理前后的甲烷化催化性能。经等离子处理的Ni/SiO2催化剂与未处理相比,因其NiO晶粒小,分散度大,从而具有很好的CO转化率及良好的抗积炭能力。
ZrO2热稳定性比较高,适合在比较高的温度下作为甲烷化催化剂载体。ZrO2属于立方萤石型结构,具有较大的自由体积空间,受到温度、压力和pH等影响,纯晶态ZrO2主要以单斜相(m-ZrO2)、四方相(t-ZrO2)和立方相(c-ZrO2)3种晶型存在(图6(a))。

图6 ZrO2不同晶型图以及催化性能对比[23]
常温条件下,ZrO2主要以单斜相存在,温度高于1 175 ℃时,以四方相形式存在,而温度高于2 367 ℃时,以立方相形式存在[23]。由于不同晶型的ZrO2配位不饱和中心、酸碱性质及氧空位不同,因此,不同晶型的甲烷化催化剂性能差异很大。四方相ZrO2负载的催化剂表现出较高的CH4选择性,而单斜相和立方相ZrO2负载的催化剂选择性相对较低,四方相ZrO2有利于提高催化剂性能且300 ℃为最佳反应温度(图6(b))。原因在于t-ZrO2拥有较大比表面积及Ni/t-ZrO2催化剂表面较多的酸性点位、酸强度促进了活性组分在载体表面的均匀分散。对于Ni基甲烷化催化剂,高温条件下可选择稳定性较好的ZrO2,低温条件下可选择成本较低的Al2O3,而对于焦炉煤气分离出纯度较高的CO气体可选择具有高比表面积、抗积炭性强的SiO2。目前对于Ni基催化剂积炭特性研究很多,工业化场景下相关研究仍较缺乏,甲烷化催化剂需与实际生产相结合,在工业化过程中做出相应调整。
3 焦炉煤气制低碳醇
3.1 焦炉煤气制甲醇
CO/CO2加氢催化转化为低碳醇不仅是焦炉煤气转化为高附加值化学品的重要途径,CO2加氢制甲醇被认为是减少全球变暖问题和促进经济可持续性的有前途的工艺之一[24],提高了钢铁生产全流程的资源利用效率。焦炉煤气中富含氢气,催化转化合成甲醇优势很大。甲醇是重要的基础化工原料,可进一步转化生成烯烃、芳烃、汽油等高附加值化学品,具有良好的应用前景。甲醇合成方法包括低压法、中压法和高压法。高压法和中压法的设备复杂且能源消耗大,钢铁企业内甲醇合成装置一般规模不大,即甲醇合成一般采用低压法。焦炉煤气首先通过脱萘系统,然后进入气柜,缓冲稳压后,进行焦炉煤气压缩工段[25](图7)。将焦炉煤气升压至2.5 MPa,先进行粗脱硫,经过综合加热炉后进行冷却进入精脱硫阶段,此阶段通常采用加氢转化法,将有机硫转换成易除去的H2S进行脱硫。精脱硫后焦炉煤气进入转化工段,在纯氧环境与催化剂的作用下,将煤气中的甲烷转换成CO与H2,控制出气口甲烷体积分数≤0.79%,达到甲醇合成气要求。甲醇合成过程的弛放气进行变压吸附回收CO与H2循环作甲醇原料气,以此降低每吨甲醇原料气消耗。得到的甲醇还需进行甲醇精馏,甲醇精馏普遍采用三塔精馏流程。从甲醇合成来的粗甲醇进入预精馏塔,塔底的甲醇液经加压精馏塔和常压精馏塔分离制得精甲醇。

图7 焦炉煤气制甲醇工艺流程[25]
3.1.1 一般反应机理
低压法条件下,甲醇合成在200~300 ℃、5 MPa下进行,通过CO/CO2加氢得到(式(7)、(8)),其中CO和CO2可由水煤气反应互相转化(式(9))。随温度升高,甲醇合成的平衡常数降低(图8(a)),吉布斯自由能增加(图8(b)),反应受到热力学限制。因此,高温条件下不利于甲醇合成,但若在低温下又会受到动力学限制。此外,压力对该反应也有重要影响。由于甲醇合成是体积减小的过程,提高压力有利于反应进行,但压力提升需满足设备需求。因此,温度和压力是甲醇合成过程中的2个重要因素。
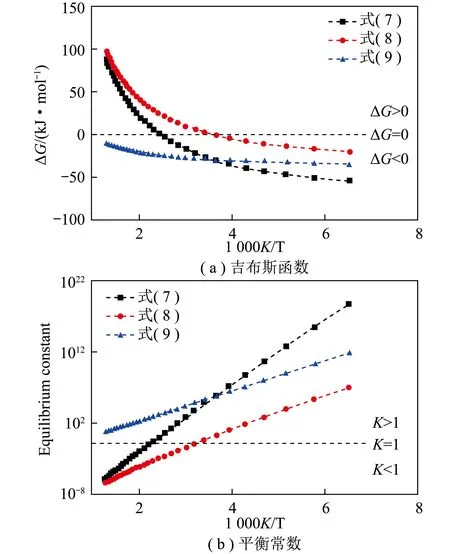
图8 温度对CO/CO2加氢和水煤气转化反应的吉布斯函数和平衡常数的影响[26]

(7)

(8)

(9)
虽然,铜基催化剂是作为甲醇合成的主流催化剂[27],但反应机理有待进一步论证。目前争议主要体现在以下3方面:① 甲醇合成碳源是CO、CO2或二者;② 甲醇合成中间体是甲酸盐或碳酸氢盐;③ 甲醇合成催化剂的活性中心是金属Cu或Cu+、Cu-ZnO界面或Cu-Zn合金。在早期,HERMAN[28]认为CO是唯一碳源,CO2通过逆水煤气反应转化为CO,从而提出CO加氢合成甲醇路径:CO→HCO*→CH2O*→CH3O*。在CO-H2-CO2气氛中,CO加氢过程中甲醇合成的速率明显高于CO2加氢速率,在CO2∶CO∶H2=2∶28∶70(体积比)[29]时甲醇生成速率最大。STUDT等[30]认为CO2是主要碳源,CO2加氢生成副产物H2O,CO与H2O水煤气转化生成新的CO2继续加氢进行甲醇合成,CO2加氢合成甲醇路径:CO2→HCOO*→HCOOH*→CH3O2*→CH2O*→CH3O*。CHINCHEN等[31]将14C标记的CO或CO2气体添加到合成气中进行同位素标记,通过调节反应气体中p(CO2)/p(CO)分压比例进行甲醇合成试验。p(CO2)/p(CO)分压比值由0.02增至1.00时,通过CO2加氢路径得到的甲醇比例由70%上升至100%,证明在工业条件下(p(CO2)/p(CO)>0.2)甲醇合成的主要碳源是CO2。LIU等[32]通过DFT计算和KMC模拟CO/CO2加氢在Cu(111)和Cu2O(111)上甲醇合成机理,指出甲醇合成过程中的碳源主要取决于催化剂表面铜的价态,催化剂表面活性主要为Cu+时,CO是合成甲醇的主要碳源;表面大量存在Cu0物种时,CO2是主要碳源。
WEIGEL等[33]认为甲醇合成反应中间体为甲酸盐,甲酸盐加氢转化成甲氧基(H3CO*)或甲醛(H2CO*),最终实现甲醇合成。而GRAEME等[34]则认为中间物种是碳酸根离子,碳酸根离子经脱氧或加氢转化为甲酸盐。总之,普遍认为甲酸盐是甲醇合成过程中不可或缺的中间体。然而,甲醇合成过程中活性位点目前说法不一,大致分为2类。早期研究甲醇合成中,认为Cu是Cu/ZnO/Al2O3催化剂的唯一活性位点,对于铜的价态产生争论:① 表面金属Cu位点是活性位点[35],PAN等[36]认为催化剂的活性与金属Cu表面积有直接关系。② 反应发生在处于氧化态的Cu+上[37],SAKAHARA等[38]通过对金属铜、银、金、铂等进行DFT表征,从本质上证实了活性中心为Cu+。近年来,随着对Cu/ZnO/Al2O3研究,ZnO在Cu/ZnO/Al2O3催化剂中的作用受到重视[39],单金属Cu催化活性非常低,将ZnO加入Cu组分后,活性得以极大提升,Cu和ZnO之间表现出明显的协同效应。一种观点认为ZnO与金属Cu形成金属-氧化物界面[40],降低了甲醇合成的反应能垒。KATTEL等[39]直接对比Zn/Cu(211)和ZnO/Cu(111)模型催化剂合成甲醇的反应活性。CO2加氢反应条件下,ZnCu表面发生氧化,表面金属Zn转化为ZnO,ZnCu模型催化剂的性能最终达到相同Zn原子覆盖度的ZnO/Cu水平,DFT计算结果表明在ZnO/Cu(211)表面合成甲醇的反应能垒比ZnCu(111)低得多(图9,ts、ts′均为反应过渡态,黑线ts为CO2经过逆水煤气反应生成CO然后加氢到甲醇的路线,蓝线ts′为甲酸加氢到甲醇路线)。另一种观点认为部分还原的ZnOx与金属Cu形成高活性的Cu-Zn表面合金[41]。FUJITANI等[42]研究了Cu/ZnO催化剂中ZnO组分对CO2加氢合成甲醇反应的影响。H2还原过程中明显观察到Zn原子向金属Cu表面迁移,从而形成甲醇合成活性位点(Cu-Zn表面合金)。此外,甲醇合成中碳氢比与生产效率直接相关。过大的碳氢比会减少催化剂活性,过小的碳氢比会增加催化剂活性,造成能耗损失,影响甲醇生产效率。因此,甲醇合成需合理氢碳比例,理论上氢碳比(H2-CO2)/(CO+CO2)为2,实际生产过程要求H2过量,氢碳比最佳为2.05~2.10。

图9 ZnCu(211)和ZnO/Cu(111)表面CO2加氢合成甲醇反应势能[39]
3.1.2 甲醇催化合成体系
甲醇合成催化剂主要有Cu基催化剂、Pd基催化剂和其他催化剂。目前工业上甲醇合成通常采用Cu/ZnO/Al2O3催化剂,Cu/ZnO/Al2O3催化剂合成甲醇的条件是473~573 K、5~10 MPa。Cu基催化剂具有比表面积较大、活性组分高度分散等优点,将活性组分负载在A12O3、ZrO2、Ga2O、SiO2、TiO2等[39,43]载体上,并加入Na、Cs、Ag、Ca、La、Fe、Mn等助剂[44]可获得高性能催化剂。Cu/ZnO/Al2O3催化剂的催化性质由各组分含量和制备方法等因素决定。XIAO等[45]采用共沉淀方法在中性条件下制备了一系列不同组成的Cu/ZnO/Al2O3催化剂,并考察了Cu、ZnO和Al2O3三种组分比例对催化剂结构和反应性能的影响。Cu和ZnO组分比例对催化活性起决定性作用,同时对稳定性也有一定影响。综合考虑活性和稳定性,确定2.8 ≤n(Cu)/n(Zn) ≤ 3.0和10 ≤n(Al) ≤ 12是Cu/ZnO/Al2O3最佳组分物质的量配比。尖晶石结构材料具有良好的稳定性和可控的微观结构,将Cu负载在ZnFe2O4尖晶石中,可根据Cu/Zn和Zn/Fe物质的量比调节Cu纳米颗粒大小,与相同工艺制备的Cu/ZnM-0.5(M=Co、Ni、Sn、Cr、Al、Ga和Mn) 催化剂比,Cu/ZnFe-0.5催化剂甲醇合成性能更好:在260 ℃和4.5 MPa下表现出71.6%的高甲醇选择性和9.4%的CO2转化率[46]。
Cu基催化剂的活性与Cu+物种在催化剂表面稳定存在相关性,通过加入钾助剂稳定表面Cu+物种提高催化剂活性。WANG等[47]比较了不同氧覆盖度下催化剂活性,发现Cu (100) 表面氧的覆盖度与反应活性之间存在火山型关系,说明表面Cu+/Cu0物种的比例控制着催化剂的活性。SUN等[48]在220 ℃、3.0 MPa和WHSV=6 000 mL/(g·h) 条件下进行甲醇合成。采用共沉淀法制备不同ZrO2含量的Cu-ZnO-ZrO2催化剂(CuZnxZr,x表示ZrO2物质的量分数),结果表明CuZn10Zr催化剂性能最佳,CO2转化率为14.0%,甲醇选择性为54.4%。相关表征证明其具有最优的催化性能是因为Cu活性位点具有较好的分散性,n(Cu+)/n(Cu++Cu0)(n为物质的量)较高,氧空位较多及ZrO2载体碱度较强。根据催化反应性能和表征,提出了CO2在CuZn10Zr上加氢合成甲醇的双活性位模型及反应机理(图10)。H2分子在Cu0位点上发生吸附和解离,而CO2则吸附在Cu-ZnO或Cu-ZrO2界面的碱位点上,经活化后的H*物种迁移到Cu-ZnO或Cu-ZrO2界面,与CO2反应生成HCOO*再加氢生成甲醇。
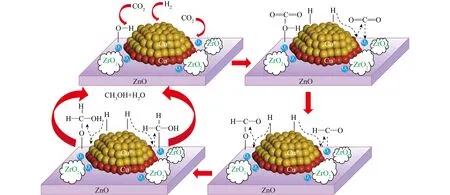
图10 CuZn10Zr催化剂上CO2加氢制甲醇的反应机理[48]
为提高Cu/ZnO/Al2O3催化剂性能,可通过加入ZrO2、Ga2O3、CeO2、MgO和Cr2O3等金属氧化物[49-50],调节Cu/ZnO表面的碱度增强对CO2及相关中间物种的吸附,同时提高Cu组分的分散度和稳定性。LI等[51]研究Ga2O3在改性Cu/ZnO催化剂中的作用,结果表明,除Ga2O3结构促进作用外,Ga2O3还促进了ZnO深度还原为Zn0,并在还原后形成CuZn合金,催化活性和甲醇选择性的提高可能与ZnO浓度增加有关。胡菊等[52]考察了CeO2含量对Cu/ZnO/Al2O3催化剂结构和反应性能的影响。加入适量CeO2可提高Cu和ZnO组分的分散度,同时增大催化剂比表面积。此外,CeO2增强了Cu/ZnO/Al2O3的热稳定性。Pd和Au等贵金属的加入对甲醇合成也有明显促进效果[53-55]。HU等[53]发现加入少量Pd可使Cu/ZnO的空时收率提高2.5倍,甲醇转换频率提高3.5倍;动力学研究表明,Cu/ZnO中掺杂一定量Pd可大幅降低甲醇合成所需活化能,有助于表面吸附H2的活化。MARTIN等[54]证明引入少量Au贵金属可提高金属Cu的电子稳定性。除添加的助剂,甲醇本身也可能在Cu/ZnO/MgO催化剂上起促进剂的作用,由于反应物蒸汽中存在少量甲醇,表观活化势垒明显降低(由117.9 kJ/mol降至67.9 kJ/mol)[56]。
Pd基催化剂(Pd/ZnO[57]、Pd/Ga2O3[58]及Pd/In2O3[59])在CO/CO2加氢合成甲醇中显示出优异的催化性能[60],其中一部分Pd基催化剂的活性中心实际上是金属Pd和氧化物载体在还原过程形成的金属间化合物。因为其电子结构,尤其是d带电子结构与铜相似[61],表现出与铜基催化剂相近或更高的活性。CHORKENDORFF课题组合成了负载在SiO2载体上的GaPd2金属化合物催化剂[62],在常压下,活性通常是Cu/ZnO/Al2O3催化剂的1.6倍以上(图11(a)),205~210 ℃时(此时对应CO2转化率最高的条件),该催化剂甲醇的选择性是Cu/ZnO/Al2O3催化剂的2倍(图11(b))。一般情况下,利用ZnO等改性后,甲醇选择性达70%以上[63],这种促进作用可能是由于金属Pd和PdZn合金团簇混合物的形成,有利于CO2活化和甲醇的形成。

图11 反应温度对GaPd2/SiO2和Cu/ZnO/Al2O3催化剂活性和甲醇选择性的影响[62]
除Cu、Pd基催化剂外,氧化物负载的Au、In、Ni等催化剂在合成甲醇中因具有优异的催化活性而受到关注。HARTADI等[64]制备Au/ZnO催化剂,在活性组分负载量相同的情况下,因为Au/ZnO催化剂能抑制CO2发生逆水煤气(RWGS)反应,所以该催化剂合成甲醇选择性明显高于工业催化剂。CONVERSION等[65]通过向Ni中加入MnO2光热CO加氢制取轻烯烃,再与水分子水合制低碳醇。该方法中MnO2的加入降低了烯烃在Ni表面的吸附能,从而最大限度减少对轻烯烃的不良深度加氢反应。该催化剂在紫外可见光照射下,烯烃选择性仅33.0%,仍需进一步研究。近年来,In2O3基催化剂在CO2多种催化转化中表现出高活性和选择性。2013年,天津大学刘昌俊教授团队与美国南伊利诺伊大学葛庆峰教授[66]发表研究论文:利用周期性密度泛函理论计算证明:具有氧空位的氧化铟催化剂对CO2加氢合成甲醇具有很高的选择性,尤其在较低反应温度条件下,甲醇选择性可达100%。氧空位在CO2的活化和所涉及关键中间体稳定中起关键作用,添加贵金属可促进氧空位的形成和H2的活化。该团队通过沉淀浸渍法制备In2O3负载的Ir催化剂,其比表面积为68 m2/g,在300 ℃、5 MPa下,H2/CO2体积比为4时,表现出优异的甲醇选择性和稳定性[67];Ir和In2O3之间的相互作用取决于催化剂结构,Ir高分散,可稳定氧空位和避免In2O3的过度还原。在In2O3上负载的Ni[68]、Pt[69]、Au[70]和Ru[71]也可得到类似效果。虽然关于贵金属催化剂的研究取得了一些进展,但与Cu基催化剂相比,这些催化剂在活性和选择性上并未大幅提升,且贵金属催化剂昂贵,目前仍无法取代Cu基催化剂在工业甲醇合成中的应用。
3.1.3 甲醇衍生物:甲酸的催化合成
近年来,随环境保护和新能源领域发展,甲酸应用进一步扩大。随新能源快速崛起,由于甲酸盐(如甲酸钠、甲酸钙)环境友好性,可代替传统无机盐用作融雪剂,甲酸用途日益显现。研究表明,甲酸是良好的氢载体,附加值较高,可作为甲酸盐电池原料及储氢材料。此外,甲酸是一种重要化工原料,广泛应用于皮革、制药、农业、橡胶、织物等领域。
甲酸制备过程中副产物产物为C、CH4和CH3OCH3等(表1),因其副反应的吉布斯自由能远小于0,使目标甲酸反应式竞争更激烈,很难合成纯甲酸,工业合成中常通过合成甲酸衍生物(如甲酸盐、甲酸酯、酰胺)等达到甲酸转化目的。工业合成上常通过甲酸甲酯水解法制备甲酸,不消耗宝贵氢气。

表1 CO2氢化反应体系的常规热力学参数
甲酸甲酯水解法制备甲酸分2步进行:第1步,甲醇和CO在甲醇钠为催化剂下进行羰化反应,生成甲酸甲酯。第2步,在甲酸自催化作用下,甲酸甲酯于90~140 ℃、0.5~1.8 MPa条件下水解为甲醇和甲酸,随后经分离精制获得甲酸,甲醇则返回系统。最终,通过甲酸与水共沸,及真空分离,可得到100%纯产品。该方法所获产品为单一甲酸,无副产物,具有流程短、原料易得、无三废、产量大、生产成本低等特点,但一次性投资太大。甲醇和CO的液相羰基化反应方程式如下:

(10)
甲酸甲酯水解法的催化剂为碱催化剂甲醇钠,在工业上多将甲醇和金属钠以物质的量比2∶1加入反应釜中。加入适量反应溶剂(如甲苯),加热至反应温度120~140 ℃,甲醇与钠发生醇化反应生成甲醇钠。甲醇钠易将甲醇的O—H键活化,形成甲氧基离子,该离子再与CO发生亲核反应完成羰化,该反应机理由CHRISTIANSEN在1942年提出,这一理论得到后续动力学研究的支持。在众多甲酸合成工艺中Kemira-Leonard工艺是目前应用较广泛的甲酸工业制备方法,工艺流程如图12所示。

图12 Kemira-Leonard工艺流程
该工艺中CO在80 ℃、4.1 MPa及甲醇钠为催化剂条件下,经羰化反应器生成粗甲酸甲酯。再将反应得到的粗甲酸甲酯和少量催化剂经闪蒸排放到甲酸甲酯塔,经预反应器得到精制甲酸甲酯同时生成少量所需甲酸。再在120 ℃、0.9 MPa,甲酸为催化剂条件下经主水解器将甲酸甲酯水解。反应达到平衡后,反应产品在闪蒸器中常压快速闪蒸,闪蒸出来的大量未反应甲酸甲酯和少量甲酸循环到反应器,待液体冷却后进入甲酸分离塔,残余甲酸甲酯迅速与甲酸和水减压分离。馏出物在循环塔中与分离循环后的甲酸溶液进入产品塔进行加压蒸馏分离,分别得到质量分数80%和90%左右的甲酸产品。该工艺特点是采用醇盐系催化剂,可大幅减低反应压力。水解在140 ℃、1.0~1.8 MPa较高温度和压力下形成均相体系,避免使用溶剂萃取,同时较高温度和压力可有效抑制甲酸再酯化。此外,在减压条件下蒸馏可缩短甲醇与甲酸接触时间,防止再酯化。
3.2 焦炉煤气制其他低碳醇
由于醇中存在氧原子,低碳醇的燃烧比汽油和柴油更彻底。同时释放的气体中有害物质较少,是一种环保燃料。目前制备低碳醇方法缺点很多,以乙醇为例,乙醇工业生产主要包括发酵和化学合成2种方法,发酵合成方法不仅造成严重的环境污染,还消耗大量粮食作物;化学合成需大量硫酸,造成设备腐蚀严重,导致生产成本高。焦炉煤气在钢铁产业中可大量提取,且价格低廉。焦炉煤气源自冶金行业的炼焦尾气,主要原料为煤。然而,从原料成本来看,焦炉煤气实际上是焦化生产过程中的副产品,因此相对容易获取,且能实现资源综合利用,将废转化为宝,响应国家减排政策的号召。焦炉煤气制乙二醇技术在能源消耗上具有一定优势,特别是如果焦化厂附近存在余热或废气可以利用[72]。相比之下,煤制乙二醇涉及到煤的运输,需占用大量土地,且在制浆过程中可能导致环境污染。而焦炉煤气制乙二醇相对煤制乙二醇,所需空气和锅炉规模较小,且使用的设备较少。综合来看,与煤炭制备乙二醇相比,焦炉煤气制乙二醇技术在经济性和工艺路线方面具有一定优势。
3.2.1 一般反应机理
低碳醇生成主要包括如下关键步骤:CO和H2解离、C—C偶联、CO插入、含氧中间体加氢等[73](图13)。CO在活性位点表面吸附、解离、加氢形成CHx*物种;CHx*经过C—C偶联形成C2Hy*,并进一步与CHx*结合形成长链CnHz*(n≥ 2)中间体(图13黑色路线);而相邻活性位点上非解离吸附的CO*可插入CnHz*物种中形成酰基(CnHzCO*)物种,其进一步加氢生成C2+OH(图13绿色路线)。此外,作为平行反应,CnHz*物种也可能直接从催化剂位点上脱附形成烯烃CnH2n或直接加氢形成烷烃CnH2n+2(图13蓝色路线)。非解离的CO*也可直接加氢形成甲酰基并进一步加氢形成甲醇;甲酰基也能与临近位点上的CHx*物种结合形成C2含氧中间体CHxCHO*并继续与CHx*结合生成更长链的含氧中间体,最后加氢形成C2+OH(图13红色路线)。低碳醇合成相较甲醇合成与费托合成具有一些相同的表面反应,但三者催化性质与反应过程不同。甲醇合成催化剂是在C—O键保留的表面非解离吸附,而费托合成催化剂是在C—O键断裂的表面解离吸附。由于催化剂活性位点的电子和物理化学特性不同,前者导致含氧化合物的形成,后者导致烃链生长。低碳醇合成催化剂的设计想法是对这2类活性组分进行优化组合。低碳醇合成要求催化剂具有双重功能,即解离吸附和非解离吸附的活性位点[75]。因此,增加催化剂上的双活性中心数量并使其含量达到一定平衡是提高催化剂活性的关键。如何在纳米甚至原子尺度上构建具有高活性和稳定性的双活性中心,成为研究热点。同时,氢碳比也是低碳醇合成的影响因素。原料气总压一定时,氢碳比变化会引起H2和CO分压的变化,对低碳醇合成中不同反应的影响不同。低碳醇合成速率随CO分压的升高而加快,但由于低碳醇合成过程受到水的强烈抑制,因此较低的氢碳比有利于移去水的水汽变换反应向正向进行,即低碳醇合成的最佳氢碳比小于2。

图13 CO加氢生成低碳醇、甲醇、烃类的反应路径[73-74]
3.2.2 低碳醇催化合成体系
目前,CO/CO2加氢合成低碳醇的催化剂大致分为4类:改性费托合成催化剂[76-77]、Cu基改性甲醇合成催化剂[78]、Mo基贵金属催化剂[79-80]、Rh基催化剂[81]。图14总结了过去10 a发表的CO/CO2加氢制低碳醇相关研究中CO/CO2转化率与低碳醇选择性的关系。若以低碳醇的收率为评价指标,性能排序为:改性费托合成催化剂(其中,以CuFe和CuCo为代表)>Mo基催化剂≈Rh基催化剂>Cu基改性甲醇合成催化剂[82]。改性费托合成催化剂被认为是较有应用前景的低碳醇合成催化剂体系。改性费托合成催化剂是在传统费托合成催化剂(Fe基、Co基催化剂)中加入碱金属(Li、Na、K、Cs等)或过渡金属(Mn、Mo等)。Fe基催化剂合成低碳醇反应条件通常在250~300 ℃、3~6 MPa、H2/CO体积比1~2条件下进行。Fe基催化剂因具有价格低廉、储量丰富、适用于不同H2/CO比例的合成气等优势而受到广泛关注。目前Fe基催化剂按活性位种类可分为Fe基单金属催剂、双金属催化剂和多金属催化剂。CuFe催化剂在CO2加氢制低碳醇中表现出更高的低碳醇收率(图11(b)),其活性位点通常被认为是临近的金属铜(Cu0)和碳化铁(FexC),FexC被认为有利于CO解离和C—C偶联,Cu0则有利于CO非解离吸附和插入[83]。

图14 CO/CO2加氢制低碳醇催化剂中低碳醇选择性与CO/CO2转化率的关系[82]
Co基催化剂作为另一类重要低碳醇合成催化剂。Co基催化剂合成低碳醇反应条件通常在220~300 ℃、3~5 MPa、H2/CO体积比1~2条件下进行。Co基催化剂因储量高、低成本、碳链增长能力强、水煤气变化不敏感及醇选择性较高等优势,得到广泛研究。Co基催化剂按活性位种类可分为Co基单金属催剂、双金属催化剂和多金属催化剂。单金属Co0-Cox+催化剂有利于低碳醇形成,包括金属钴-碳化钴(Co0-Co2C)、金属钴-氧化钴(Co0-CoOx)2类。Co2C被证明可促进CO非解离吸附和插入。中国科学院大连化学物理研究所丁云杰和李薇雪等[84]根据密度泛函理论(DFT)对比Co2C(111)晶面和面心立方的金属Co(100)晶面上CO的吸附能和CO解离的活化能,表明CO在金属Co0上更易解离吸附,而在Co2C位点上则易发生非解离吸附。双金属CuCo催化剂比单金属Co0-Cox+催化剂有更高的低碳醇选择性和收率[85]。双金属CuCo催化剂的研究可追溯至1978年,法国石油研究所首先开发了Cu-Co共沉淀催化剂。Cu-Co催化剂合成低碳醇反应条件为300 ℃、6.0 MPa,该催化剂的Cu/Co原子比约1,由1~3种过渡金属氧化物作为载体或助剂。对该催化剂改性研究主要包括2方面:活性组分Cu和Co的比例及2个活性中心的分布。原子尺度混合的活性组分Cu和Co可显著提高二者协同效应从而提高低碳醇的选择性。PRIETO等[86]采用理论计算和微动力学模型研究Cu-Co比例对低碳醇合成的影响(图15)。通过计算不同Cu-Co比例(3/0、2/1、1/2、0/3)下的甲烷、甲醇和乙醇选择性,发现表面富Co的CuCo合金结构更有利于乙醇的形成。随后通过XRD和XPS监测了CuCo合金相的变化和表面Co的还原程度,发现Cu/(Cu+Co)原子比为0.3时,总醇的时空产率最高。一般认为Cu-Co催化剂合成低碳醇具有2类活性中心,其中Co用于CO的解离吸附生成烷基链(图13黑色路线),Cu用于CO的非解离吸附氧化烷基链(图13红色路线),2种活性中心共同作用生成低碳醇,目前CuCo催化剂对低碳醇的选择性和收率分别达50%和20%以上。

图15 通过DFT计算和微动力学模型预测的甲烷、甲醇、乙醇选择性随催化剂中单金属Cu位点、单金属Co位点、CuCo合金位点相对比例的变化趋势[86]
CuCo合金的相分离是导致CuCo催化剂失活的主要原因。为增强Cu-Co之间的相互作用,促进CuCo表面合金的生成并提高其在反应过程中的稳定性,研究者尝试以LDHs等多种前体制备催化剂。北京化工大学卫敏课题组[87]以Al2O3为基质,在其上原位生长CuCoAl-LDH纳米片,随后经焙烧、还原获得了核壳型结构的Cu@(CuCo-合金)/Al2O3催化剂(图16),该催化剂合成低碳醇条件在220 ℃、2 MPa、H2/CO体积比2下进行,Cu/Co原子比为1/2时,CO转化率为21.5%,总醇选择性为50.6%,催化剂性能最优,优异催化性能源于纳米颗粒中Cu和Co之间独特的电子和几何相互作用。层状双金属氢氧化物(LDHs)具有独特结构。金属阳离子可在原子水平上分布到氢氧化物层中。作为高级醇合成的催化剂前驱体受到广泛关注,北京化工大学卫敏、北京大学马丁和中国科学院金属研究所张炳森等[88]多团队合作,报道了一种由Cu4Fe1Mg4层状双金属氢氧化物(Cu4Fe1Mg4-LDH)前驱体衍生的Fe5C2-Cu界面催化剂,催化剂即使在低压(1 MPa)下也展现出53.2%的CO转化率,优于大部分CuFe催化剂在高压(≥3 MPa)下的性能。此外,碱金属助剂对Cu-Co催化剂的活性和选择性也有很大影响,COSULTCHI等[89]制备了掺杂不同碱金属的Co/Cu/Cr催化剂,结果发现Na的掺杂有利于醇类生成,产物中醇选择性为34%,略高于烃类选择性。载体对产物分布也有重要影响,如负载在MgO上的催化剂主要生成甲醇;负载在TiO2、CeO2或La2O3上的催化剂主要生成烃类;而负载在ZrO2、SiO2和Al2O3上的催化剂醇选择性较高。

图16 核壳型Cu@ (CuCo-合金)/Al2O3催化剂在原位生长焙烧和还原过程中物相演变过程[87]
改性甲醇合成催化剂包括改性低温和改性高温催化剂。改性高温甲醇合成催化剂最早是由意大利Snam公司开发的高温Cr基催化剂,高温Cr基催化剂合成低碳醇反应条件在350~400 ℃,7~10 MPa,H2/CO体积比2.3~2.5下进行[90],反应产物中甲醇和异丁醇占比较大。改性低温甲醇合成催化剂最早由德国的Lurgi公司开发,低温催化剂(Cu/ZnO/Al2O3、Cu/ZrO2和Cu/CeO2)合成低碳醇反应条件在250~300 ℃,1~5 MPa,H2/CO体积比1.0~2.5下进行。加入助剂Co后,得到直链醇,尤其是乙醇。改性甲醇合成催化剂的改性可通过添加碱金属实现。催化剂表面(包括载体)的酸性会导致一些副反应,尤其是醇脱水。通过碱金属对表面酸性的改性,可抑制副反应,促进链增长,提高醇选择性。适量添加碱金属可减弱碳氧键,导致CO离解,从而促进碳链增长。然而,添加碱金属必须适量,因为过量的碱金属会导致醇产率和C2+OH比例明显下降。主要原因是CO解离吸附过多会导致大量积炭。不同碱金属对低碳醇合成的选择性提高作用有所差别,但基本规律为Cs>Rb>K>Na>Li[91]。目前对K和Cs的研究较充分。SUN等[92]研究了碱金属K和Cs对Cu/Zn/Al2O3催化剂的影响。结果显示K对醇的生成影响不大,而过量K反而会抑制CO转化。碱金属过量时,会覆盖Cu活性位点并降低催化剂比表面积。Cs的添加能促进CO转化和醇的生成。在5.4 MPa、290 ℃、1 875 mL/(g·h)反应条件下,Cs促进的最优催化剂可使CO转化率达41.6%,C2+OH选择性为24.9%。Cs的促进作用是因为其能稳定中间物种HCO*和H2CO*。
Mo基催化剂反应条件苛刻,Mo基催化剂合成低碳醇反应条件在高温280~320 ℃、高压5~8 MPa下进行,但其水煤气变换活性高,耐硫性好,可减少焦炉煤气脱硫脱水的生产成本。催化体系对于反应气氛中S有较强的抗中毒作用且不易结炭,醇选择性也较高。单金属Mo基催化剂活性差,产物中C2+OH收率低,烷烃为主要产物。因此,通常采用活性炭、Al2O3等载体,并添加碱性金属(Fe、Co、Mn)提高醇的选择性。醇生成的活性位点[93]是Mn0-2+-Mn4-5+双活性位,其中低价态的Mn0-2+是CO解离吸附活性位,高价态的Mo4-5+是CO非解离吸附活性位,二者协同作用可促进醇的生成。因为Mo基催化剂中含有硫,所以反应所得气相产物和液相产物含硫,不易直接利用。此外,Rh基催化体系具有良好的CO2/H2活化和催化C—C偶联能力,为提高催化剂活性可通过添加1~2种过渡金属或稀土金属氧化物助剂实现。醇的活性位通常是Rh0-Rh+双活性位点。其中Rh0是CO解离吸附活性位,Rh+是CO非解离吸附活性位,故在低碳醇合成中具有优异性能。但Rh化合物价格昂贵,催化剂易被CO2毒化,不适宜大规模工业化。低碳醇合成催化剂催化性能具有以下特点:改性费托合成Cu-Co催化剂反应条件温和,活性和选择性较高,但副产物选择性较高;改性甲醇合成催化剂总醇选择性太低;Mo基催化剂反应活性较高,不易积炭,寿命长,但总醇及醇选择性低;Rh基催化剂价格昂贵,不适合工业化。
4 结语及展望
钢化联产利用冶金煤气合成甲烷和低碳醇等化学品是实现钢铁碳中和的重要途径。其中甲烷化催化剂以Ni基催化剂为代表;甲醇合成催化剂以Cu/Zn催化剂为代表;低碳醇合成催化剂以改性费托合成Cu-Co催化剂为代表。此外,都需对焦炉煤气进行深度净化处理,以满足工艺要求,焦炉煤气合成甲酸不需消耗宝贵氢气,开发意义较大。工业化过程中还需综合考虑这些产品的生产成本和市场价格优势等因素决定所选用催化合成路线。
冶金煤气中可能含一些中毒物质,如硫化物、氯化物等,这些物质可能对催化剂产生毒性影响。通过选择热稳定性良好的载体材料以保证催化剂的稳定性和活性;通过优化催化剂表面结构和活性位点分布,提高其对中毒物质的吸附能力,减少中毒物质对活性位点的占据;还可考虑催化剂再生,延长催化剂使用寿命和稳定性。综合考虑,可设计具有较高抗性的催化剂,有效应对冶金煤气中的中毒物质。
目前,需对钢铁全流程总体热平衡和煤气平衡计算评估,将冶金余热回收利用规模与钢化联产流程反应所需能量进行系统性测算,通过合理规划钢化联产过程中能质匹配,最终实现最大限度减排及钢铁工业可持续发展。未来,以钢化联产为技术纽带,将新型钢铁工业生态链与化工行业可持续发展生态链结合,能促进我国“双碳”战略目标的实现。

