糖尿病肾病合并高尿酸血症风险预测模型的构建与验证
潘鹭娜
中国人民解放军陆军第七十三集团军医院检验科,福建省厦门市 361000
糖尿病肾病(DKD)是糖尿病主要微血管并发症,是慢性肾病和终末期肾病的重要原因[1]。随着老龄化社会的加速到来,DKD发病率呈逐年上升趋势,是一个不容忽视的公共卫生问题。DKD与高尿酸血症(HUA)的发生密切相关,DKD患者代谢能力降低,导致UA蓄积,引起HUA。其次,HUA可引起肾结石、痛风、肾功能不全并加重糖代谢障碍,进一步导致肾脏损伤。DKD合并HUA患者临床症状不典型,患者往往忽视其风险,导致诊断不及时,进而影响治疗效果,因此研究DKD患者合并HUA影响因素并构建风险预测模型,对于提高患者和临床重视程度,及时发现潜在高风险患者,及早进行干预,改善患者预后有一定价值。本研究基于二元Logistic回归分析,并构建风险预测模型,以期为临床判断DKD合并HUA风险提供有效评估依据,具体研究如下。
1 对象与方法
1.1 研究对象 选取我院诊断和治疗的DKD患者212例,平均年龄(65.12±6.75)岁,其中男126例,女86例。DKD诊断标准:符合《中国糖尿病肾脏疾病防治临床指南》[2]中相关标准。排除标准:服用降低UA的药物、合并有痛风、恶性肿瘤、严重肝胆系统疾病。
1.2 方法
1.2.1 分组:根据《高尿酸血症和痛风治疗的中国专家共识》[3]中HUA标准(男性血UA>420μmol/L;女性血UA>360μmol/L),将所有研究对象分为合并HUA 93例,非HUA 119例,分别编号,采用随机数表法按照7∶3的比率抽取148例患者(包含HUA65例,非HUA83例)构成建模组,剩余患者组成验证组(包含HUA28例,非HUA36例)。
1.2.2 临床资料收集:收集所有研究对象人口资料和第一次检验结果,包括年龄、性别、是否合并高血压、糖尿病病程、空腹血糖(FPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、总甘油三酯(TG)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)、游离的三碘甲状腺原氨酸(FT3)、游离的四碘甲状腺原氨酸(FT4)、促甲状腺激素(TSH)、尿酸(UA)、C反应蛋白(CRP),根据CKD-EPI公式计算肾小球滤过率(e-GFR)。
1.2.3 模型构建:通过单因素分析筛选DKD合并HUA潜在风险因素,二元Logistic回归分析对潜在影响因素予以确认,基于二元Logistic回归分析原理,构建风险预测模型,并对模型在建模组、验证组预测效能进行评价。

2 结果
2.1 DKD合并HUA单因素分析 建模组DKD合并HUA患者TG、糖尿病病程、HbA1c、TSH、UA、CRP均高于非HUA患者,差异有统计学意义(均P<0.05),两组间其余指标差异无统计学意义(均P>0.05),见表1。

表1 建模组DKD合并HUA单因素分析
2.2 DKD合并HUA多因素分析和风险预测模型的构建 将单因素分析中有统计学意义的指标纳入二元Logistic回归分析。二元Logistic回归分析显示:TG、糖尿病病程、HbA1c、TSH、CRP均为DKD合并HUA的独立影响因素(见表2)。根据二元Logistic回归分析原理,构建风险预测模型:P=1/{1+exp[-(-9.344+0.828×TG+0.287×糖尿病病程+0.196×HbA1c+0.102×TSH+0.442×CRP)]}。
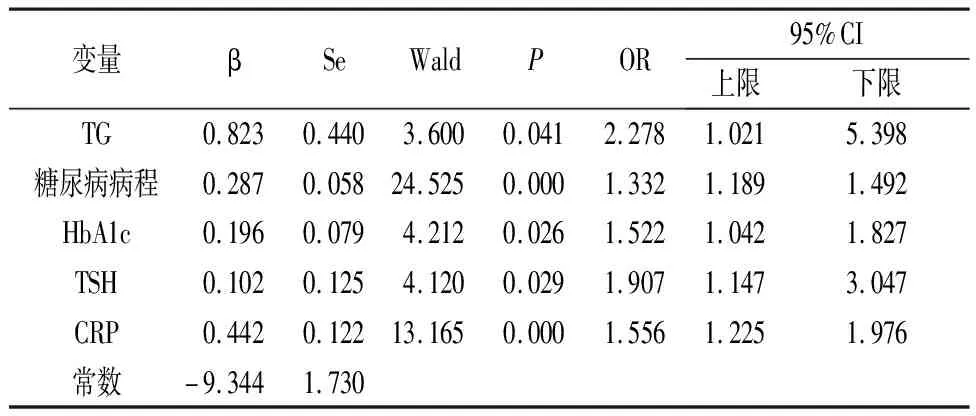
表2 DKD合并HUA二元Logistic回归分析
2.3 建模组模型预测效能评估 将建模组患者影响因素纳入风险预测模型,计算每名患者合并HUA预报概率,绘制ROC曲线,评价模型在建模组预测效能。建模组模型AUC为0.832(0.768~0.895),敏感度为75.40%,特异性为75.90%。H-L检验为χ2=3.657,P=0.366,说明模型在建模组中具有较好的区分度和校准度,见图1。
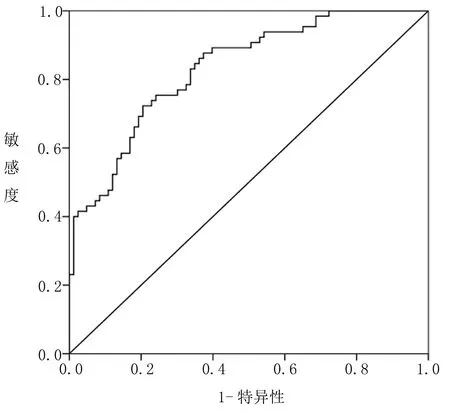
图1 建模组模型ROC分析
2.4 验证组模型预测效能评估 验证组模型AUC为0.821(0.749~0.886),敏感度为78.57%,特异性为77.78%。H-L检验为χ2=4.017,P=0.196,说明模型在验证组中具有较好的区分度和校准度,见图2。
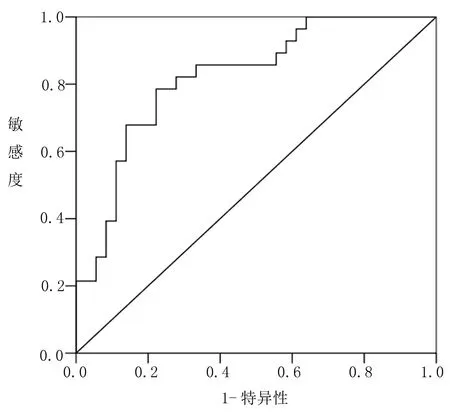
图2 验证组模型ROC分析
3 讨论
DKD患者存在不同程度的胰岛素抵抗,高胰岛素血症可以抑制尿酸排泄,提高重吸收能力。以往研究发现,HUA与DKD发生呈正相关,且会累积心、脑、肾等器官和组织,引起功能障碍,明显加重DKD肾损伤,加快病理进程[4]。目前国内外研究主要集中于DKD合并HUA潜在影响因素,并没有就影响因素构建风险预测模型,对临床指导价值有限。本研究在总结以往影响因素的前提下,进一步构建了风险预测模型,并对模型的预测效能进行了评估,为临床判断DKD患者合并HUA风险提供了可靠依据。
本研究中DKD合并HUA发生率为43.87%,与Li Q研究结果基本相符[5],表明DKD患者合并HUA风险较高,早期识别和及时干预对降低HUA发生可能有一定价值。血脂代谢紊乱与UA水平呈正相关,脂肪分解时产生的酮体和脂肪酸可抑制尿酸的代谢,加速肾动脉硬化,降低肾脏尿酸盐排泄,导致HUA发生[6]。UA的主要通过肾脏排泄,DKD患者肾小球滤过率明显降低,而病程与肾小球滤过率呈一定负相关,从而导致尿酸排泄障碍,进而导致HUA的发生。徐台林等[7]研究发现,糖尿病病程是DKD合并HUA的独立影响因素之一,本研究结果与之相符。HbA1c可反映过去3个月内血糖控制水平,HbA1c控制在7%以内表明血糖控制较为理想。Huang GQ等[8]研究发现,HUA患者HbA1c高于非HUA患者,是DKD患者合并HUA的独立影响因素。本研究发现HbA1c为DKD合并HUA独立影响因素。激素的过量和缺乏可影响UA的代谢,甲状腺激素对UA的影响已经成为研究的热点。甲状腺激素可以通过提高胰岛素敏感性来调节甲状腺功能减退患者UA代谢,其次高胰岛素血症可以降低肾脏UA排泄,导致HUA发生。炎症因子表达水平对DKD疾病进展有一定预测价值,在一定程度上可以反映肾脏损伤程度。Fu CC等[9]研究发现T2DM患者合并HUA与CRP等炎症因子表达密切相关。本研究证实TG、糖尿病病程、HbA1c、TSH、CRP均为DKD合并HUA独立影响因素,基于此构建了风险预测模型。建模组、验证组通过ROC曲线、H-L检验分析分别判断模型预测效能、区分度、校准度、稳定性,证实该风险预测模型在建模组、验证组均有较好的预测敏感度、特异性、区分度和校准度,适合在临床应用与推广。此外本研究存在一定局限性:(1)本研究为回顾型分析,样本量较小,可能会造成部分指标统计结果偏差。(2)构建的风险预测模型计算量较大,不利于临床对患者快速评估。(3)建模组、验证组均来自同一医院,无法证实在其他医院是否有同样预测价值。未来前瞻性、多中心、大样本、计算更为简便的列线图分析可能更有利于临床的应用和评价。
综上所述,基于二元Logistic分析原理,本研究成功构建了DKD合并HUA风险预测模型,经验证该模型有较高的预测效能,适合临床应用。临床医护人员运用此模型,可筛查DKD合并HUA高风险人群,及时采取干预措施,降低患者UA水平,延缓肾脏损伤进程。

