不同药物组合治疗儿童急性早幼粒细胞白血病随机对照研究
王柯岩
河南省周口市妇幼保健院(周口市儿童医院)小儿内科 466000
急性早幼粒细胞白血病(Acute promyelocytic leukemia,APL)属于特异基因、染色体核型改变的急性髓系白血病,占据儿童急性髓系白血病的10%左右,其临床表现为出血、血细胞减少,有10%~20%的患儿死于早期出血[1]。全反式维甲酸(ATRA)可抑制APL细胞特异性分化,三氧化二砷(ATO)可诱导APL细胞凋亡,但单纯使用ATRA治疗易出现骨髓抑制等不良反应,临床常采用ATRA+ATO联合治疗,但接受静脉ATO治疗需较长住院时间,影响患儿生活质量。复方黄黛片属于砷化合物,具有益气活血作用,可抑制白血病细胞增殖,诱导细胞凋亡。为提高APL患儿治疗效果,本文主要对比分析ATRA+ATO、ATRA+复方黄黛片在APL患儿中的临床疗效,为APL治疗提供理论依据。
1 资料与方法
1.1 一般资料 选取2019年1月—2021年12月本院收治的81例APL患儿为观察对象,随机分为对照组40例和研究组41例。对照组:男21例、女19例,年龄2~17(9.16±2.16)岁,体质量指数13~22(17.68±1.25)kg/m2。研究组:男26例、女15例,年龄2~16(9.03±2.27)岁,体质量指数12~23(18.04±1.37)kg/m2。两组一般资料均衡可比(P>0.05)。研究经本院伦理委员会批准。
1.2 纳入与排除标准 纳入标准:符合APL诊断标准[2];首次确诊;预计生存时间≥6个月;认知功能正常者;所有病例遵循知情同意原则。排除标准:合并其他白血病;对ATRA、ATO存在禁忌证者;合并其他血液系统疾病者;合并严重心、肝、肾功能障碍者;过敏体质者。
1.3 方法 对照组予以ATRA(山东良福集团制药有限公司,国药准字H20083494,规格:10mg)+ATO(北京双鹭药业股份有限公司,国药准字H20080664,规格:5mg)治疗,用法用量:第1~4周口服ATRA 25mg/(m2·d),连续服用14d,间歇14d。第5~12周静脉滴注ATO,每次剂量为0.16mg/kg,1次/d,连续治疗14d,间歇14d。研究组予以ATRA+复方黄黛片(天长亿帆制药有限公司,国药准字Z20090788,规格:0.27g)治疗,第1~4周ATRA治疗方法同对照组。第5~12周口服复方黄黛片,10片/次,3次/d,连续服用14d,间歇14d。
1.4 观察指标 (1)临床疗效[3]:显效:临床症状基本消失,早幼粒细胞≤5%,原粒细胞≤5%;有效:临床症状改善,5%<早幼粒细胞≤20%,5%<原粒细胞≤20%;无效:未达到上述标准。总有效率=(显效+有效)例数/总例数×100%。(2)比较两组白细胞计数、早幼粒细胞比例、血液学缓解所需时间、凝血指标恢复正常所需时间。(3)比较两组治疗前后血脂代谢指标:总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)。(4)凝血功能指标:分别于治疗前、治疗后采集所有受试者空腹外周静脉血6mL,用离心机离心15min(3 500r/min)分离血清后置于-80℃冰箱保存。使用HISCL-5000超敏发光免疫分析仪(日本希森美康公司)检测凝血酶—抗凝血酶复合物(TAT)、血栓调节蛋白(TM)、纤溶酶-α2纤溶酶抑制剂复合物(PIC)水平。(6)血清微小RNA-218(miR-218)、Bim-1水平:于治疗前后采用Trizol试剂(美国Invitrogen公司)分别提取两组血清总RNA,按照反转录试剂盒(北京天根生化)进行反转录,参照荧光定量PCR试剂盒(北京天根生化)进行扩增反应,并采用2-ΔΔCt法检测miR-218、Bim-1、mRNA水平。(7)统计两组不良反应:包括胃肠道不适、维甲酸综合征、头晕头痛、关节酸痛。

2 结果
2.1 两组疗效比较 对照组显效15例、有效17例、无效8例;研究组显效22例、有效17例、无效2例。研究组总有效率为95.12%(39/41),高于对照组的80.00%(32/40),差异有统计学意义(χ2=4.278,P=0.039)。
2.2 两组临床指标比较 与对照组比较,研究组白细胞计数、早幼粒细胞比例降低,血液学缓解所需时间、凝血指标恢复正常所需时间缩短(P<0.05),见表1。

表1 两组临床指标比较
2.3 两组血脂代谢指标比较 治疗前两组血脂代谢指标比较无明显差异(P>0.05)。治疗后两组TC、LDL-C、TG水平高于治疗前,但研究组低于对照组(P<0.05),见表2。
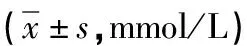
表2 两组血脂代谢指标比较
2.4 两组凝血功能比较 治疗前两组凝血功能比较无明显差异(P>0.05)。治疗后两组TAT、TM、PIC水平低于治疗前,且研究组低于对照组(P<0.05),见表3。

表3 两组凝血功能比较
2.5 两组血清miR-218、Bim-1水平比较 治疗前两组血清miR-218、Bim-1水平比较无明显差异(P>0.05)。治疗后研究组血清miR-218水平高于对照组,Bim-1水平低于对照组(P<0.05),见表4。

表4 两组血清miR-218、Bim-1水平比较
2.6 两组不良反应发生情况比较 对照组胃肠道不适4例、维甲酸综合征3例、头晕头痛3例、关节酸痛2例;研究组胃肠道不适2例、维甲酸综合征1例、头晕头痛1例、关节酸痛1例。研究组不良反应总发生率为12.20%(5/41),低于对照组的30.00%(12/40),差异有统计学意义(χ2=3.871,P=0.049)。
3 讨论
APL发病机制为染色体易位形成PML-RARα融合基因,可阻滞白细胞成熟障碍分化,引起髓系细胞分化、增殖、凋亡,并可加速早幼粒细胞病理性堆积,引起骨髓造血、凝血功能[4]。
ATRA可作用于PML-RARα融合基因,促进野生型PML、RAR基因功能恢复,减少凝血物质释放量,但长期单独使用ATRA存在维持时间短、耐药性等问题,而ATO可促进ATRA与其受体融合,下调细胞凋亡相关蛋白表达,进而诱导APL细胞凋亡[5]。复方黄黛片属于中药制剂,其组成成分为青黛、雄黄、太子参、丹参,雄黄为君药,具有祛湿解毒、化痰截疟之效;青黛为臣药,具有泻火解毒、清热凉血之效;丹参具有清心活血之效;太子参具有益气补血、补肾健脾之效,诸药合用共奏清热活血、生血解毒之功[6]。现代药理学认为复方黄黛片属于砷剂,雄黄主要成分为四硫化四砷,丹参主要活性成分为丹参酮ⅡA,可影响白血病细胞增殖、凋亡,并可促进PML-RARα融合基因降解,促使早幼粒癌变细胞成熟,提高APL治疗效果[7]。本文结果显示,研究组总有效率高于对照组,白细胞计数、早幼粒细胞比例低于对照组,血液学缓解所需时间、凝血指标恢复正常所需时间明显短于对照组,表明ATRA联合复方黄黛片可提高疗效,有效改善临床症状。分析认为,ATRA+ATO可诱导APL细胞程序性凋亡,减少异常白细胞生成量,阻断血管形成,其中ATRA可降解癌蛋白,ATO可特异性结合部分癌蛋白,促进APL细胞成熟,联合应用可发挥协同作用[8]。ATRA+复方黄黛片治疗方案可减少砷剂蓄积,促使每种药物间歇期延长,以此避免产生耐药性,复方黄黛片可增强ATRA对APL细胞的杀伤作用,促进APL细胞凋亡,进而达到增强疗效目的[9]。同时本文结果显示,治疗后研究组TC、LDL-C、TG水平低于对照组,表明ATRA+复方黄黛片可纠正血脂代谢状态。分析原因为复方黄黛片组方内有效成分可降低砷剂对机体产生的毒性。
APL患儿治疗期间,若出现进行性白细胞增多、凝血障碍,可增加早期出血性病死风险,TAT、TM、PIC属于血栓前状态分子标志物,可反映早期出血性情况[10]。本文结果显示,治疗后研究组TAT、TM、PIC水平低于对照组,表明ATRA+复方黄黛片可改善APL患儿凝血功能,减少弥散性血管内凝血发生,降低出血性感染发生风险。miR-218可通过下调Bim-1表达抑制APL细胞增殖,并可促进细胞凋亡[11]。已有研究表明复方黄黛片可调节APL细胞生物学行为,但关于其具体机制尚未明确[12]。本文结果显示,治疗后研究组血清miR-218水平高于对照组,Bim-1水平低于对照组,而治疗前后对照组血清miR-218、Bim-1水平比较无明显差异。提示ATRA+复方黄黛片可能通过调控miR-218、Bim-1表达而发挥作用。同时本文结果发现,研究组不良反应总发生率低于对照组,表明ATRA+复方黄黛片治疗方案对机体产生损害较轻,安全性更高。这主要是因为复方黄黛片可选择性诱导杀伤白血病细胞,对正常肺脏组织的影响较小,且具有增效减毒作用。
综上所述,与ATRA+ATO相比,ATRA+复方黄黛片用于APL患儿的疗效更佳,可改善临床症状、血脂代谢异常状态,促进凝血功能恢复,减少不良反应发生,可能与调节miR-218、Bim-1表达有关。

