外源褪黑素对玫瑰高温胁迫的缓解效应





摘要:[目的]高温已经成为制约玫瑰生长和生产最主要的非生物逆境因子之一。探究外源褪黑素对玫瑰耐高温能力的影响,可为解决玫瑰栽培过程中的热害问题以及玫瑰耐高温遗传改良提供实践和理论依据。[方法]以二年生‘紫枝’玫瑰盆栽苗为试验材料,研究叶面喷施100 μmol·L-1褪黑素预处理对40 ℃高温胁迫下玫瑰叶片相关生理特性和热激蛋白基因表达的影响。[结果]高温胁迫导致玫瑰叶片水分失衡,细胞膜系统受损,光合作用受阻,次生氧化胁迫,明显抑制了玫瑰的生长。而外源褪黑素预处理后,玫瑰叶片在高温胁迫下的相对电导率(REC)和丙二醛(MDA)含量明显降低;相对含水量(RWC)和叶绿素含量(SPDA)显著升高;光系统II 最大光化学效率(Fv/Fm)和净光合速率(Pn)显著提升;脯氨酸(Pro)和可溶性蛋白(SP)等渗透调节物质的含量显著增多;超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶的活性显著增强;RhHSP70、RhHSP90 和RhHSP101 等热激蛋白基因的表达量显著上调。[结论]高温胁迫下,施加外源褪黑素预处理能够通过提高叶片保水能力,维护细胞膜系统的稳定性和完整性,提升光合作用强度,增加渗透调节物质含量,增强抗氧化酶活性,上调热激蛋白基因表达等途径来缓解高温胁迫对玫瑰叶片产生的不利影响,从而提高了玫瑰的耐高温能力。
关键词:褪黑素; 玫瑰; 高温胁迫; 生理特性; 热激蛋白
中图分类号:S685.12 文献标识码:A 文章编号:1671-8151(2024)01-0034-09
玫瑰(Rusa rugosa)为蔷薇科(Rosaceae)蔷薇属(Rose)的一种多年生常绿或落叶直立丛生木本花卉,栽培历史悠久,是我国十大名花之一,也是世界四大切花之一,享有“ 花中皇后”美誉。作为世界名花,玫瑰不仅具有较高的绿化和观赏价值,更重要的是玫瑰还被广泛应用于食品、医药、美容、养生、化工等行业领域,具有极高的商业开发利用价值。近年来,随着农业产业结构不断调整以及花卉产业飞速发展,优质玫瑰需求量日益增加,玫瑰种植区域和种植数量呈连年上升趋势[1]。
高温是威胁农业生产和破坏生态环境最主要的非生物胁迫之一[2]。近年来,由于全球气候恶化和温室效应加剧,夏季极端高温天气频繁发生,严重影响园艺植物的露天栽培和生长生产。玫瑰性喜阳光充足、通风凉爽的气候,生长最适温度为15~25 ℃[3]。当夏季气温持续高于30 ℃ 时,玫瑰通常会进入半休眠状态,当遇到40 ℃以上极端高温天气时,玫瑰生长发育会受到明显损害,如叶片萎蔫、花枝枯瘦、花芽异常、花朵畸形、花期缩短、病虫害高发等,严重影响了玫瑰的观赏价值和经济价值,同时也限制了玫瑰的种植区域和供给范围[4]。国内外有关玫瑰亲缘关系非常近的月季或蔷薇的研究结果均表明,高温胁迫损伤细胞生命物质和生物膜,扰乱植物正常生理代谢过程和细胞内稳态,进而抑制植物生长发育,加速其衰老或死亡[5]。在这样的形势和环境下,如何提高玫瑰栽培质量和产量,已经成为目前花卉产业发展面临的重要问题。因此,通过研发栽培调控技术来缓解高温胁迫对玫瑰造成的伤害,对指导玫瑰培育和生产都有非常重要的理论意义和应用价值。
褪黑素(Melatonin,MT)又名松果体素,化学名称为N-乙酰基-5-甲氧基色胺,是一种动植物生命所必需的吲哚色胺类小分子激素。褪黑素作为一种重要的生长调节物质和抗氧化物质,在植物体内具有多重生物学功能,能够调控植物的生长发育过程,如昼夜节律、种子萌发、叶片衰老和腋芽分化等[6];参与植物的逆境胁迫应答,如高低温、干旱、盐碱和病虫害等非生物和生物逆境胁迫[7];还可以作为一种重要的响应逆境胁迫的信号分子诱发植物自身防御功能,从而提高植物的抗逆性[8]。外源褪黑素处理可以缓解高温胁迫对植物造成的伤害,已经在拟南芥[9]、黑麦草[10]、番茄[11]、樱桃萝卜[12]、菊花[13]、苹果[14]等许多植物中被广泛报道。在以上植物中的研究结果表明,高温胁迫条件下,外源褪黑素可以有效抑制活性氧(Reactiveoxygen species,ROS)积累、保护细胞膜完整性、维持光合作用强度、提高抗氧化能力、增强渗透调节能力、调节物质代谢和诱导耐热基因表达等,从而提高植物的耐热性,减轻高温胁迫的危害[9-14]。但褪黑素能否以及如何缓解玫瑰高温胁迫还未见报道。本试验通过研究喷施外源褪黑素(100 μmol·L-1)预处理对高温(40 ℃)胁迫下玫瑰叶片相关生理特性和热激蛋白基因表达的影响,以期从生理和分子层面初步探讨褪黑素缓解玫瑰高温胁迫的作用机制,旨在为利用褪黑素改善玫瑰高温胁迫下的生长和生产提供参考依据,同时为玫瑰耐高温遗传改良提供理论依据。
1 材料与方法
1. 1 试验材料
试验于2022-2023 年在荆楚理工学院特色花卉生物育种湖北省工程研究中心进行。供试材料为二年生‘ 紫枝’玫瑰盆栽苗,取自荆楚理工学院月季种质资源圃。试验处理所需褪黑素(MT)购自美国Sigma 公司,依据前期预试验相对电导率测定结果,选择100 μmol·L-1为本次试验处理浓度。
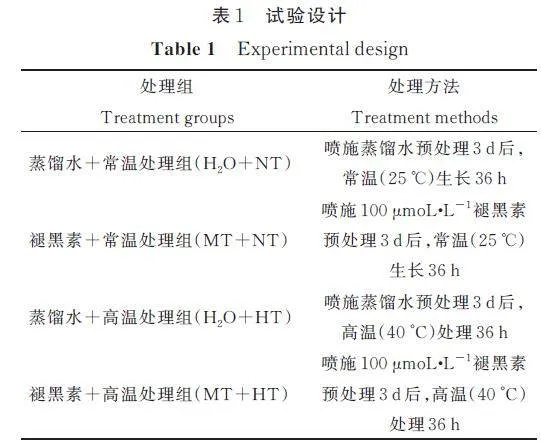
1. 2 试验设计
选用生长健壮的‘ 紫枝’玫瑰盆栽苗,修剪株高统一为约40 cm,培养至其株型和长势基本一致后,置于正常生长光照培养箱(温度为25 ℃,昼夜时长为14 h/10 h,光照强度为600 μmol·m-2·s-1,相对湿度为70%)中培养3 d 后进行不同处理。采用完全随机区组试验设计,共设置4 个处理(表1),每个处理3 次生物学重复,每个生物学重复3 株苗,以蒸馏水+常温处理组为对照。
蒸馏水和褪黑素以叶面喷施的方式于每天晚上21:00 进行喷施(以刚刚形成水滴滴落为宜)。每天喷施1 次,连续喷施3 d,最后一次喷施1 d 后,将蒸馏水+ 高温(H2O+HT 组)和褪黑素+ 高温(MT+HT 组)的盆栽苗转移到高温处理光照培养箱中(温度为40 ℃,昼夜时长为14 h/10 h,光照强度为600 μmol·m-2·s-1,相对湿度为70%)。高温处理36 h 后,分别在每个实验组的各个供试玫瑰植株上端的相同位置选取完全展开的羽状复叶,用于各项生理指标测定和基因表达分析。
1. 3 测定指标与方法
1. 3. 1 生理指标测定
相对含水量(Relative water content,RWC)采用称重法进行测定,具体参照陈浩维等[15]的方法。
相对电导率(Relative electrical conductivity,REC)使用日本Horiba 公司生产的Twin Cond B-173 型电导率测定仪进行测定[16];叶绿素含量(Chlorophyll content,SPAD)使用中国浙江托普云农公司生产的SPAD-502 型叶绿素测定仪进行测定[16];光系统II(PSII)最大光化学效率(Photochemicalefficiency of photosystem II,Fv/Fm)使用英国Hansatech 公司生产的FMS-2 型叶绿素荧光测定仪进行测定[17];净光合速率(Net photosyntheticrate,Pn)使用英国Hansatech 公司生产的CIRAS-2 型光合作用测定仪进行测定[17]。
丙二醛(Malondialdehyde,MDA)的含量使用南京建成A003-3-1 试剂盒进行测定;可溶性糖(soluble sugar,SS)的含量测定使用南京建成A145-1-1 试剂盒进行测定;可溶性蛋白(Solubleprotein,SP)的含量使用南京建成A045-2-2 试剂盒进行测定;游离脯氨酸(Proline,Pro)的含量使用南京建成A107-1-1 试剂盒进行测定;超氧化物歧化酶(Superoxide dismutase,SOD)的活性使用南京建成A001-3-2 试剂盒进行测定;过氧化物酶(Peroxidase,POD)的活性使用南京建成A084-3-1 试剂盒进行测定;过氧化氢酶(Catalase,CAT)的活性使用南京建成A007-1-1 试剂盒进行测定[18]。
1. 3. 2 基因表达分析
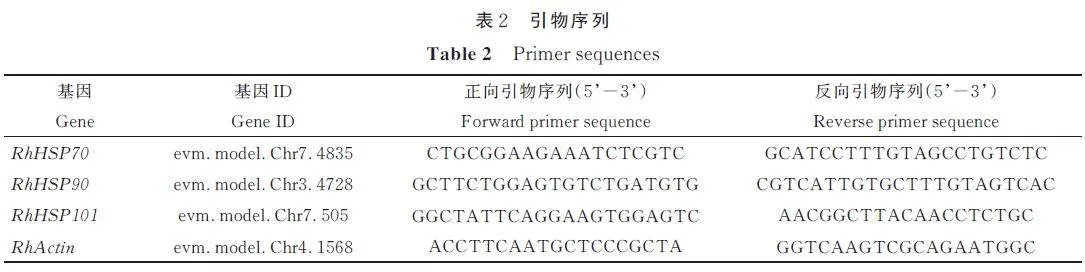
使用Aidlab 公司生产的RN38-EASYspinPlus 植物RNA 快速提取试剂盒提取玫瑰叶片总RNA;以总RNA 为模板,使用Vazyme 公司生产的HiScript® III All-in-one RT SuperMix Perfect forqPCR 反转录试剂盒合成cDNA;以cDNA 为模板,使用Tiangen 公司生产的Talent qPCR PreMix试剂盒在美国ABI 公司生产的Stepone PCR 仪上进行荧光实时定量PCR[19]。玫瑰热激蛋白基因(RhHSP70、RhHSP90 和RhHSP101)和RhActin基因所采用的特异性引物见表2。以RhActin 基因为内参,采用2-ΔΔCT 法[20]计算RhHSP70、RhHSP90和RhHSP101 基因的相对表达量。
1. 4 数据处理
试验数据首先在Microsoft Excel 2020 软件中计算平均值和标准偏差,然后在IBM SPSS Statistics26 软件中采用最小显著差异法(LSD 法)检验差异显著性(Plt;0. 05),最后在GraphPad Prism 10软件中绘制统计图表,图表数据均采用3 次重复的平均值±标准偏差来表示。
2 结果与分析
2. 1 外源褪黑素处理后高温胁迫下玫瑰叶片水分状态和细胞膜系统
相对含水量(RWC)是衡量高温胁迫下植物组织水分状况和保水能力的基本指标[21]。如图1 所示,MT+NT 组玫瑰叶片RWC 与H2O+NT 组相比差异不显著;H2O+HT 组玫瑰叶片RWC 与H2O+NT 组相比显著降低10. 68%;而MT+HT组玫瑰叶片RWC 与H2O+HT 组相比显著升高了6. 59%。由此可知,高温胁迫导致玫瑰叶片RWC显著降低,而外源褪黑素预处理则显著提高了高温胁迫下玫瑰叶片RWC。结果说明,外源褪黑素预处理能够有效增强高温胁迫下玫瑰叶片保水能力,维持细胞水分平衡。
相对电导率(REC)是反映植物细胞膜热稳定性的重要指标[22]。如图1 所示,MT+NT 组玫瑰叶片REC 与H2O+NT 组差异不显著;H2O+HT组玫瑰叶片REC 与H2O+NT 组相比显著升高了63. 24%;MT+HT 组玫瑰叶片REC 与H2O+HT组相比显著降低了26. 43%。丙二醛(MDA)含量是反映植物细胞膜氧化损伤程度的主要指标[23]。如图1 所示,MT+NT 组玫瑰叶片MDA 含量与H2O+NT 组相比差异不显著;H2O+HT 组玫瑰叶片MDA 含量与H2O+NT 组相比显著增加了45. 71%;MT+HT 组玫瑰叶片MDA 含量与H2O+HT 组相比显著减少了15. 69%。可知,高温胁迫导致玫瑰叶片REC 值和MDA 含量显著增加,而外源褪黑素预处理则显著降低了高温胁迫下玫瑰叶片REC 值和MDA 含量。结果说明,外源褪黑素预处理能够有效减轻高温胁迫对玫瑰叶片细胞膜损伤,维护细胞膜稳定性和完整性。
2. 2 外源褪黑素处理后高温胁迫下玫瑰叶片光合特性
对玫瑰叶片叶绿素含量(SPAD)、光系统II(PSII)最大光化学效率(Fv/Fm)和净光合速率(Pn)3 个重要光合作用指标进行测定,结果如图2所示,与H2O+NT 组相比,MT+NT 组玫瑰叶片Pn 值显著上升19. 17%,但其SPAD 和Fv/Fm 值差异不显著;H2O+HT 组玫瑰叶片SPAD、Fv/Fm和Pn 值与H2O+NT 组相比分别显著下降21. 19%、9. 57% 和26. 29%;MT+HT 组玫瑰叶片SPAD、Fv/Fm 和Pn 值与H2O+HT 组相比分别显著升高16. 93%、6. 04% 和25. 74%。可见,高温胁迫导致玫瑰叶片SPAD、Fv/Fm 和Pn 值显著降低,而外源褪黑素预处理则显著提高高温胁迫下玫瑰叶片SPAD、Fv/Fm 和Pn 值。结果说明,外源褪黑素预处理能够有效减轻高温胁迫对玫瑰叶片光合色素和PSII 损伤,维护叶片光合能力。
2. 3 外源褪黑素处理后高温胁迫下玫瑰叶片渗透调节物质含量
对玫瑰叶片中可溶性糖(SS)、可溶性蛋白(SP)和脯氨酸(Pro)3 种主要渗透调节物质含量进行测定,结果如图3 所示,与H2O+NT 组相比,MT+NT 组玫瑰叶片SP 含量显著增加44. 30%,但其SS、Pro 含量差异不显著;H2O+HT 组玫瑰叶片SS、SP 和Pro 含量与H2O+NT 组相比分别显著增加66. 13%、81. 01%、174. 45%;与H2O+HT组相比,MT+HT 组玫瑰叶片SP 和Pro 含量分别显著增加了30. 07% 和32. 51%,但其SS 含量增加不显著。可见,高温胁迫下玫瑰叶片SS、SP 和Pro含量显著积累,外源褪黑素预处理则进一步显著提高高温胁迫下玫瑰叶片SP 和Pro 含量。表明外源褪黑素预处理能够有效促进高温胁迫下玫瑰叶片渗透调节物质积累,增强植株抵御高温能力。
2. 4 外源褪黑素处理后高温胁迫下玫瑰叶片抗氧化酶活性
对玫瑰叶片中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)3 种重要的抗氧化酶活性进行测定,结果如图4 所示,MT+NT组玫瑰叶片SOD、POD 和CAT 活性与H2O+NT组差异不显著;与H2O+NT 组相比,H2O+HT 组玫瑰叶片SOD 活性显著升高了45. 68%,POD 活性升高不明显,CAT 活性显著降低了29. 53%;MT+HT 组玫瑰叶片SOD、POD 和CAT 活性与H2O+HT 组相比,分别显著升高了28. 25%、19. 26% 和33. 89%。由此可见,高温胁迫下玫瑰叶片SOD 活性增强,CAT 活性减弱,而外源褪黑素预处理则显著提高了高温胁迫下玫瑰叶片SOD、POD 和CAT 活性。结果说明,外源褪黑素预处理能够有效增强高温胁迫下玫瑰叶片抗氧化酶活性,维持ROS 代谢平衡,减轻氧化胁迫损伤。
2. 5 外源褪黑素处理后高温胁迫下玫瑰叶片热激蛋白基因表达
对玫瑰叶片中3 个重要的热激蛋白基因RhHSP70、RhHSP90 和RhHSP101 进行了表达分析,结果如图5 所示,MT+NT 组玫瑰叶片RhHSP70、RhHSP90 和RhHSP101 基因的表达量与H2O+NT 组相比差异不显著;H2O+HT 组玫瑰叶片RhHSP70、RhHSP90 和RhHSP101 基因的表达量与H2O+NT 组相比分别显著上调了3. 23倍、7. 08 倍和4. 42 倍;MT+HT 组玫瑰叶片RhHSP70、RhHSP90 和RhHSP101 基因表达量与H2O+HT 组相比分别显著上调0. 89 倍、1. 03 倍和1. 38 倍。可见,玫瑰叶片RhHSP70、RhHSP90 和RhHSP101 基因受高温胁迫诱导上调表达,而外源褪黑素预处理则进一步显著提高了高温胁迫下玫瑰叶片RhHSP70、RhHSP90 和RhHSP101 基因的表达量。结果说明,外源褪黑素预处理能够有效促进高温胁迫下玫瑰叶片热激蛋白上调表达,保护和修复蛋白质,维护细胞稳态。
3 讨论
高温胁迫是影响玫瑰生长发育的主要限制因素之一。因此,寻求提高玫瑰耐热性的途径对玫瑰产业具有重大意义。近年来,大量研究表明褪黑素在植物高温胁迫中发挥着积极作用[6-8]。本试验主要研究了外源褪黑素预处理对高温胁迫下玫瑰叶片水分状态、质膜透性、光合特性、渗透调节物质含量、抗氧化酶活性及热激蛋白基因表达的影响,结果发现褪黑素正向调控玫瑰对高温胁迫的耐受性。
植物遭受高温胁迫时通常会引起叶片失水,表现出卷曲、枯萎或脱落等症状[24]。本研究发现,外源褪黑素预处理有效缓解了高温胁迫对玫瑰叶片的伤害,减少了叶片水分的损失,减轻了叶片的萎蔫程度,这与在苹果[25]、甜瓜[26]、生菜[27]等植物中的研究结果一致。相关研究报道,高温胁迫下植物叶片失水萎蔫主要归因于高温改变了叶片组织的形态和结构[28]。姚富文等[25]研究发现,外源褪黑素预处理使高温胁迫下苹果叶片表皮细胞厚度增加和叶肉细胞排列紧密,有助于提高叶片的保水力。由此推测,外源褪黑素预处理减轻了高温胁迫下玫瑰叶片含水量的损失,这可能主要是由于褪黑素对叶片组织的保护作用,有待于进一步研究和验证。
作为温度传感器的植物细胞膜系统被认为是高温损伤的主要部位,其中质膜透性增加和膜脂过氧化是高温胁迫下膜损伤的主要表现[29]。植物细胞膜的热稳定性与其耐热性呈正相关。彭勇政等[30]在对不同月季品种进行耐热性评价时,发现随着温度的升高,不同月季品种的REC 水平和MDA 含量均呈上升的趋势,且不耐热品种的增幅均大于耐热品种。窦宗信[31]在高温胁迫对丰花月季生理效应的研究中发现,丰花月季叶片REC 水平和MDA 含量随着胁迫时间的增长而持续增加,且不耐热品种的上升速度均大于耐热品种。本研究发现,玫瑰叶片REC 水平和MDA 含量在高温胁迫下显著增加的现象可以通过外源褪黑素预处理得到有效缓解,这与在甘蓝[16]、菊花[13]、苹果[14]等植物中的研究结果一致,说明褪黑素能够通过维护高温胁迫下植物细胞膜系统的稳定性和完整性,提高植物的耐热能力。
光合作用是植物物质转化和能量代谢的关键,也是植物体内对温度变化极为敏感的生理过程之一[32]。本研究结果表明,高温胁迫下玫瑰叶片Pn 明显下降可能是由光合色素含量和PSII 活性降低引起的。高温胁迫导致植物叶片叶绿素含量下降可能是由于高温抑制了叶绿素合成相关酶的活性或诱发ROS 大量积累加速了叶绿素降解[32]。PSII 是植物光能转换的重要场所,也是决定光合作用效率的重要部位。Fv/Fm 值反映了PSII 反应中心原初光能的转换效率。玫瑰叶片Fv/Fm 值在高温胁迫下明显降低,说明高温胁迫严重抑制了玫瑰叶片PSII 的光化学活性,这与卞凤娥等[17]研究高温胁迫对葡萄叶片叶绿素荧光特性的影响中得出的结论一致。本研究中,外源褪黑素预处理可以显著提高高温胁迫下玫瑰叶片光合色素含量、Fv/Fm 和Pn 值,这与在葡萄[17]、茄子[33]、菊花[13]等植物中的研究结果一致,说明减轻高温胁迫下光合色素和PSII 的损伤,维持植株较高的光合能力,可能是褪黑素帮助植物适应高温的一种重要策略。
SS、SP 和Pro 是植物体内重要的渗透调节物质,在高温等逆境胁迫响应过程中发挥着重要作用[29]。高温驯化过程中,渗透调节物质的积累是植物增强高温适应性的主要事件之一,它可以调节细胞渗透势,维持细胞水分平衡,保护细胞生命物质及生物膜,其含量在一定程度上还可以反映植物生命活动的代谢水平,已经得到了广泛的研究证实[29]。本研究中,高温胁迫导致玫瑰叶片SS、SP、Pro 含量显著积累,而外源褪黑素预处理则进一步显著提高了高温胁迫下玫瑰叶片SP 和Pro 含量,这与在茄子[33]、菊花[13]、莴苣[34]等植物中的研究结果一致,说明褪黑素对高温胁迫下植物细胞持水性及生物膜的保护作用可能与其诱导更多渗透调节物质的积累有关。
SOD、POD 和CAT 是植物酶促ROS 清除系统中关键的抗氧化酶,在维持细胞内ROS 代谢平衡,抵抗高温等逆境胁迫中起着重要作用[35]。本研究中,高温胁迫后玫瑰叶片SOD 活性显著升高,POD 活性升高不明显,CAT 活性显著降低,这与在番茄[11]、甜瓜[26]、苹果[14]等植物中的研究结果相互之间均不一致。高温胁迫下,植物体内抗氧化酶活性变化规律如何,是否与植物种类、胁迫强度、处理时间等诸多因素有关,一直以来,并未形成明确的定论。但外源褪黑素预处理可以显著提高高温胁迫下玫瑰叶片SOD、POD 和CAT 活性,这与在番茄[11]、甜瓜[26]、苹果[14]等植物中的研究结果相一致,这可能是由于褪黑素可以促进高温胁迫下抗氧化酶相关基因的上调表达,提高了抗氧化酶的活性,从而增强了植株对ROS 的清除能力,减轻了高温胁迫下的氧化损伤。
热激蛋白(Heat shock protein,HSP)作为维持细胞蛋白质稳态的重要分子伴侣,负责蛋白质的折叠、组装、转运与降解,并能在高温胁迫下协助蛋白质复性,通过重建正常的蛋白质构象维持细胞稳态,对保护植物在高温胁迫中免受损伤起着至关重要的作用[36]。已有研究表明,外施褪黑激素可以上调高温胁迫下HSP 家族基因的表达,有利于提高植物的耐热能力。Shi 等[9]研究表明,根施褪黑素预处理可以上调拟南芥HSP90 和HSP101 基因在高温胁迫下的表达量,从而增强植株对高温胁迫的耐受性。叶面喷施或根部浇灌相应浓度的褪黑素预处理可以增加高温胁迫下番茄HSP17. 4、HSP20、HSP20-1、HSP21、HSP70 和HSP90 基因的表达量,从而提高植株对高温胁迫的抵抗力[37-38]。Xia 等[39]研究表明,根部浇灌褪黑素预处理可以提高高温胁迫下猕猴桃7 个HSP70s和3 个sHSPs 基因的表达量,从而保护植株免受高温胁迫损伤。本研究中,外源褪黑素预处理可以使高温胁迫下玫瑰叶片中RhHSP70、RhHSP90 和RhHSP101 基因上调表达,说明褪黑素诱导高温胁迫下HSP 基因的上调表达可能是其增强植物耐热性的重要分子机制之一。
在前人的研究中,植物经外源褪黑素预处理后可以在一定范围的胁迫强度和胁迫时间内保持耐高温状态。姚富文[25]对RWC、REC、MDA 含量和叶绿素含量等耐热性评价指标的连续多次取样的测定结果发现,在40 ℃高温胁迫的1~5 d 内,褪黑素预处理的苹果叶片相对于未经褪黑素预处理的苹果叶片提高了高温耐受性。王译等[27]对MDA 含量以及SOD、POD、CAT 活性等抗氧化指标的连续多次取样的测定结果发现,在30 ℃/25 ℃昼夜高温胁迫的1~8 d 内,褪黑素预处理的生菜叶片相对于未经褪黑素预处理的生菜叶片提高了抗氧化能力。胡少卿[40]对RWC 含量、REC 含量、MDA 含量、叶绿素含量、Fv/Fm、Pn、SS 含量、SP含量、Pro 含量、SOD 活性、POD 活性、CAT 活性等耐热性评价指标连续多次取样的测定结果发现,在33 ℃/28 ℃和40 ℃/35 ℃这2 种昼夜高温胁迫的1~4 d 内,褪黑素预处理的菊花叶片相对于未经褪黑素预处理的菊花叶片提高了高温抗性。在本研究中,我们通过上述各项耐热性评价指标的1次取样的检测结果表明,在40 ℃高温胁迫36 h 时,褪黑素预处理的玫瑰叶片耐高温能力高于未经褪黑素预处理的玫瑰叶片。结合前人的研究成果,我们推测褪黑素预处理的玫瑰叶片在40 ℃高温胁迫36 h 内可能保持耐高温状态。但由于植物的耐热性是一个复杂的生物学现象,其耐高温表现受到胁迫时期、胁迫时长、胁迫强度以及研究对象等多种因素的影响,有待于我们进一步设计试验具体分析褪黑素预处理缓解玫瑰受到高温胁迫影响的程度。
4 结论
本研究结果表明,高温胁迫严重抑制了玫瑰的生长发育,而外源褪黑素预处理能够缓解高温胁迫对玫瑰叶片的伤害,提高了玫瑰对高温胁迫的抵御能力。本研究从生理和分子水平阐明了外源褪黑素缓解玫瑰高温胁迫的机制,为进一步研究褪黑素调控玫瑰高温胁迫响应的分子机制奠定了基础。但关于褪黑素在玫瑰抵御高温胁迫作用中的其它调控路径还有待进一步深入研究。此外,还应进一步深入研究高温胁迫下外源褪黑素提高玫瑰耐热性的最适浓度范围及施用周期,以促进生产上的应用推广。
参考文献
[1]尤瑾,乔志伟,李洋,等. 基于专利分析的玫瑰产业发展研究[J].现代农业科技,2022(13):189-194.
You J,Qiao Z W,Li Y,et al. Research on development of roseindustry based on patent analysis[J]. Modern AgriculturalScience and Technology,2022(13):189-194.
[2]Hassan M U,Chattha M U,Khan I,et al. Heat stress incultivated plants:nature,impact,mechanisms,and mitigationstrategies-a review [J]. Plant Biosystems-an InternationalJournal Dealing with All Aspects of Plant Biology,2021,155(2):211-234.
[3]曾尚文.月季耐湿热性研究综述[J].南方林业科学,2015,43(4):25-28.
Zeng S W. Research status on Rosa chinensis for heat andhumidity tolerance[J]. South China Forestry Science,2015,43(4):25-28.
[4]高小峰,郑明燕,源朝政,等.月季抗逆性研究进展[J].陕西农业科学,2018,64(5):88-90,98.
Gao X F,Zheng M Y,Yuan C Z,et al. Advance of stressresistance in Chinese rose[J]. Shaanxi Journal of AgriculturalSciences,2018,64(5):88-90,98.
[5]赵冰雪,张永春,周琳,等.月季高温胁迫研究进展[J].北方园艺,2021(10):124-131.
Zhao B X,Zhang Y C,Zhou L,et al. Research progress on hightemperature stress of Rosa hybrida[J]. Northern Horticulture,2021(10):124-131.
[6]Sun C L,Liu L J,Wang L X,et al. Melatonin: a masterregulator of plant development and stress responses[J]. Journalof Integrative Plant Biology,2021,63(1):126-145.
[7]Nawaz K,Chaudhary R,Sarwar A,et al. Melatonin as masterregulator in plant growth,development and stress alleviator forsustainable agricultural production: current status and futureperspectives[J]. Sustainability,2020,13(1):294.
[8]Shi H T,Chen K L,Wei Y X,et al. Fundamental issues ofmelatonin-mediated stress signaling in plants[J]. Frontiers inPlant Science,2016,7:1124.
[9]Shi H T,Tan D X,Reiter R J,et al. Melatonin induces class A1heat-shock factors (HSFA1s) and their possible involvement ofthermotolerance in Arabidopsis[J]. Journal of Pineal Research,2015,58(3):335-342.
[10]Zhang J,Shi Y,Zhang X Z,et al. Melatonin suppression ofheat-induced leaf senescence involves changes in abscisic acidand cytokinin biosynthesis and signaling pathways in perennialryegrass (Lolium perenne L.)[J]. Environmental andExperimental Botany,2017,138:36-45.
[11]Jahan M S,Shu S,Wang Y,et al. Melatonin alleviates heatinduceddamage of tomato seedlings by balancing redoxhomeostasis and modulating polyamine and nitric oxidebiosynthesis[J]. BMC Plant Biology,2019,19(1):414.
[12]Jia C H,Yu X J,Zhang M,et al. Application of melatoninenhancedtolerance to high-temperature stress in cherry radish(Raphanus sativus L. var. radculus pers)[J]. Journal of PlantGrowth Regulation,2020,39(2):631-640.
[13]齐晓媛,王文莉,胡少卿,等.外源褪黑素对高温胁迫下菊花光合和生理特性的影响[J]. 应用生态学报,2021,32(7):2496-2504.
Qi X Y,Wang W L,Hu S Q,et al. Effects of exogenousmelatonin on photosynthesis and physiological characteristics ofchrysanthemum seedlings under high temperature stress[J].Chinese Journal of Applied Ecology,2021,32(7):2496-2504.
[14]何晓龙,刘怀特,尚雨薇,等.不同外源物质对高温胁迫下平邑甜茶幼苗的缓解效应[J]. 河北农业大学学报,2022,45(5):67-76,131.
He X L,Liu H T,Shang Y W,et al. Mitigation effects ofdifferent exogenous substances on Malus hupehensis seedlingsunder high temperature stress[J]. Journal of Hebei AgriculturalUniversity,2022,45(5):67-76,131.
[15]陈浩维,邓明华,黄尧瑶,等.干旱胁迫对玫瑰花瓣膜脂过氧化及抗氧化酶活性的影响[J].西北植物学报,2018,38(5):885-893.
Chen H W,Deng M H,Huang Y Y,et al. Membrane lipidperoxidation and antioxygen enzyme activities of rose petalsunder drought stress[J]. Acta Botanica Boreali-OccidentaliaSinica,2018,38(5):885-893.
[16]曾庆栋,许忠民,张恩慧,等.外源褪黑素对高温胁迫下甘蓝幼苗生理特性的影响[J].北方园艺,2017(20):12-17.
Zeng Q D,Xu Z M,Zhang E H,et al. Effect of exogeneousmelatonin on physiological characteristic of cabbage seedlingsunder high temperature stress[J]. Northern Horticulture,2017(20):12-17.
[17]卞凤娥,孙永江,牛彦杰,等.高温胁迫下根施褪黑素对葡萄叶片叶绿素荧光特性的影响[J]. 植物生理学报,2017,53(2):257-263.
Bian F E,Sun Y J,Niu Y J,et al. Effect of root-appliedmelatonin on photosystem II in grape leaves under heat stress[J]. Plant Physiology Journal,2017,53(2):257-263.
[18]刘灵锐,曾梓健,年海,等.纳米氧化锌缓解大豆铝胁迫生理机制[J].华南农业大学学报,2023,44(5):787-793.
Liu L R,Zeng Z J,Nian H,et al. Physiological mechanisms ofzinc oxide nanoparticles alleviating aluminum stress in soybean[J]. Journal of South China Agricultural University,2023,44(5):787-793.
[19]刘航程,孙爽,徐秀琴,等.‘月月粉’和野蔷薇花青素合成酶基因的鉴定与表达分析[J].分子植物育种,2021,19(6):1811-1821.
Liu H C,Sun S,Xu X Q,et al. Identification and expressionanalysis of anthocyanin biosynthesis genes in Rosa chinensisand Rosa multiflora[J]. Molecular Plant Breeding,2021,19(6):1811-1821.
[20]Livak K J,Schmittgen T D. Analysis of relative geneexpression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4):402-408.
[21]Wahid A,Close T J. Expression of dehydrins under heat stressand their relationship with water relations of sugarcane leaves[J]. Biologia Plantarum,2007,51:104-109.
[22]Ibrahim A M H,Quick J S. Genetic control of high temperaturetolerance in wheat as measured by membrane thermal stability[J]. Crop Science,2001,41(5):1405-1407.
[23]Tommasino E,Griffa S,Grunberg K,et al. Malondialdehydecontent as a potential biochemical indicator of tolerant Cenchrusciliaris L. genotypes under heat stress treatment[J]. Grass andForage Science,2012,67(3):456-459.
[24]Vollenweider P,Günthardt-Goerg M S. Diagnosis of abioticand biotic stress factors using the visible symptoms in foliage[J]. Environmental Pollution,2005,137(3):455-465.
[25]姚富文.苹果耐高温基因的鉴定及褪黑素对高温胁迫的缓解效应[D].郑州:河南农业大学,2021.
Yao F W. Identification of high temperature tolerance genes inapple and the alleviating effect of melatonin on hightemperature stress [D]. Zhengzhou: Henan AgriculturalUniversity,2021.
[26]周永海,杨丽萍,马荣雪,等.外源褪黑素对高温胁迫下甜瓜幼苗抗氧化特性及其相关基因表达的影响[J].西北农业学报,2020,29(5):745-751.
Zhou Y H,Yang L P,Ma R X,et al. Effects of exogenousmelatonin on antioxidant properties and related gene expressionin melon seedlings under high temperature stress[J]. ActaAgriculturae Boreali-occidentalis Sinica,2020,29(5):745-751.
[27]王译,韩莹琰,郝敬虹,等.褪黑素对高温胁迫下生菜抗氧化酶系统的影响[J].北京农学院学报,2022,37(2):45-49.
Wang Y,Han Y Y,Hao J H,et al. Effects of melatonin onantioxidant enzyme of lettuce under high temperature stress[J].Journal of Beijing University of Agriculture,2022,37(2):45-49.
[28]苗琛,利容千,王建波.热胁迫下不结球白菜和甘蓝叶片组织结构的变化[J].武汉植物学研究,1994(3):207-211.
Miao C,Li R Q,Wang J B. Leaf structural changes of Brassicacampestris and B. oleracea in response to heat stress[J].Journal of Wuhan Botanical Research,1994(3):207-211.
[29]Bita C E,Gerats T. Plant tolerance to high temperature in achanging environment: scientific fundamentals and productionof heat stress-tolerant crops[J]. Frontiers in Plant Science,2013,4:273.
[30]彭勇政,刘智媛,朱晓非,等.5 个月季品种高温处理后生理指标变化及其耐热性评价[J].上海交通大学学报(农业科学版),2019,37(5):53-58.
Peng Y Z,Liu Z Y,Zhu X F,et al. Physiological index changesand heat tolerance evaluation of five rose cultivars after hightemperature treatment[J]. Journal of Shanghai Jiao TongUniversity(Agricultural Science),2019,37(5):53-58.
[31]窦宗信.高温胁迫对丰花月季生理效应及耐热性诱导的研究[D].兰州:甘肃农业大学,2006.
Dou Z X. Study on physiological effects and thermotoleranceinduction of Rosa chinensis var floribunda under hightemperature stress [D]. Lanzhou: Gansu AgriculturalUniversity,2006.
[32]Ashraf M,Harris P J C. Photosynthesis under stressfulenvironments: an overview[J]. Photosynthetica,2013,51(2):163-190.
[33]吴雪霞,张圣美,张爱冬,等.外源褪黑素对高温胁迫下茄子幼苗光合和生理特性的影响[J]. 植物生理学报,2019,55(1):49-60.
Wu X X,Zhang S M,Zhang A D,et al. Effect of exogenousmelatonin on photosynthetic and physiological characteristics ofeggplant seedlings under high temperature stress[J]. PlantPhysiology Journal,2019,55(1):49-60.
[34]王博伟,陈艳丽,朱国鹏,等.叶面喷施褪黑素对海南高温季节水培叶用莴苣生长生理的影响[J].中国蔬菜,2022(11):80-85.
Wang B W,Chen Y L,Zhu G P,et al. Effect of melatoninfoliar spraying on growth and physiology characteristics ofhydroponic lettuce during high temperature season in Hainan[J]. China Vegetables,2022(11):80-85.
[35]Wahid A,Gelani S,Ashraf M,et al. Heat tolerance in plants:an overview[J]. Environmental and Experimental Botany,2007,61(3):199-223.
[36]Wang W X,Vinocur B,Shoseyov O,et al. Role of plant heatshockproteins and molecular chaperones in the abiotic stressresponse[J]. Trends in Plant Science,2004,9(5):244-252.
[37]Xu W,Cai S Y,Zhang Y,et al. Melatonin enhancesthermotolerance by promoting cellular protein protection intomato plants[J]. Journal of Pineal Research,2016,61(4):457-469.
[38]Qi Z Y,Wang K X,Yan M Y,et al. Melatonin alleviates hightemperature-induced pollen abortion in Solanum lycopersicum[J]. Molecules,2018,23(2):386.
[39]Xia H,Zhou Y J,Deng H H,et al. Melatonin improves heattolerance in Actinidia deliciosa via carotenoid biosynthesis andheat shock proteins expression[J]. Physiologia Plantarum,2021,172(3):1582-1593.
[40]胡少卿. 外源褪黑素对菊花高温胁迫缓解生理机制的研究[D].泰安:山东农业大学,2020.
Hu S Q. Study on the mechanism of exogenous melatoninrelieving physiology of Chrysanthemum under high temperaturestress[D]. Taian:Shandong Agricultural University,2020.
(编辑:郭玥微)

