新型冠状病毒感染对阻塞性睡眠呼吸暂停综合征患者无痛胃镜检查中呼吸功能的影响
付琦,廉仲明,秦菲菲,黄亚茹,田丹丹
(郑州大学第一附属医院 麻醉与围术期医学部,河南 郑州 450052)
新型冠状病毒(corona virus disease 2019,COVID-19)的大流行导致了全球公共卫生危机[1-2]。目前COVID-19感染后遗症备受关注,其中肺部并发症尤为常见,包括但不限于呼吸困难、呼吸机依赖、肺功能异常和纤维化肺疾病,即使在症状消失后,肺部生理也仍可能存在异常[3],因此围手术期呼吸道管理面临严重挑战[4]。无痛胃肠内镜检查在临床上广泛应用,为满足检查要求常规需使用静脉麻醉药,但对患者呼吸、循环系统具有抑制作用,尤其是对于合并阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)的患者,可能会反复出现呼吸暂停、低通气和低氧血症[5]。因此,本研究旨在调查COVID-19感染对于OSAS患者接受无痛胃镜检查时呼吸功能的影响,为临床工作提供参考,降低围手术期呼吸抑制风险。
1 对象与方法
1.1 研究对象
本研究经郑州大学第一附属医院科研与临床试验伦理委员会批准(2022-KY-0813),选取2023年1—3月于郑州大学第一附属医院接受无痛胃镜检查且合并OSAS的60例患者,所有患者均签署知情同意书。根据是否感染过COVID-19分为两组,对照组(未感染组)30例,观察组(已感染组)30例。其中对照组男20例,女10例;年龄19~70(51.43±15.29)岁;体重指数29.87~40.11 kg·m-2,中位数及四分位数为31.78(30.52,35.07)kg·m-2;美国麻醉医师协会Ⅰ级7例,Ⅱ级23例。观察组男22例,女8例;年龄21~67(47.91±13.78)岁;体重指数27.35~38.05 kg·m-2,中位数及四分位数为31.17(30.33,33.05)kg·m-2;美国麻醉医师协会Ⅰ级5例,Ⅱ级25例。两组患者一般资料差异无统计学意义(P>0.05)。
1.2 选取标准

1.3 检查方法
患者入室后,选左侧卧位,使用微旁流采样管路吸氧,流量为5 L·min-1,连接微旁流呼吸末二氧化碳监测仪(CapnostreamTM 20p),严密监测患者血氧饱和度(percutaneous arterial oxygen saturation,SpO2)、心电图、血压。患者安静2 min后记录基线生命体征。充分吸氧后进行麻醉诱导,两组患者均接受静脉注射阿芬太尼注射液0.2 μg·kg-1,苯磺酸瑞马唑仑注射液0.25 mg·kg-1,给药时间均超过30 s。同时评估患者改良警觉/镇静评分,低于1分则开始胃镜检查;若给药后1 min改良警觉/镇静评分仍超过1分则进行镇静补救,追加0.1 mg·kg-1的瑞马唑仑注射液,直至镇静充分,随后所有患者均由同一位经验丰富的内镜医生使用同一规格胃镜进行检查。检查及复苏过程中,若出现SpO2<93%,可给予托下颌、面罩辅助通气等相对应处理,若患者氧合仍无改善,可使用声门上气道装置。麻醉过程中如出现低血压(平均动脉压下降>基线值的20%)则根据患者情况由麻醉科医师决定给予甲氧明0.5 mg或麻黄碱6 mg;如出现心动过缓(心率<60次·min-1),则给予阿托品0.3 mg。
1.4 观察指标
(1)呼吸相关不良事件:观察两组诱导、检查及复苏过程中呼吸暂停发生情况,并记录呼吸暂停发生次数、呼吸暂停时间。其中呼吸暂停定义为微旁流呼吸末二氧化碳监测仪报警,即CO2呼出暂停>15 s,综合肺指数(integrated pulmonary index,IPI)≤4分[6],以及其他检测到的任何呼吸暂停。(2)生命体征:记录两组患者基线(T0)、给药后1 min(T1)、2 min(T2)、3 min(T3)时的心率、SpO2及血压。(3)不良反应:记录两组麻醉期间出现的低血压、心动过缓、恶心呕吐等情况。(4)满意度情况:检查结束后,对患者进行满意度调查。使用视觉模拟评分(0~10分)评估两组满意度情况,满意为评分≥8分;基本满意为评分5~7分,不满意为评分<5分。
1.5 统计学方法

2 结果
2.1 呼吸功能
观察组呼吸暂停次数多于对照组,呼吸暂停时间长于对照组(P<0.05);两组患者呼吸暂停发生率差异无统计学意义(P>0.05)。见表1。

表1 两组呼吸暂停情况比较
2.2 生命体征
两组心率、SpO2及平均动脉压组内及组间各时间点比较,差异均无统计学意义(P>0.05)。见表2。
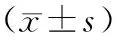
表2 两组生命体征情况比较
2.3 无痛胃镜检查相关时间
两组患者诱导时间、检查时间及离室时间比较,差异均无统计学意义(P>0.05)。见表3。
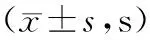
表3 无痛胃镜检查相关时间比较
2.4 不良反应
观察组心动过缓发生率高于对照组(P<0.05);两组低血压及恶心呕吐发生率差异无统计学意义(P>0.05)。见表4。

表4 两组不良反应发生率比较[n(%)]
2.5 患者满意度
对照组满意21例,基本满意8例,不满意1例;观察组满意25例,基本满意3例,不满意2例。对照组满意度(97.0%)与观察组(93.0%)差异无统计学意义(Z=1.073,P=0.283)。
3 讨论
COVID-19疫情在全球迅速蔓延,WHO将感染COVID-19病毒后3个月内出现且持续至少2个月以上的症状定义为“长COVID-19”[2,7]。据统计大概有6 500万或更多的人面临困扰,睡眠和心身健康受到严重影响,尤其对于已有基础疾病(例如合并OSAS)的患者[3,8]。但目前尚不能完全理解长COVID-19的机制,定义也存在争议。既往研究表明,合并OSAS的患者术后并发症风险显著增加,尤其是呼吸、循环系统不良事件发生率增加2~3倍[9-10]。因此,本研究旨在调查COVID-19感染对于OSAS患者接受无痛胃肠内镜检查时呼吸功能的影响。
呼吸抑制是无痛胃肠镜最常见的不良反应之一,精确监测患者通气状态对患者安全至关重要[11]。呼出气二氧化碳监测仪是一种临床广泛应用的呼吸功能监测仪器,其测定的呼气末二氧化碳分压可有效反映患者的肺泡通气水平与肺血流,并可准确预测非插管患者呼吸不良事件的发生风险。其中微旁流式二氧化碳监测仪可在采集患者鼻部与口腔呼出气体的同时满足供氧需求,可有效监测非插管患者镇静状态下的通气状况[12-15]。同时,对于呼吸暂停的监测,呼气末二氧化碳往往比指脉氧监测更加敏感。因此本研究使用微旁流呼吸末二氧化碳监测仪监测患者呼吸。瑞马唑仑是一种超短效苯二氮卓类药物,具有起效快、恢复快、对心血管系统和呼吸系统抑制轻微的特点;阿芬太尼用于日间手术患者,具有见效快、恢复快、安全性高、镇痛效果好、能保持自主呼吸、不易诱发咳嗽、PONV发生率低等优点。既往研究发现,瑞马唑仑和阿芬太尼对患者呼吸和循环功能影响小,术后不良反应少,患者满意度高,用于胃肠镜手术安全、有效[16]。因此本研究选用瑞马唑仑复合阿芬太尼诱导以期降低OSAS患者胃镜检查过程中的不良反应,保证患者安全。本研究结果显示,观察组呼吸暂停次数多于对照组,呼吸暂停时间长于对照组,表明经历COVID-19感染后的OSAS患者虽然已无临床症状,但在无痛胃肠镜中呼吸抑制的发生率升高。这与目前对于COVID-19的研究结果相符,由于急性感染而发生的许多变化可促进纤维化并导致长期并发症[17]。SARS-CoV2病毒可直接进入细胞,特别是稳定上皮屏障的Ⅱ型肺泡上皮细胞,诱发细胞凋亡,进而导致促炎因子的增加,造成弥漫性肺泡损伤和淋巴细胞、巨噬细胞和中性粒细胞聚集,最终导致纤维化。除了对肺实质的直接损伤外,SARS-CoV2病毒对肺血管的损伤也有报道。早期尸检研究显示在肺血管的小血管内存在微血栓[18]。因此患者呼吸系统对于麻醉药物的耐受性下降,产生呼吸抑制,呼吸暂停的次数和总时间均增加。
本研究结果显示,两组患者各时间点生命体征均无统计学差异,表明OSAS患者感染COVID-19对无痛胃肠内镜检查引起的循环系统波动较小。有报道表明,COVID-19对神经系统的亲和力与其刺突蛋白(S蛋白)有关,它可以与血管紧张素转换酶2相互作用,促进病毒进入神经细胞[19-20]。SARS-CoV2病毒引起的神经损伤分子机制可能与直接的病毒效应、免疫、炎症和其他因素有关,而神经系统损伤的一种表现是自主神经系统破坏,交感神经系统活动增加,无法适当调节,从而导致自主神经功能包括血压变异性和心率变异性的变化,以及直立性低血压和体位性心动过速综合征[18,21-22]。本研究未能观察到此项表现,可能与本试验麻醉药物选择相关,与丙泊酚与舒芬太尼相比,瑞马唑仑与阿芬太尼对循环系统抑制作用较弱。本研究结果表明,观察组心动过缓的发生率高于对照组,这可能是因为麻醉药物引起心肌抑制,感染COVID-19的患者自主神经系统破坏,调节能力减弱,从而导致心率减慢。
4 小结
COVID-19感染对于接受无痛胃肠内镜检查时OSAS患者的呼吸系统有显著的影响,可增加呼吸暂停次数,延长呼吸暂停总时间,患者呼吸抑制风险显著增加。但COVID-19感染对于其循环系统无显著负面影响,患者满意度相似。值得注意的是,本结果仅限于进行无痛胃肠内镜检查的OSAS患者,可能存在一定的偏倚,未来可以对不同手术类型及不同人群进一步研究,以便为麻醉医生在长COVID-19期间进行更好的术前评估以及预处理提供循证依据,降低患者围手术期风险。

