基于超声影像组学及临床特征构建乳腺癌列线图的预测模型
张盼盼,孙医学,李 阳,李 林,杜 欢,路丽丽,乔佳业
(蚌埠医学院第一附属医院超声医学科,安徽 蚌埠 233017)
根据2020年癌症数据统计,乳腺癌已经成为女性癌症死亡的主要原因[1],早发现和早诊断对于乳腺癌治疗决策和提高生存率至关重要[2]。超声是我国乳腺癌筛查的首选方法[3],规范化的乳腺影像报告数据系统(Breast imaging reporting and data system,BI-RADS)已在临床得到广泛应用。BI-RADS使用人为规定的特征描述符作为超声图像分类依据,缺少客观的定量数据,高度依赖于超声医师的经验和主观判断,准确性存在争议[4]。因此,术前如何实现对乳腺肿块的定量评估是临床面临的重要问题。近年来随着人工智能和大数据技术发展,影像组学方法应运而生[5],其可从超声图像提取特征数据,实现对形态、回声等的量化表达,减少主观判断,提供更加客观的定量预测数据,辅助医师决策[6]。多数研究方法仅提取病灶的影像组学特征或临床危险因素单独来分析,未将两者相结合。本研究旨在应用影像组学方法实现对乳腺癌超声图像的量化表达并与临床危险因素整合构建联合模型,并探讨其在乳腺良恶性肿瘤中的应用价值。
1 资料与方法
1.1 研究对象回顾性收集2020年10月—2023年2月于我院行超声检查的女性患者共525例。将纳入的525个病灶按照7∶3的比例随机分为训练组(368例)和验证组(157例)。纳入标准:①病理诊断结果明确;②临床资料完整,包括患者年龄、超声设备、肿块最长径、肿瘤位置等信息;③术前1周内行超声检查。排除标准:①由于伪影、钙化等采集的图像质量显示欠佳;②在超声检查前接受放疗和/或化疗的患者;③肿块过大超过单幅B型超声图像边界。本研究经我院伦理委员会批准。
1.2 仪器与方法
1.2.1 图像采集采用百胜Mylab Twice(频率为4~12 MHz的线阵探头)和LOGIQ E9(频率为6~15 MHz的线阵探头)彩色多普勒诊断仪。由2名超声医师(分别具有7年和8年超声工作经验)对乳腺病灶进行检查,调节仪器参数、优化图像质量后,记录病灶最大径线切面灰度图像并存储为DICOM格式。
1.2.2 影像组学特征提取在病理结果与临床资料均不知情的情况下,由1名工作5年的超声科医师使用3D-slicer软件对目标病灶进行描记(图1),需要注意的是勾画感兴趣区域时尽可能沿肿块轮廓进行,随后使用pyradiomics软件从ROI中进行影像组学特征的提取。2个月后,随机抽取100例目标病灶,由该医师和另1名工作4年的超声科医师再次对肿块进行描记,采用组内相关系数(Intra-class correlation coefficient,ICC)用于评估观察者及观察者间一致性[7]。

图1 影像组学特征提取
1.2.3 影像组学特征筛选为了消除冗余特征对建模过程的影响,使用LASSO回归筛选出权重影响较大的影像组学特征,并建模后计算得到影像组学评分(Radiomics score,Rad-Score)。
1.2.4 模型建立采用单因素和多因素Logistic回归分析,以P<0.05的临床因素作为危险因素,同时,采用Logistic回归方法建立基于Rad-Score与临床危险因素的乳腺癌联合模型,基于联合模型绘制列线图将结果进行可视化。
1.3 统计学处理数据采用R(version 4.0.2)和IBM SPSS 25.0软件进行分析。计数资料以n(%)表示,组间比较采用卡方检验。计量资料以±s表示,符合正态分布的连续变量采用独立样本t检验。使用ICC评价特征提取的可重复性,ICC>0.75认为重复性较好。通过分析AUC及校准曲线来评估模型的性能,采用DeLong检验比较不同模型AUC的差异。检验水准α=0.05。
2 结果
2.1 病例基线特征共纳入了525例女性患者的525例乳腺肿块,病理确诊为恶性284例(54.10%),良性241例(45.90%)。记录采集每个肿块的最大径线切面超声图像,共525幅图像作为研究样本,其中训练集图像368幅,验证集图像157幅。训练集和验证集的基线信息中患者年龄、肿块最长径、肿块位置及机器型号占比、影像组学评分差异均无统计学意义(P>0.05)(表1)。

表1 训练集和验证集入组患者的基线资料
2.2 影像组学特征提取和筛选从入组患者的超声图像中共提取了851个超声影像组学特征,随机选取100例病灶,其ICC值为0.776~0.897,说明观察者和观察者间重复性良好。
采用LASSO回归方法进行特征筛选(图2),最终13个非零系数权重较大的特征被选择(图3)。

图2 使用LASSO回归进行影像组学特征选择
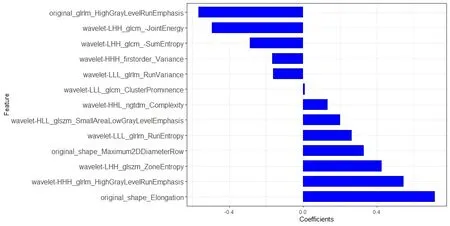
图3 使用LASSO回归筛选的13个超声影像组学特征
2.3 联合模型构建通过单因素和多因素Logistic回归分析,最终确定患者年龄为临床独立危险因素(表2)。基于LASSO回归将所选特征和相应加权系数的乘积相加,构建影像组学模型,计算Rad-score。基于年龄和Rad-score构建乳腺癌预测联合模型,并绘制列线图(图4)。

表2 临床危险因素的单因素及多因素Logistic回归分析
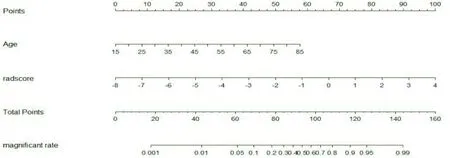
图4 基于临床危险因素和Rad-Score构建乳腺癌预测模型的列线图
Rad-score=(-0.168)×wavelet-HHH_firstorder_Variance + 0.713×original_shape_Elongation+0.328×original_shape_Maximum2DDiameterRow(-0.493)×wavelet-LHH_glcm_-JointEnergy+ (-0.565)×original_glrlm_HighGrayLevelRunEmphasis+(-0.287)×wavelet-LHH_glcm_-SumEntropy+(-0.163)×wavelet-LLL_glrlm_RunVariance+0.545×wavelet-HHH_glrlm_HighGrayLevelRunEmphasis + 0.134 × wavelet-HHL_ngtdm_Complexity + 0.426 × wavelet-LHH_glszm_ZoneEntropy + 0.2×wavelet-HLL_glszm_SmallAreaLowGrayLevelEmphasis + 0.009 × wavelet-LLL_glcm_ClusterProminence + 0.262 × wavelet-LLL_glrlm_RunEntropy+0.224。
2.4 列线图预测模型的临床应用和效能评估在训练集和验证集中,临床模型的AUC值分别为:0.772、0.847;影像组学模型的AUC值分别为:0.790、0.820;联合模型的AUC值分别为:0.846、0.909(图5)。DeLong检验显示在训练集和验证集中,联合模型优于临床模型(P<0.05),联合模型与影像组学模型及影像组学模型与临床模型之间差异无统计学意义(P>0.05)。在训练集和验证集中联合模型的校准曲线,可以看出其预测乳腺癌风险概率与实际发生率较为接近(图6),可以更好地指导临床决策。

图5 训练集和验证集中3种预测模型的ROC曲线
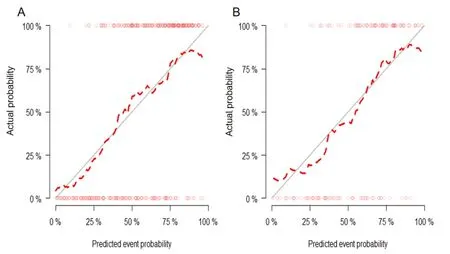
图6 联合模型在训练集和验证集中的校准曲线
校准曲线表示预测值对应的实际值,如果预测值=实际值,则与对角线重合。
3 讨论
近年来,影像组学被认为是一种有效的和无创的预测乳腺癌状态的方法,但大多数研究是基于乳腺X线摄影和MRI成像[8-9]。然而,基于形态学特征的乳腺BI-RADS分级按照人为规定的描述符来判断图像高度依赖于超声医师的积累和经验,缺少量化指标,诊断可靠性也存在争议[10]。随着人工智能和大数据技术浪潮的推动,加速产生了新的影像组学方法,其可从肿瘤影像提取深层次的高维特征数据实现量化表达,并运用机器学习技术分析和建立模型,预测疾病风险,辅助临床决策。
本研究中,我们研究了从乳腺癌患者的灰度超声图像中提取的超声影像组学特征是否可以作为乳腺癌危险因素的预测指标,并提出了一种预测乳腺癌的新方法。从每个乳腺肿块中共提取851个超声影像组学特征,使用LASSO回归进行降维分析后,筛选出13个超声影像组学特征作为构建Rad-Score模型的指标,其中包括3个灰度共生矩阵(Gray-level co-occurrence matrix, GLCM)、4个灰度游程矩阵和2个灰度大小区域矩阵特征,这些特征代表了肿瘤的组学复杂性,对于识别和分类肿瘤病变的内部空间异质性具有重要意义[11-12]。GLCM纹理特征描述了在不同方向以及像素或体素之间的预定义距离,捕获具有预定义灰度强度的像素对或体素对的空间关系[13],灰度共生矩阵反映图像在方向、变化幅度及局部病变的灰阶分布信息,有研究[14]表明MRI灰度共生矩阵可鉴别乳腺肿块的良恶性,也给本研究结果提供了支撑。本研究不仅建立还验证了影像组学模型的性能,训练集和验证集中的AUC值分别为0.790和0.820。通过Logistic回归分析,筛选出年龄作为与乳腺癌高表达相关的危险因素,结合年龄和Rad-Score构建的联合预测模型,显示出略高的预测性能。表明影像组学模型对乳腺癌具有较高的预测性能,结合年龄危险因素构建的联合模型有较高的预测性能。通过校准曲线评价了乳腺癌联合模型的预测概率与实际结果具有一致性。
近年来,基于乳腺癌构建的列线图也同样获得了较好的诊断效能。ZHANG S等[15]通过超声影像组学特征和临床危险因素构建的列线图在鉴别乳腺BI-RADS 4类病变方面表现较好。YANG K等[16]通过常规超声和双模式弹性成像鉴别乳腺良恶性肿块构建的列线图取得良好的临床效益。与ZHANG S等[15]研究相比,本研究的数据量更大,不仅仅涉及BI-RADS 4类的病变,而是包含了更多BI-RADS类型的乳腺肿块;与YANG K等[16]研究不同的是本研究采用定量的影像组学数据,不会过度依赖超声医师的经验,从而减少对乳腺肿块边缘、形状、边界及后方特征等的判别。
虽然本研究中联合模型与影像组学模型及影像组学模型与临床模型AUC差异均无统计学意义,但是与临床模型相比,联合模型表现出显著的预测性能,说明联合模型对乳腺癌有良好的预测效果。在外部验证中,联合模型仍表现出最高的AUC,表明该预测模型的稳定性和一致性较好。
单一的指标已不能满足如今个体化治疗的需求,我们需将获得的信息综合分析,才能较准确地预测病变并促进精准医疗。本研究的创新之处在于将临床危险因素及超声影像组学评分纳入列线图,采用更客观的定量参数较准确地评估了术前对乳腺良恶性肿块的预测能力。然而,本研究还需要进一步的前瞻性设计和更大样本、多中心研究来验证其可行性。
总之,基于临床危险因素和Rad-Score构建的术前预测乳腺癌风险的联合模型,对乳腺癌具有较高的预测价值,可以有效解决基层和部分低年资医生因肿瘤异质性难以定量评估的问题。这种列线图有望为治疗策略提供信息,并协助临床决策。

