rhBNP 联合PCI 术治疗急性心肌梗死合并心力衰竭的效果及安全性
牛保良
(河南省安阳市第六人民医院 安阳 455000)
急性心肌梗死(AMI)是由急性、持续性冠状动脉血供中断,心肌严重缺氧缺血引发,常合并心力衰竭(以下简称“心衰”),具有显著的致残以及致死率,需及时进行科学治疗。经皮冠状动脉介入治疗术(PCI)是能够有效解除冠状动脉狭窄的治疗技术,不仅能有效恢复AMI 合并心衰患者缺血坏死心肌血流灌注,而且能够迅速有效地保护心肌,抑制心肌重构[1]。但有研究指出,经过PCI 治疗后的冠状动脉血管虽被打通,但是由于心肌损坏程度不同,心肌结构及功能的恢复程度也存在差异[2]。因此,PCI 治疗AMI 合并心衰后对心肌的保护治疗将会直接影响最终治疗效果及预后改善情况。有研究指出,心脏在受损时左心室会大量分泌B 型钠尿肽(BNP)对心脏机能进行代偿性保护,BNP 进入血液后可加强受损心肌抗缺血缺氧能力及拮抗神经体液的过度激活,从而保护心脏功能和防止心衰进展[3]。当前,随着对BNP 研究的不断深入,重组人脑利钠肽(rhBNP)得以研发,并在AMI 合并心力衰竭患者中得到了越来越多的应用。为进一步探究rhBNP 联合PCI 治疗AMI 合并心衰是否有累积效应,以期更高的疗效,本研究分析rhBNP 联合PCI 治疗AMI 合并心衰的有效性及安全性。现报道如下:
1 资料与方法
1.1 一般资料 选择2020 年1 月至2022 年1 月就诊于河南省安阳市第六人民医院的80 例AMI 合并心衰患者,按随机对照原则分组,对照组以及研究组均为40 例。诊断标准:AMI、心衰分别符合《内科学(第9 版)》[4]、《中国心力衰竭诊断和治疗指南2014》中[5]诊断标准。纳入标准:符合上述诊断标准;认知功能、沟通能力与视听觉正常;年龄40~70 岁;AMI 首次发病;持续性心肌缺血大于30 min;知晓本研究内容自愿签署知情同意书;积极配合治疗,服药依从性高。排除标准:存在PCI 禁忌和rhBNP 药物过敏;病情不稳定无法耐受手术l h 以上;凝血功能异常或有出血倾向;存在严重肝、肾、脑功能障碍;近3 个月内有严重外伤或接受过重大手术;并发心源性休克;合并其他心脏疾病,如限制性心肌病、扩张型心肌病等;PCI 治疗失败;合并影响预后的疾病,如恶性肿瘤、免疫功能缺陷等。两组基础资料均衡可比(P>0.05)。见表1。本研究已获河南省安阳市第六人民医院医学伦理委员会批准(批准文号:伦理字201900120056 号)。
表1 两组基线资料比较()
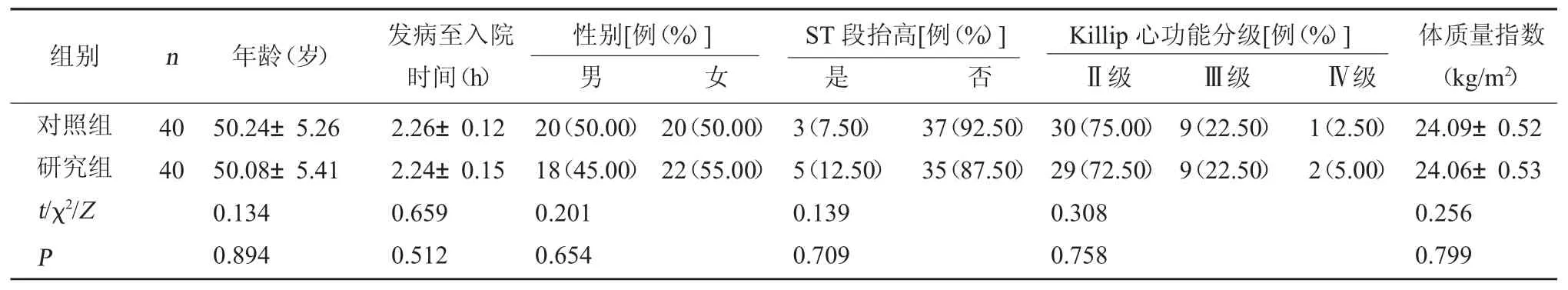
表1 两组基线资料比较()
组别n年龄(岁)发病至入院时间(h)性别[例(%)] 男女ST 段抬高[例(%)] 是否Killip 心功能分级[例(%)] Ⅱ级Ⅲ级Ⅳ级体质量指数(kg/m2)对照组研究组t/χ2/Z P 40 40 50.24±5.26 50.08±5.41 0.134 0.894 2.26±0.12 2.24±0.15 0.659 0.512 20(50.00)18(45.00)0.201 0.654 20(50.00)22(55.00)3(7.50)5(12.50)0.139 0.709 37(92.50)35(87.50)30(75.00)29(72.50)0.308 0.758 9(22.50)9(22.50)1(2.50)2(5.00)24.09±0.52 24.06±0.53 0.256 0.799
1.2 治疗方法 (1)入院后,均对患者完成体格检查、心电图和血液检验等基础检查。嚼服300 mg 阿司匹林肠溶片(国药准字H20065051)、600 mg 硫酸氢氯吡格雷(国药准字H20143419)、20 mg 阿托伐他汀钙片(注册证号H20140866)。完善术前准备后送入介入治疗室开展PCI 治疗,采用1%盐酸利多卡因注射液(国药准字H20173168)局麻处理,选择桡动脉为穿刺点,置入6F 动脉鞘管,沿鞘管置入造影导管。选用荷兰飞利浦UNIQ Clarity FD20 型血管造影系统,使用碘海醇注射液(国药准字H20031169)对冠状动脉行标准体位(左冠脉6 个体位,右冠脉3 个体位)造影,每支血管采用相互垂直的2 个体位进行造影,测量影像学结果,明确冠状动脉病变程度、梗死部位及狭窄程度后于冠状动脉病变部位植入药物洗脱支架行PCI 治疗。2 h 后拔除桡动脉鞘管,绷带加压包扎处理,定时查看穿刺部位出血、血肿情况。密切查看患者生命体征,术后常规开展抗炎、抗凝治疗。择期再次开展冠状动脉造影,以TIMI 血流达到Ⅲ级且冠脉残余狭窄程度<10%为PCI 介入治疗成功的标准。PCI 术后对患者实施常规抗心衰治疗:包括控制高血压、糖尿病等危险因素;消除心衰诱因,如控制感染、治疗心律失常、纠正贫血及电解质紊乱等;使用抗血小板聚集药物和他汀类调脂药物进行二级预防;根据病情调整利尿剂、硝酸酯和强心剂的用法用量;从小剂量开始应用血管紧张素转换酶抑制剂,逐渐递增直至达到目标剂量,一般每隔1~2 周剂量倍增1 次,滴定剂量及过程需个体化。调整到合适剂量后应终身维持使用,避免突然撤药。期间应监测血压、血钾和肾功能,如果肌酐增高>30%应减量,如仍继续升高,应停用。(2)研究组在PCI 治疗后给予rhBNP 治疗。在患者血流动力学相对稳定、收缩压≥90 mmHg 后静脉注射rhBNP(国药准字S20050033),负荷量为1.5 μg/kg,5 min 内注射完成,然后微量泵持续静脉泵入,起始剂量0.007 5 μg/(kg·min),在6 h 内依据患者病情和血压将泵入剂量调整至耐受范围,持续静脉泵入72h,泵药期间监测患者血压,维持收缩压≥85mmHg,平均动脉压≥70 mmHg,若发生低血压,应减少用药剂量或停止用药,待血压恢复正常后再重新用药。连续用药7 d。治疗后随访3 个月。
1.3 观察指标 (1)临床疗效。参考《临床疾病诊断与疗效判断标准》[6]评价治疗3 个月后临床疗效。显效:TIMI 血流达到Ⅲ级且冠脉残余狭窄程度<10%,心功能提高至Ⅰ级,且临床症状明显改善;有效:TIMI 血流Ⅱ级及以上,心功能提升但未到Ⅰ级,临床症状有所改善;无效:TIMI 血流Ⅱ级以下,心功能无提升,临床症状无改善,甚至更严重,总有效=显效+有效。(2)炎症因子水平。分别于治疗前后采集患者6 mL(均分为2 份)空腹静脉血,离心得血清。借助贝克曼IAMMGE 以酶联免疫法对肿瘤坏死因子-α(TNF-α)、C 反应蛋白(CRP)水平进行测定;使用M240172-γ 放射免疫计数器,以放射免疫分析法对白细胞介素-6(IL-6)水平进行测定。(3)心肌损伤指标。分别于治疗前后抽取患者空腹静脉血3 mL,离心后得血清,采用日产OLYMUS ALL600型全自动生化分析仪检测肌酸激酶同工酶(CK-MB)、肌酸激酶(CK),以化学发光法(美国Sigma 公司)测定肌钙蛋白Ⅰ(cTnⅠ)。(4)心功能指标。使用彩色多普勒超声诊断仪(美国惠普公司,5000 型号) 检测治疗前后左心室收缩末期容积(LVESV)、左心室舒张末期容积(LVEDV)、左心室射血分数(LVEF)等指标。(5)不良反应发生率。统计治疗期间不良反应,包括低血压、急性肾功能异常、头晕头疼、恶心呕吐等。(6)不良心血管事件发生率。主要有恶性心律失常、全因死亡、心源性猝死、再次心肌梗死及支架血栓。
1.4 统计学方法 使用SPSS22.0 软件处理数据,所有计量资料经Shapiro-Wilk 正态性检验,以()表示计量资料,并行t检验;用%表示计数资料,并行χ2检验,等级资料行秩和检验,P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效 研究组治疗3 个月后的总有效率较对照组明显升高(P<0.05)。见表2。
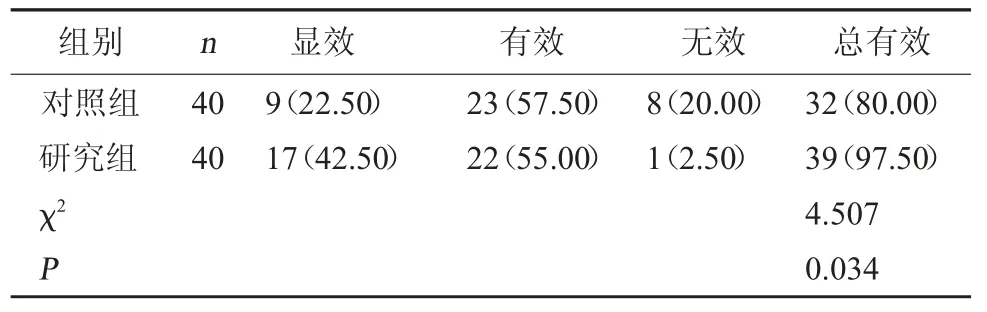
表2 两组治疗后临床疗效对比[例(%)]
2.2 炎症因子水平 研究组与对照组治疗前血清TNF-α、CRP 及IL-6 水平比较,差异无统计学意义(P>0.05);研究组治疗后的炎症因子水平均较对照组下降更明显(P<0.05)。见表3。
表3 两组治疗前后炎症因子水平对比()
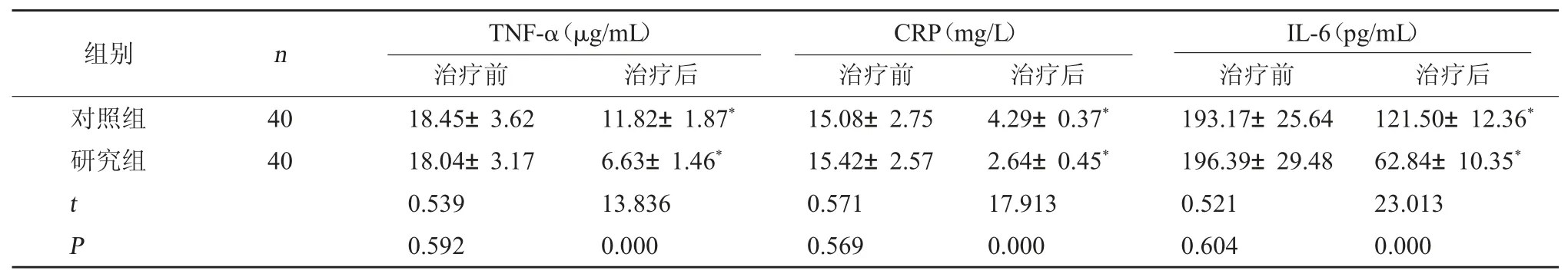
表3 两组治疗前后炎症因子水平对比()
注:相比本组治疗前,*P<0.05。
IL-6(pg/mL)治疗前治疗后对照组研究组组别nTNF-α(μg/mL)治疗前治疗后CRP(mg/L)治疗前治疗后40 40 tP 18.45±3.62 18.04±3.17 0.539 0.592 11.82±1.87*6.63±1.46*13.836 0.000 15.08±2.75 15.42±2.57 0.571 0.569 4.29±0.37*2.64±0.45*17.913 0.000 193.17±25.64 196.39±29.48 0.521 0.604 121.50±12.36*62.84±10.35*23.013 0.000
2.3 心肌损伤指标 研究组与对照组治疗前CK-MB、CK、cTnⅠ相比,差异无统计学意义(P>0.05);研究组治疗后心肌损伤指标均较对照组降低更明显(P<0.05)。见表4。
表4 两组治疗前后心肌损伤指标对比()
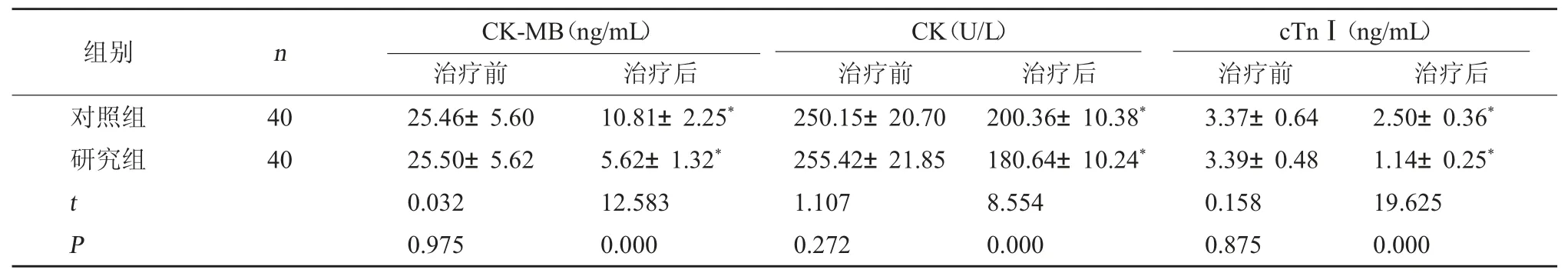
表4 两组治疗前后心肌损伤指标对比()
注:相比本组治疗前,*P<0.05。
cTnⅠ(ng/mL)治疗前治疗后对照组研究组组别nCK-MB(ng/mL)治疗前治疗后CK(U/L)治疗前治疗后40 40 tP 25.46±5.60 25.50±5.62 0.032 0.975 10.81±2.25*5.62±1.32*12.583 0.000 250.15±20.70 255.42±21.85 1.107 0.272 200.36±10.38*180.64±10.24*8.554 0.000 3.37±0.64 3.39±0.48 0.158 0.875 2.50±0.36*1.14±0.25*19.625 0.000
2.4 心功能指标 研究组与对照组治疗前LVEDV、LVESV、LVEF 相比,差异无统计学意义(P>0.05);研究组治疗后LVEDV、LVESV 比对照组低,LVEF 比对照组高(P<0.05)。见表5。
表5 两组治疗前后心功能指标对比()
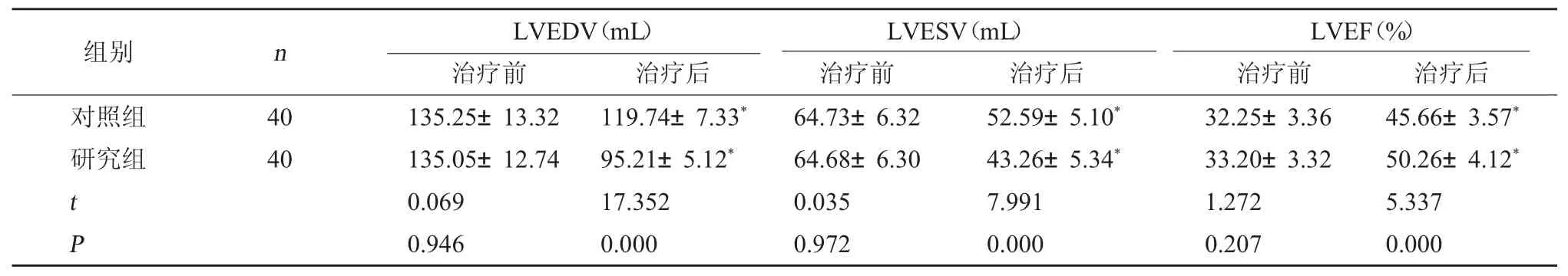
表5 两组治疗前后心功能指标对比()
注:相比本组治疗前,*P<0.05。
LVEF(%)治疗前治疗后对照组研究组组别nLVEDV(mL)治疗前治疗后LVESV(mL)治疗前治疗后40 40 tP 135.25±13.32 135.05±12.74 0.069 0.946 119.74±7.33*95.21±5.12*17.352 0.000 64.73±6.32 64.68±6.30 0.035 0.972 52.59±5.10*43.26±5.34*7.991 0.000 32.25±3.36 33.20±3.32 1.272 0.207 45.66±3.57*50.26±4.12*5.337 0.000
2.5 不良反应发生情况 研究组治疗3 个月期间出现低血压、急性肾功能异常、头晕头疼、恶心呕吐等不良反应发生率相比对照组有所增加,但差异无统计学意义(P>0.05)。见表6。
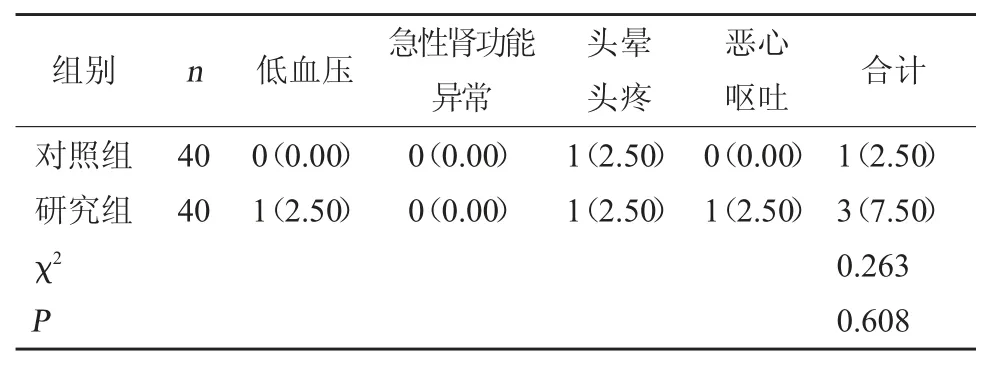
表6 两组治疗期间不良反应对比[例(%)]
2.6 不良心血管事件发生情况 研究组随访期间不良心血管事件发生率相比对照组显著下降(P<0.05)。见表7。
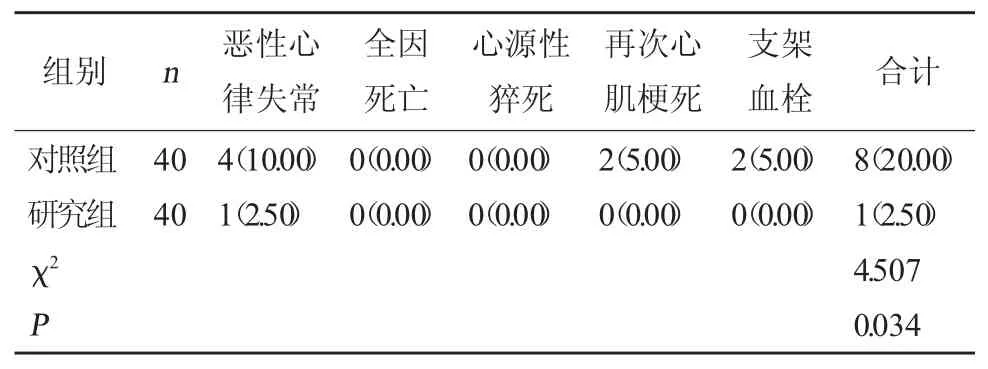
表7 两组随访期间不良心血管事件发生率对比[例(%)]
3 讨论
在AMI 发病时,神经内分泌系统过度激活会分泌出多种炎症因子(如TNF-α、CRP 及IL-6)、心肌损伤因子(如CK-MB、cTnⅠ、CK)加大心肌细胞压力负荷,促使坏死的心肌细胞纤维化,进而引起心衰,加重患者病情严重程度的同时增加病死风险。有研究指出,针对AMI 合并心衰患者,采取有效措施尽快疏通阻塞的血管,恢复心肌细胞正常血流及血氧的有效灌注,缩小梗死心肌细胞面积及促进患者心功能恢复是改善患者预后的关键所在[7~8]。
PCI 能够较为快速地打通堵塞的冠状动脉并有效恢复心肌血流灌注情况,从而减小心肌梗死面积,及时挽救AMI 患者生命。但在使用PCI 治疗AMI合并心衰患者时,部分患者因术后梗死区域心肌组织无法完全恢复血液灌注而造成心功能恶化,不良心血管事件发生率较高[9]。因而,在PCI 治疗后仍需联合有效治疗方案,以改善患者心功能。临床有研究发现,rhBNP 作为新型治疗心力衰竭的药物,对改善患者心功能有重要意义[10]。本研究中研究组治疗后血清炎症因子水平均较对照组明显降低;研究组治疗后CK-MB、CK、cTnⅠ水平均明显低于对照组。证实rhBNP 联合PCI 治疗AMI 合并心衰,能有效减轻患者机体炎症反应及心肌损伤程度。分析其原因与以下几点有关:(1)rhBNP 主要成分是BNP,与人体内源性BNP 具有相同的生物活性、分子结构,也能发挥相同的作用。rhBNP 给药后对神经内分泌活动可产生天然的抵抗作用,能通过改善心脏自主神经调节功能来抑制神经内分泌系统的过度激活,最终起到减轻机体炎症反应的目的[11]。(2)rhBNP 给药后能高效结合利钠肽受体,帮助鸟苷酸环化酶转化为环单磷酸鸟苷作用于多个器官,能促使细胞膜钾离子通道扩大开放,有利于增加内源性血管舒张物质的分泌量,进而扩张冠状动脉血管及提升冠状动脉血液流量,缓解心肌细胞的缺血缺氧情况,从而有效减轻心肌细胞再灌注损伤[12~13]。并且,rhBNP 可对心肌细胞的凋亡和坏死起到抑制作用,能有效缩减心肌细胞的梗死面积进而减轻心脏前后负荷,利于降低心肌细胞耗氧量及逆转坏死的心肌细胞纤维化进程,对减轻心肌损伤有积极意义[14]。本研究结果显示,研究组治疗后LVEDV、LVESV 比对照组低,LVEF 比对照组高;研究组随访期间不良心血管事件发生率低于对照组;研究组治疗后的总有效率比对照组高。证实rhBNP 联合PCI 治疗AMI 合并心衰,能有效改善患者心功能,降低不良心血管事件发生率,临床疗效更好。分析原因:(1)rhBNP 可拮抗交感神经系统以及肾素-血管紧张素-醛固酮系统,可有效对抗过度激活神经内分泌引起的心脏毒性作用,利于PCI 治疗后心功能的恢复,进而有效降低不良心血管事件发生率,能取得较为满意的治疗效果[15]。(2)rhBNP 可通过抑制心肌纤维细胞过度表达,减少心肌细胞凋亡来阻止心室结构重塑,促进PCI 治疗后心功能恢复的同时利于降低不良心血管事件发生率,治疗效果更好。从安全性角度而言,本研究中研究组治疗期间不良反应发生率相比对照组无明显增加,证实增加使用rhBNP 不会增加药物不良反应,可保证治疗安全性。
综上所述,rhBNP 联合PCI 治疗AMI 合并心衰,能有效减轻患者机体炎症反应及心肌损伤程度,改善心功能,降低不良心血管事件发生率,且不会增加药物不良反应发生率,临床疗效更好。

