基于TCGA数据库探究SERPINA5在前列腺癌中的表达及临床意义
陶 润,李文永,关 翰,李 俊,邓 硕,张家俊
(蚌埠医科大学第一附属医院 泌尿外科,安徽 蚌埠 233004)
前列腺癌是一种常见的男性恶性肿瘤,2020年全球约有140万新发病例,37.5万死亡病例,是2020年全球男性第二大最常见癌症和第五大癌症死亡原因[1]。尽管相对于澳大利亚、北美,西欧等地区,亚洲地区的发病率偏低,但是我国前列腺癌发病率仍然呈现出增高的倾向[2]。虽然目前可以通过前列腺癌特异性抗原(PSA)检测、前列腺磁共振检查以及前列腺组织的病理活检进行早期诊断[3],但也会因此造成一些不必要的过度诊疗,导致对病人经济上以及医院资源的无谓消耗[4]。由于其早期发病时缺少显著的临床症状而易被忽视,很多病人发现时往往分期较晚,导致治疗疗效及预后不佳。目前国内最常见的治疗措施为手术治疗以及抗雄激素治疗,然而,大多数雄激素依赖性病人在治疗后易于复发,成为去势抵抗性前列腺癌,进一步增加了治疗难度[5]。晚期癌症的致命性往往是由于缺乏在基因和细胞生物学水平上产生持久反应的方案[6]。就目前而言,前列腺癌的诊断、治疗和预后还有很多不足之处。癌症基因组图谱(TCGA)和Oncomine数据库是两个大型的肿瘤信息数据公共平台,含有大量的基因数据和临床信息。本研究通过数据库筛选出在前列腺癌与癌旁组织中差异化表达的基因,以期为前列腺癌的预防与治疗带来新的方案以及研究方向。
1 资料与方法
1.1资料收集
通过TCGA数据库下载前列腺癌的mRNA表达数据。
1.2数据处理
通过R软件的“edgeR”包对数据进行筛选获取差异基因,筛选条件为|LogFC|>3,FDR<0.05,利用“gplots”包将筛选后的差异基因进行处理。
1.3通路与功能富集分析
通过DAVID 6.8数据库对差异基因进行GO和KEGG富集分析,并利用R软件的“ggplot2”包将其可视化处理。
1.4构建蛋白互作网络与筛选Hub基因
通过STRING 11.0数据库对差异基因进行蛋白互作网络分析(protein-protein interaction,PPI),并使用Cytoscape_v3.7.1软件对PPI网络进行可视化处理,利用其“cytoHubba”插件挑选出关联强度前10的Hub基因。
1.5筛选目标基因
将Hub基因与Oncomine数据库中的前列腺癌研究数据进一步筛选,筛选条件为:(1)分析类型,癌组织与癌旁组织;(2)癌症类型,前列腺癌;(3)数据类型,mRNA;(4)阈值,P<0.05。采用Mate分析得到目标基因。
1.6临床数据统计分析
通过R软件的“ggpubr”包以及“limma”包对TCGA下载的临床数据进行分析,并绘制可视化图表。
1.7关键基因的生存分析
使用在线工具GEPIA对所获得的目标基因进行预后生存分析。
2 结果
2.1差异基因的筛选结果
通过TCGA数据库总共获得了551个样本数据(其中癌旁组织样本52个,癌组织样本499个)。通过R软件对样本数据处理后,共筛选出463个差异基因,其中呈现上调的265个,下调的198个。
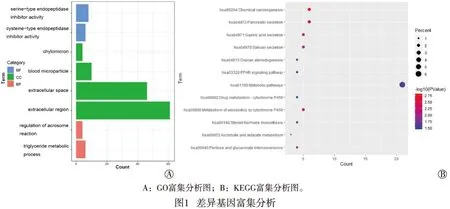
2.2GO与KEGG富集分析
通过DAVID 6.8数据库与R软件对差异基因进行GO富集分析后发现,这些基因在分子功能(molecular function,MF)层面中主要与丝氨酸型内肽酶抑制剂和半胱氨酸型内肽酶抑制剂活性相关。在细胞组分(cellular component,CC)层面中与乳糜微粒、血液微粒、细胞外间隙相关。在生物过程(biological process,BP)层面中主要参与顶体反应的调节、三酰甘油代谢过程(见图1A)。进行KEGG富集分析后发现,这些差异基因主要与PPAR信号通路、物质代谢通路、唾液分泌功能、胃酸分泌功能以及胰腺分泌功能等相关(见图1B)。
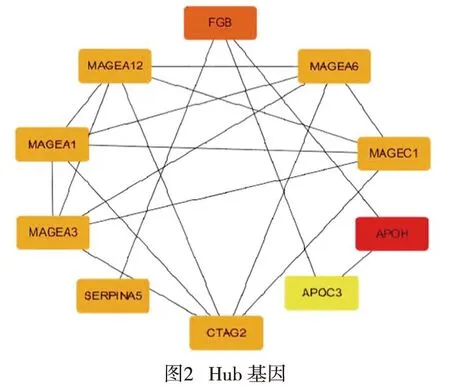
2.3构建PPI网络图与筛选Hub基因
通过STRING 11.0对差异基因进行分析,将基因间的相互关联系数设置为0.4,并且将孤立基因排除,得到PPI网络图。通过Cytoscape将PPI网络图进一步分析,并且使用其插件挑选出关联度前10的Hub基因,分别为APOH、FGB、CTAG2、MAGEA12、MAGEC1、MAGEA6、MAGEA3、MAGEA1、SERPINA5、APOC3(见图2)。
2.4联合Oncomine数据库筛选目标基因
使用Oncomine数据库搜寻目标基因相关的研究,发现自从2002年以来共有6项研究涉及SERPINA5在癌组织与癌旁组织中的差异化表达,通过Meta分析发现SERPINA5在前列腺癌中呈现低表达,且差异表达有统计学意义(P<0.05)(见图3)。

2.5分析SERPINA5与临床数据的相关性
通过TCGA数据库下载前列腺癌样本的临床数据,随后利用R软件对SERPINA5进行单因素分析。分析后发现前列腺癌病人的SERPINA5的表达水平在不同肿瘤分化程度以及TNM分期间差异有统计学意义,其中前列腺癌中分化组SERPINA5的表达水平高于低分化组(P<0.05)(见图4D),T1+T2组SERPINA5的表达水平高于T3+T4组(P<0.05)(见图4A),N0组SERPINA5的表达水平高于N1组(P<0.05)(见图4B),M0组SERPINA5的表达水平高于M1组(P<0.05)(见图4C),而在不同年龄、人种间差异均无统计学意义(P>0.05)(见图4E、4F)。
2.6生存分析
使用在线工具GEPIA对SERPINA5进行预后生存分析,发现前列腺癌病人SERPINA5的表达水平与总生存率(OS)无关(P>0.05),而与无病生存率(DFS)有关(P<0.05)(见图5)。其中SERPINA5的表达量越高,病人的预后情况越好。
3 讨论
TCGA是致力于对选定的肿瘤类型进行全面基因组和表观基因组分析的几个国际组织之一,利用庞大的基因数据库以促进研究人员对疾病总进程的理解,并为所有的癌症相关研究提供一个免费开放的资源获取平台[7]。本研究利用TCGA数据库筛选出在前列腺癌组织与癌旁组织中差异化表达的基因。对差异基因筛选后选择SERPINA5为目标基因进行临床相关性的研究以及预后分析。
丝氨酸蛋白酶抑制剂(SERPIN)是一种普遍存在于生物体内的蛋白酶抑制剂家族[8],目前人体内的SERPIN被细分A~I为 9个亚族,SERPINA5为其中的A亚族成员5。该基因是位于14号染色体q臂上的丝氨酸蛋白酶抑制剂基因簇中的一个,基因跨度约为13个碱基对,由5个外显子和4个内含子组成[9]。人血浆中的SERPINA5通过5′-侧翼区中的Sp1和AP2结合位点分别作为启动子和增强子在肝脏中起主要表达作用,除此之外还有部分表达于肾脏和生殖器官,包括睾丸、精囊和卵巢[10]。SERPINA5的主要特点是广泛的蛋白酶反应性和人体中广泛的组织分布。SERPINA5最初被描述为活化蛋白C的抑制剂,并独立作为纤溶酶原激活物尿激酶的抑制剂[8]。一项关于肝癌的研究[11]表明,肝细胞癌中SERPINA5基因的表达水平显著降低,并且SERPINA5的表达水平与HCC的恶性进展呈负相关关系。用q-PCR和免疫印迹法检测7种肝癌细胞系中SERPINA5的相对表达水平后发现,SERPINA5在Hep3B、HepG2和HUH-7细胞中表达水平相对较高,这些细胞没有转移潜能或转移潜能较低,而SERPINA5在具有高转移潜能的SNU-449、HCCLM3和MHCC-97H细胞中表达水平相对较低,靶向敲除SERPINA5后可以促进肝癌细胞迁移。因此推测SERPINA5基因可以降低肝癌细胞的体内外转移潜能,并且SERPINA5的表达量增高可以起到抑制肝癌细胞的作用,该项研究还发现SERPINA5抑制肝癌转移的机制之一就是通过与纤连蛋白的直接相互作用和纤连蛋白-整合素信号通路的破坏,这表明SERPINA5在肝癌中可能是一个抑癌基因。有趣的是,在另一项关于低级别神经胶质瘤的研究[12]中发现SERPINA5启动子的两个不同的CpG位点被高甲基化后,会引起SERPINA5的表达水平降低,从而使病人获得更好的预后,这表明SERPINA5在低级别神经胶质瘤中反而是一个促癌基因。SERPINA5除了在癌组织与癌旁组织中差异表达外,在某些癌症的不同分期中也有着显著的差异。据报道[13],在卵巢恶性肿瘤中,与早期肿瘤相比,晚期浆液性交界性肿瘤和浆液性癌的SERPINA5表达明显降低,且表达的缺失与浆液性交界性肿瘤中的微乳头状生长和微浸润以及浆液性癌的浸润表型有关。除此之外,还有部分研究[14-16]表明SERPINA5可能在雄性生殖、宿主防御中发挥作用。而在前列腺癌中,也有相关的研究[17]分析了SERPINA5在正常细胞(PrEC)、良性前列腺增生细胞(BPH-1)和恶性前列腺上皮细胞系(LNCaP、DU-145和PC-3)中8个CpG位点的甲基化程度,其中5个CpG位点的甲基化程度与SERPINA5表达水平的降低显著相关。并且在正常的前列腺上皮细胞、良性增生细胞和低侵袭性的LNCaP细胞中,有两个CpG位点(位于转录起始位点-19 bp和-14 bp)被高甲基化,而在侵袭性的DU-145和PC-3细胞系中,这些位点相较于正常组织基本未被甲基化。这表明SERPINA5启动子的两个不同CpG位点的新的甲基化模式可能有助于鉴别前列腺癌的良性和恶性。本研究中,对目标基因SERPINA5进行临床数据分析以及生存分析后发现,前列腺癌病人的SERPINA5的表达水平与肿瘤分化程度、TNM分期以及DFS的差异有统计学意义,而与年龄、人种以及OS的差异无统计学意义,并且SERPINA5的表达量越高,病人的预后情况越好,这表明SERPINA5在前列腺癌中是一种抑癌基因。然而关于SERPINA5对于前列腺癌进展中发挥作用的主要机制尚未明确,仍需要进一步的研究和探讨。

此外,我们在进行富集分析时发现这些差异基因主要富集在PPAR信号通路、物质代谢等通路上。PPAR是一种核转录因子,在人体多项代谢调节中发挥重要作用。到目前为止,根据目前的研究[18]表明PPAR家族总共分为三种亚型:PPAR-α、PPAR-β和PPAR-γ。其中PPAR-γ在前列腺癌的进展中起到了重要作用,部分研究[19]指出,PPAR-γ对于前列腺癌的进展起到了抑制作用,而雄激素受体(androgen receptor,AR)可以抑制前列腺癌细胞中PPAR-γ的表达水平从而促进前列腺癌的发病进程,因此,降低AR功能的方法可用于增加前列腺癌细胞中PPAR-γ的表达量和PPAR-γ激动剂的抗肿瘤作用。AR不仅可以通过与PPAR-γ的直接作用来影响前列腺癌的进程,还可以通过与SERPIN家族中的乳腺丝氨酸蛋白酶抑制剂(mammary serine protease inhibitor,MASPIN)的相互作用对此进行调节。据报道[20],AR可以通过与MASPIN启动子中的激素反应元件(hormonal responsive element,HRE)相结合,负向调节MASPIN的表达,从而促进前列腺癌的发展。由此我们可以猜想,同为SERPIN家族中的SERPINA5是否也会直接通过与AR的相结合,或者间接通过PPAR信号通路影响前列腺癌的进展,这还有待于进一步的研究。除了PPAR信号通路以外,物质代谢通路也对前列腺癌的进展起到了关键作用。相关研究[21]表明代谢途径紊乱会导致半胱氨酸升高,从而参与代谢中间体导致内皮细胞损伤或炎症并增加氧化应激。前列腺癌中继发氧化应激增加而产生的活性氧对肿瘤发展起到了促进作用[22]。

综上所述,本研究利用生物信息学的方法对前列腺癌相关基因数据进行整理,最终得到目标基因SERPINA5,并且分析了目标基因与前列腺癌的临床相关性及预后情况,为前列腺癌未来的生物靶向治疗提供了理论基础和研究方向。

