宰后贮藏期间滩羊肉线粒体氧化磷酸化与色泽稳定性的关系
王金霞,杨 波,罗瑞明,李 荣,陈雪妍,张 倩,胡丽筠
(宁夏大学食品科学与工程学院,宁夏 银川 750000)
滩羊是广泛分布于宁夏、甘肃、陕西等地的区域性优质家畜品种,其肉质细嫩、无膻味、营养丰富、脂肪分布均匀,备受消费者喜爱,具有重要的经济及食用价值。消费者往往通过肉表面的颜色来判断肉的健康与新鲜程度,长期以来,因肉色的褐变已造成巨大的经济损失,仅美国年均损失就高达数十亿美元[1],因此探究动物宰后贮藏期间影响肉色的因素提高肉色稳定性避免造成经济损失是当前的首要任务。
肉的色泽稳定性通常由肌红蛋白(myoglobin,M b)、血红蛋白和一些微量有色代谢物维持。在充分放血的肌肉中,Mb含量占总色素含量的75%左右[2],是影响宰后肉色泽稳定性的主要因素[3]。脱氧肌红蛋白(deoxymyoglobin,DeoMb)、氧合肌红蛋白(oxymyoglobin,OxyMb)以及高铁肌红蛋白(metmyoglobin,MetMb)是Mb主要存在的3 种形式,肉的色泽稳定性是由3 种Mb的含量以及存在比例所决定。
氧化磷酸化系统由线粒体内膜电子传递链(electron transport chain,ETC)和复合物V(ATP合酶)组成。氧化磷酸化是一个生物化学过程,是物质在线粒体内氧化释放的能量通过呼吸链供给ADP与无机磷酸合成ATP的偶联反应,即ETC和ATP形成的偶联机制称为氧化磷酸化。氧化磷酸化可产生ATP,还原型辅酶I(nicotinamide adenine dinucleotide,NADH)和黄素腺嘌呤二核苷酸递氢体(flavine adenine dinucleotide,FADH2)的还原物从复合物I(NADH-辅酶Q氧化还原酶)或II(琥珀酸-Q氧化还原酶)通过复合体III(Q-细胞色素c氧化还原酶)转移到细胞色素c,其中O2在反应中被还原为水,而被氧化的自由能均在复合物I、III和IV(细胞色素c氧化酶)中释放,作为电化学势通过质子从基质转移到膜间空间,电化学势的能量被ATP合酶利用驱动催化反应ADP+磷酸→ATP以满足细胞行使功能所需能量[4],同时氧化磷酸化参与调节各种关键细胞活动,例如ROS的产生和封存[5]、钙稳态、细胞凋亡以及细胞衰老等[6]。
近年来国内外学者在肉品贮藏加工过程中对影响肉色及其稳定性的内外部因素稳定性方面做了大量研究。张玉斌等[7]研究表明,作为线粒体内三羧酸循环中间代谢物,乳酸盐的氧化过程是导致MetMb还原的原因,线粒体的还原能力可以影响氧消耗、MetMb还原以及Mb氧化还原状态,进而影响牛肉色泽的稳定性。Tang Jiali等[8]选用在三羧酸循环过程中不会产生NADH的琥珀酸盐作为反应底物,经过实验发现线粒体调节的MetMb还原是在低氧压或电子在电子传递链上积累的条件下,通过细胞色素将可用电子传递给MetMb实现。Mancini等[9]研究表明,相较于OxyMb,DeoMb性质不稳定,更易被氧化成OxyMb和MetMb。刘维[10]以蛋白质组学为基础,对贮藏期间牛肉的变色机理进行了初步探讨,其研究结果表明,在贮藏期间,参与线粒体能量代谢的多种相关酶类与线粒体的活性及其MetMb的还原力有直接关系,其变化会直接影响肉色。以上研究结果表明线粒体内相关酶活性的变化对肉色及其稳定性有显著影响,但鲜见从宰后成熟期间氧化磷酸化变化的角度解析滩羊肉的色泽稳定性变化机制的报道。
本实验以滩羊背最长肌为研究对象,通过测定其在4 ℃贮藏8 d过程中氧化磷酸化变化对色泽稳定性的影响,并对其进行相关性分析,以此阐明滩羊肉贮藏期间氧化磷酸化与色泽稳定性的关系,为后续揭示氧化磷酸化调控色泽稳定性的机制奠定基础。
1 材料与方法
1.1 材料与试剂
所用滩羊背最长肌来自宁夏盐池县大夏牧场食品有限公司,选取胴体质量相近的6 月龄公滩羊12 只,宰前遵循《宁夏回族自治区家禽屠宰管理条例》,屠宰后立即用灭菌刀取下右侧背最长肌,剔除可见脂肪与结缔组织后,置于聚乙稀薄膜内,用锡纸包装后置于带有编号的保鲜袋中,贮存在4 ℃条件下,在成熟0、1、2、3、4、6、8 d时分别检测相应指标。
磷酸盐缓冲液 上海麦克林生化科技有限公司;生理盐水(0.8%)、Tris-HCl(1 mol/L,pH 7.0)、蔗糖(分析纯)国药集团化学试剂有限公司;活性氧(reactive oxygen species,ROS)探针 上海懋康生物科技有限公司;线粒体电子传递链复合物I、II、III、IV、V活性检测试剂盒、核苷酸检测试剂盒、过氧化氢酶(catalase,CAT)试剂盒、超氧化物歧化酶(super oxide dismutase,SOD)试剂盒、NADH检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒、詹纳斯绿B染色液(0.2%)北京索莱宝科技有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、线粒体膜电位检测试剂盒(J C-1)上海碧云天生物科技有限公司;羊高铁肌红蛋白还原酶(metmyoglobin reductase,MetMbase)检测试剂盒北京清析技术研究院。
1.2 仪器与设备
Minolta CM-600d色差仪 日本柯尼卡美能达传感股份有限公司;UV-1200紫外分光光度计 上海美谱达仪器有限公司;JXFSTPRP-CL全自动样品冷冻研磨仪上海净信有限公司;352型酶标仪 芬兰Labsystems Multiskan MS公司;TGL-24M高速冷冻离心机 长沙平凡仪器仪表有限公司;NanoElute超高效液相色谱仪 德国Bruker公司;EnSpire荧光酶标仪 美国PerkinElmer公司。
1.3 方法
1.3.1 样品采集
采集0、1、2、3、4、6、8 d的样品各50 g,用于测定色泽指标L*、a*、b*值及各Mb衍生态相对含量;采集不同成熟期间的样品各20 g,迅速置于液氮中放置2 h后转移至-80 ℃冰箱中保存,用于其他指标测定。
1.3.2 肉色指标的测定
使用色差仪测定不同贮藏期间样品的L*、a*、b*值,测量前用白盘校准仪器,每个样本分别在3 个不同位置测定,结果取其平均值。并在测定时读取样品在630 nm及580 nm处的反射率,计算630 nm与580 nm的比值,记为R630/R580。
1.3.3 3 种Mb相对含量的测定
参考邬威[11]的方法,并略作修改。称取不同贮藏时间的样本各5 g,加入25 mL磷酸盐缓冲液后置于冷冻匀浆机中4 ℃匀浆180 s。将匀浆后的混合液置于4 ℃冰箱中保存1 h后取出置于离心机中4 ℃、4 500×g离心30 min,弃沉淀并加入磷酸盐缓冲液补充上清液至25 mL,分别在503、525、557、582 nm处测定其吸光度,DeoMb、OxyMb及MetMb相对含量的计算公式如下:
1.3.4 MetMbase活性的测定
实验操作按照羊MetMbase检测试剂盒的要求进行,使用酶标仪在450 nm波长下测定吸光度。
1.3.5 线粒体氧化磷酸化各项指标测定
1.3.5.1 线粒体膜通透性与线粒体膜电位的测定
线粒体的提取参照Sun Lijuan等[12]方法。参考Halestrap[13]的方法测定线粒体膜通透性,测定线粒体悬浮液在520 nm波长下的吸光度(A520nm),依据A520nm的变化判定线粒体膜通透性的改变。如果溶液吸光度降低,表明线粒体膜通透性增加,反之则表明线粒体膜通透性降低。
实验操作按照线JC-1检测试剂盒的要求进行,采用荧光酶标仪分别测定荧光强度。JC-1单体产生绿色荧光,激发波长设置为490 nm,发射波长设置为530 nm;JC-1聚合物产生红色荧光,激发波长设置为525 nm,发射波长设置为590 nm,线粒体膜电位按下式计算:
1.3.5.2 核苷酸含量的测定
按照核苷酸含量检测试剂盒的要求进行。
1.3.5.3 线粒体电子传递链复合物I、II、III、IV、V活性测定
实验操作按照线粒体复合物检测试剂盒的要求进行,使用酶标仪进行测定。
1.3.5.4 内源抗氧化酶活力的测定
实验操作按照CAT、SOD、GSH-Px检测试剂盒的要求进行,使用紫外分光光度计或酶标仪测定。
1.3.5.5 ROS水平测定
参考张玉林[14]的方法,并略作修改。取已经剔除脂肪与结缔组织的肉样0.1 g,置于Tris-HCl缓冲液(10 mmol/L Tris-HCl、0.8 g/100 mL NaCl、0.1 mmol/L EDTA-2Na、10 mmol/L蔗糖,pH 7.4)中混合,在4 ℃、60 Hz条件下匀浆30 s,3 000×g冷冻离心15 min,收集上清液,采用双缩脲法测定上清液的蛋白质量浓度。ROS相对含量的测定方法如下:取100 μL的上清液与100 μL反应缓冲液(10 mmol/L Tris-HCl、0.8 g/100 mL NaCl、0.1 mmol/L EDTA-2Na、10 mmol/L蔗糖,10 μmol/L DCFH-DA,pH 7.4)在酶标板内迅速混合,采用荧光酶标仪于激发波长480 nm、发射波长525 nm处立即测定孵育前的荧光强度,再置于37 ℃培养箱内孵育30 min后再次测定孵育后荧光强度,ROS水平按下式计算:
1.3.5.6 NADH含量的测定
实验操作按照NADH检测试剂盒的要求进行,使用酶标仪在570 nm波长下测定吸光度。
1.4 数据处理
2 结果与分析
2.1 贮藏期间色泽指标的变化
色泽是评价肉品质最直观的指标之一,决定了肉品的经济价值与食用价值。如表1所示,L*、a*、b*值在0~8 d均呈先升高后降低趋势(P<0.05),L*值在3 d时达到最大值,而a*、b*值在2 d时达到最大值。如图1所示,宰后0~8 d,R630/R580呈先升高后下降趋势(P<0.05)。
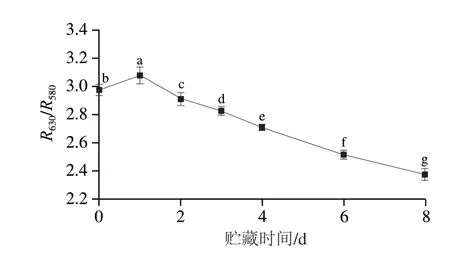
图1 贮藏期间R630/R580的变化Fig.1 Changes of R630/R580 during storage

表1 滩羊宰后贮藏期间肉色的变化Table 1 Changes in colour parameters during storage
2.2 贮藏期间3 种Mb相对含量的变化
MetMb、OxyMb、DeoMb是Mb的3 种衍生态。肉色主要由这3 种Mb相对含量[15]。如图2所示,贮藏期间滩羊背最长肌中的MetMb相对含量呈显著下降后上升趋势(P<0.05),OxyMb 相对含量先上升后下降(P<0.05),而DeoMb相对含量变化整体呈下降趋势(P<0.05),结果表明MetMb和OxyMb是贮藏期间Mb的主要存在形式。

图2 贮藏期间3 种Mb相对含量的变化Fig.2 Changes in relative contents of MetMb,OxyMb and DeoMb during storage
2.3 贮藏期间MetMbase活力的变化
MetMbase是MetMb还原系统的关键酶类,可以通过NAD+的作用将MetMb还原成OxyMb,从而提升肉色稳定性[16]。滩羊宰后贮藏期间背最长肌的MetMbase活性变化如图3所示,贮藏0~8 d内,MetMbase活性呈显著下降趋势(P<0.05),本研究结果可与2.2节中MetMb相对含量显著上升结果相互印证。
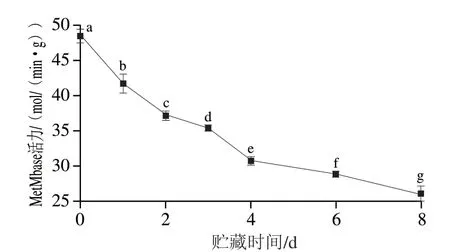
图3 贮藏期间MetMbase活性的变化Fig.3 Changes in MetMbase activity during storage
2.4 贮藏期间线粒体膜通透性和膜电位变化
由图4A可知,随着贮藏时间的延长线粒体膜通透性显著上升(P<0.05);如图4B所示,线粒体膜电位在贮藏0~8 d显著下降(P<0.05)。以上结果表明滩羊宰后贮藏期间线粒体的完整性遭到破坏。
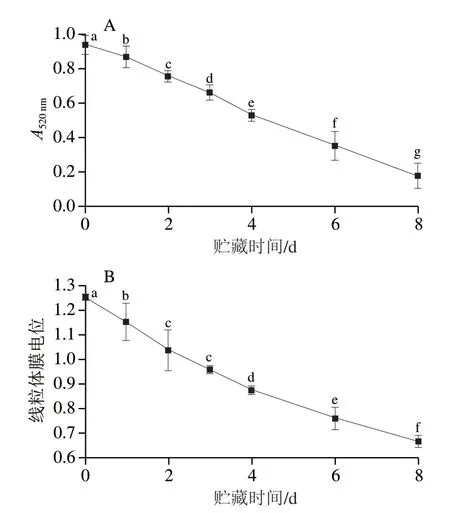
图4 贮藏期间线粒体膜通透性(A)和膜电位(B)变化Fig.4 Changes in mitochondrial membrane permeability (A) and membrane potential (B) during storage
2.5 贮藏期间核苷酸含量变化
由图5可知,ATP、ADP、AMP含量随着贮藏时间的延长均显著下降(P<0.05)。这可能是因为滩羊宰后贮藏期间为保证细胞各项生命活动正常进行,ATP被快速消耗,虽然ATP、ADP和AMP时刻不停地发生相互转化,但这仅能缓解短期内的能量缺乏[17],因此,ATP、ADP、AMP水平在宰后贮藏期间呈持续降低趋势。
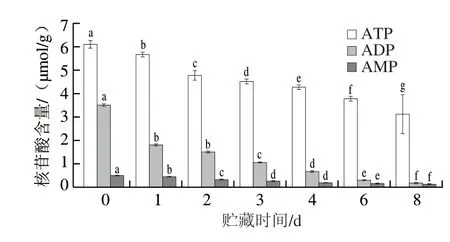
图5 贮藏期间核苷酸含量变化Fig.5 Changes in nucleotide content during storage
2.6 贮藏期间线粒体复合物I、II、III、IV、V活性变化
由图6可知,随着贮藏时间的延长,线粒体复合物I、II、III、IV活性呈下降趋势(P<0.05);线粒体复合物V呈显著上升趋势(P<0.05)。这可能是因为随着贮藏时间的延长,线粒体电子传递链各个复合物内部的亚基发生了变化,这些变化可能会影响复合物的组装,进而导致各个复合物活性受到不同程度的影响[18]。
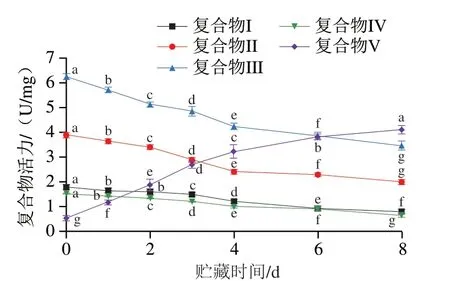
图6 贮藏期间线粒体复合物I、II、III、IV、V活性Fig.6 Activities of mitochondrial complex I,II,III,IV and V during storage
2.7 贮藏期间内源抗氧化酶活性的变化
由图7A可知,贮藏0~6 d期间CAT活性显著下降(P<0.05);贮藏6~8 d其活性上升(P<0.05);如图7B、C所示,贮藏期间SOD、GSH-Px活性呈显著下降趋势(P<0.05)。
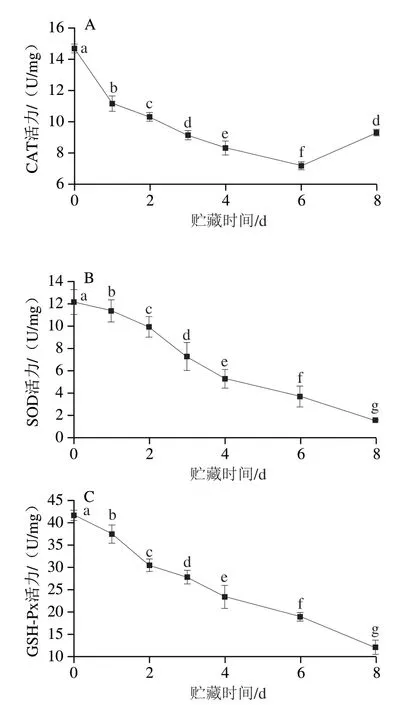
图7 贮藏期间内源抗氧化酶活性的变化Fig.7 Changes in endogenous antioxidant activity during storage
2.8 贮藏期间线粒体ROS水平的变化
由图8可知,贮藏0~1 d滩羊背最长肌的ROS水平变化不显著(P>0.05),这可能是因为ROS产生初期被体内的抗氧化系统所清除;1 d后滩羊背最长肌的ROS水平显著上升(P<0.05),这是因为内源抗氧化酶的活力随贮藏时间的延长而降低,导致ROS含量逐渐积累增加[19]。

图8 贮藏期间ROS水平变化Fig.8 Changes in ROS levels during storage
2.9 贮藏期间NADH含量的变化
NADH是MetMb还原酶系统中最关键的辅酶,MRA活性受NADH浓度变化影响较为显著。如图9所示,随着贮藏时间的延长,滩羊背最长肌中的NADH含量显著下降(P<0.05)。
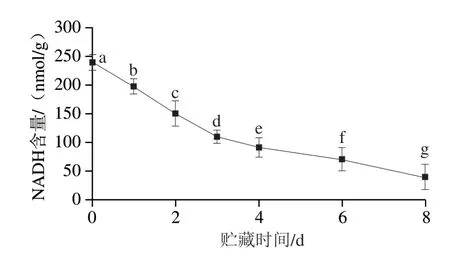
图9 贮藏期间NADH含量的变化Fig.9 Changes in NADH content during storage
2.10 氧化磷酸化与色泽稳定性的相关性分析
如图10所示,线粒体膜通透性、线粒体膜电位与复合物I、II、III、IV显著正相关(P<0.001),与复合物V显著负相关(P<0.05),这说明在宰后贮藏期间线粒体的完整性会显著影响复合物活性。DeoMb、OxyMb与复合物I、II、III、IV显著正相关(P<0.05、P<0.01),与复合物V显著负相关(P<0.01);MetMb与复合物I、II、III、IV显著负相关(P<0.01),与复合物V显著正相关(P<0.05、P<0.001)。肌细胞线粒体可以通过复合物III和IV之间电子传输介导的还原、电子流的逆转以及存在于外膜内的MetMbase增强Mb的还原,进而对色泽稳定性产生影响。ATP与DeoMb、OxyMb显著正相关(P<0.05、P<0.001),与MetMb显著负相关(P<0.001),这可能是因为ATP会抑制ETC的传递从而降低线粒体还原MetMb的能力,进而对3 种Mb相对含量造成影响[20]。内源抗氧化酶体系与DeoMb和OxyMb呈正相关,与MetMb呈负相关,这说明自由基清除能力的减弱,会使过氧化物攻击线粒体造成MetMb的累积和线粒体的损伤。ROS与DeoMb、OxyMb显著负相关(P<0.01),与MetMb显著正相关(P<0.001),这是因为ROS降低了线粒体抗氧化功能,造成线粒体损伤,致使MetMb不断积累[21]。
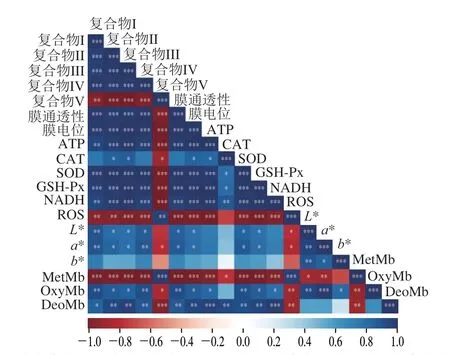
图10 贮藏期间氧化磷酸化与色泽稳定性的相关性分析Fig.10 Analysis of correlation between oxidative phosphorylation and color stability during storage
3 讨论
随着贮藏时间的延长,滩羊背最长肌L*值先上升后下降趋势,这可能因为贮藏期间肌肉pH值的变化显著影响机体内代谢酶的活性,当pH值降至蛋白质等电点时,蛋白质发生变性导致肌原纤维结构发生改变,当游离水渗出到肌肉表面时会增强光的反射率,从而使得肌肉L*值升高,此过程还调控肌肉中的a*、b*值[22]。随着贮藏时间的延长,a*值呈先上升后下降的趋势(P<0.05),这可能是因为Mb与空气中的O2长时间的接触产生了较多的OxyMb,致使a*值呈升高趋势[23]。但由于氧环境的存在,肌肉中时刻发生OxyMb与MetMb的不可逆转换并积累,最终导致a*值开始不断降低。b*值表示肉样的黄度值,贮藏期间b*值呈先上升后下降趋势,这可能是因为OxyMb被不可逆的氧化为MetMb所导致。R630/R580通常与a*值呈正相关,可间接反映出新鲜肉类中MetMb的含量,其比值越大,MetMb在肌肉中的含量越小。宰后0~8 d,R630/R580呈先升高后下降趋势(P<0.05),这则是因为刚被屠宰的滩羊肉中MetMb并不是Mb的主要存在形式,贮藏0~1 d由于MRA不断还原MetMb使得R630/R580呈升高趋势,随着贮藏时间的延长,由于OxyMb被不可逆的氧化为MetMb导致R630/R580呈下降趋势,此结果可与2.2节的结果相互印证。
DeoMb、OxyMb与MetMb在鲜肉中的含量和比例直接影响肉的颜色[24]。刚被屠宰的肌肉中,Mb为还原态的紫红色的DeoMb,由于贮藏期间环境中的氧气充足,Mb被转换成了鲜红色的OxyMb,随着贮藏时间的延长,Mb被进一步氧化成了褐色的MetMb,为抑制肉色劣变,动物组织中存在的天然还原系统可将MetMb进一步还原成DeoMb。随着贮藏时间的延长,滩羊背最长肌中的MetMb相对含量呈显著下降后上升趋势(P<0.05),OxyMb相对含量显著上升后下降(P<0.05),而DeoMb相对含量随着MetMbase系统的破坏整体呈下降趋势(P<0.05)。本实验研究结果与张萌[25]的研究结果并不相同,这可能是因为物种不同所导致的差异。
MetMbase可维持Mb血红素辅基中铁离子的还原状态,以保持理想的OxyMb水平,维持肉色稳定性[26],宰后贮藏初期MetMbase活力相对较高,可迅速将被氧化的OxyMb还原,致使MetMb的积累速率相对较低。贮藏期间MetMbase活力显著下降,可能是因为随着贮藏时间的延长线粒体完整性遭到破坏[15]以及脂肪氧化产生自由基导致Mb卟啉环上Fe3+的外层电子发生了能量跃变[27]。
肌细胞中线粒体是储存和供应能量的重要细胞器,线粒体内膜构型变化、线粒体内膜的结合和重组以及各种代谢物通过线粒体内膜的传送等反应都与线粒体氧化磷酸化作用有着密切的关系[28]。Mancini等[29]认为线粒体功能结构以及线粒体完整性的改变会对肉色稳定性造成影响。通常以线粒体膜通透性、线粒体膜电位变化作为线粒体膜损伤的标志[30]。本研究中,线粒体膜通透性与线粒体膜电位随着贮藏时间的延长均显著下降,原因可能是随着贮藏时间的延长,氧自由基的产生导致线粒体结构功能及完整性受到破坏[31]。这与师希雄等[32]对冰温贮藏过程中甘南藏羊后腿线粒体膜电位及线粒体膜通透性变化规律的研究结果类似。
线粒体的核心功能是泵送质子穿过内膜以产生具有高势能的梯度(即线粒体膜电位)的能力,这种势能随后被用于驱动多亚基单位ATP合酶复合物合成ATP[33]。宰后成贮藏期间,滩羊肌细胞线粒体ATP、ADP、AMP含量整体呈显著下降趋势,一方面这可能是因为宰后呼吸中断引起的糖酵解反应快速消耗ATP;另一方面则可能是因为宰后供氧方式的改变导致线粒体中氧化还原电位下降,氧化磷酸化功能受到障碍,不能正常合成ATP,导致了肌细胞内ATP的生成量迅速降低。而滩羊宰后肌肉组织中不断发生ATP→ADP→AMP不可逆的降解[34],因此随着ATP含量的降低,致使ADP、AMP的含量也逐渐降低。
Griffith[35]认为线粒体膜结构功能的损伤会对线粒体膜中氧化磷酸化生化反应功能造成衰退。氧化磷酸化系统包括复合物I、复合物II、复合物III、复合物IV、复合物V等[36]。复合物I负责催化NADH脱氢生成NAD+[37]。复合物II主要负责将琥珀酸催化生成延胡索酸,并将产生的电子最终传递给泛醌[38]。复合物III主要负责将电子从辅酶Q的传递给细胞色素c。复合物IV是ETC的终端电子受体,主要通过将电子从细胞色素c转移到O2,将O2转化为水[39]。复合物V是氧化磷酸化途径中的终点酶,当电子通过ETC移动时,质子被抽出线粒体内膜,返回线粒体基质参与复合物V催化的ATP合成反应中[26]。
ROS是具有活性化学性质的信号分子,能降低线粒体抗氧化能力,造成线粒体损伤[21]。当机体受损或处于缺血缺氧状态会产生过量的ROS,线粒体产生ROS的速率受线粒体内膜跨膜电位的调节。随着贮藏时间的延长,内源抗氧化酶逐渐失活,不能够及时清除机体内过量的ROS,导致ROS含量逐渐积累增加,从而导致氧化应激,最终引起细胞凋亡的发生[40],使线粒体完整性遭到破坏。
机体内的内源性抗氧化酶系统能够清除氧化应激产生的ROS[41]。SOD是抗氧化系统中最重要的酶,主要负责催化超氧阴离子歧化成H2O2[43],CAT进一步将H2O2催化分解为水和氧气。马森[43]认为GSH-Px能够促进GSH参与过氧化,代谢细胞呼吸过程中的过氧化物和羟自由基,从而保护线粒体完整性不受到破坏。本研究发现CAT活性在贮藏0~6 d显著下降,但在6 d后却显著上升,这可能是因为同期SOD活力的持续下降,导致机体产生应激反应,致使CAT活力开始升高。
MetMbase是NADH依赖型还原酶,因此NADH含量是Mb还原系统的主要影响因素之一[16]。贮藏期间NADH含量呈显著降低趋势,这可能是由于随着贮藏时间的延长,线粒体呼吸功能受到影响,导致氧化磷酸化进程受到阻碍,从而引起NADH含量显著下降。
比较不同贮藏期间氧化磷酸化各指标与肉色之间的关系可以看出,线粒体结构及功能的变化与肉色之间有显著相关性。在特定的肌肉中,Mb浓度与复合物IV活性相关[44]。崔树娜等[45]向复合体III抑制剂预处理的线粒体中加入琥珀酸和NAD,增加了NADH浓度,增强了MetMb的还原,即线粒体可以通过复合物III和IV之间电子传输介导的还原、电子流的逆转以及存在于外膜内的MetMbase增强Mb的还原,进而对色泽稳定性产生影响。此外,线粒体接触肉中本身的氧化剂,如脂质过氧化产物丙二醛[46]和无机铁离子[47]也会损害Mb和色泽稳定性。宰后贮藏期间,ROS会攻击Mb卟啉环上铁离子外层电子的跃变,从而破坏MetMbase,使血红素Fe2+被氧化为Fe3+产生褐色[48]。
综上所述,宰后贮藏期间滩羊肉中抗氧化体系的失效导致ROS含量的积累等因素最终引起线粒体膜通透性随贮藏时间的延长而增大,线粒体膜电位随贮藏时间的延长而减小,即线粒体完整性遭到破坏,导致位于线粒体内膜的氧化磷酸化相关酶活性随贮藏时间延长而发生改变,影响肌肉中MetMbase系统的活性,致使MetMbase活力不断降低,造成了MetMb的累积,进而对肉品的L*、a*、b*值产生影响,最终引起滩羊肉色发生劣变。
4 结论
滩羊肉4 ℃贮藏期间,随贮藏时间的延长,L*、a*、b*值均呈先上升后下降趋势;R630/R580先升高后显著下降;MetMb相对含量呈先下降后上升趋势,OxyMb相对含量先上升后下降;DeoMb相对含量变化整体呈下降趋势;线粒体膜通透性、膜电位持续下降;线粒体电子传递链复合物I、II、III、IV活性显著下降,复合物V活性显著升高;ROS水平显著上升;内源抗氧化酶体系整体呈下降趋势;核苷酸含量显著下降;Mb衍生态相对含量、肉色指标与线粒体膜通透性、线粒体膜电位、复合物(I、II、III、IV、V)活性以及ATP、SOD、GSH-Px、CAT活性和ROS呈显著相关性。以上结果表明,宰后贮藏期间滩羊肉中内源抗氧化酶系的失效导致肌细胞内产生过多的ROS,致使线粒体完整性受到破坏,对线粒体氧化磷酸化相关酶活性产生影响,进而影响肌细胞中MetMbase系统的活力,致使MetMb无法被还原,最终导致滩羊肉色泽稳定性变差。

