不同干燥方式对仿刺参性腺脂质、营养价值及挥发性物质的影响
王天雪,刘 淇,赵 玲,孙慧慧,高 昕,曹 荣,3,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.中国水产科学研究院黄海水产研究所,山东 青岛 266071;3.青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室,山东 青岛 266235)
仿刺参(Apostichopus japonicas)属于棘皮动物门(Echinodermata)、海参纲(Holothuroidea)、仿刺参属(Apostichopus),2022年我国养殖产量超24万 t[1],是渔业经济的重要组成部分。研究表明,海参体壁脂质成分如脑苷脂[2]、磷脂(phospholipid,PL)[3],具有调节脂质代谢[4]、降血糖[5]、改善神经退行性疾病[6]等功效,而海参性腺的脂质含量较体壁更为丰富[7]。海参性腺俗称“海参花”,是海参加工过程中的副产物,目前对其加工利用研究主要集中在蛋白的酶解和风味改良方面[8],对脂质的研究较少。
干燥是一种常见的水产品加工方式,不仅有效降低水分含量、防止腐败变质,还能改善食品风味、提高感官品质。目前广泛应用的干燥方式包括热风干燥、微波干燥、冷风干燥、真空冷冻干燥以及各类联合干燥技术。其中热风干燥操作简单、适应性强,仍是最常用的干燥方法[9],但其易使部分营养物质损失;微波干燥具有加热速度快、高效节能等优点,但可能因加热不均导致样品局部过热[10];冷风干燥的干燥温度较低,然而较长的干燥时间可能导致加工成本的增加和脂质氧化的加深[11];真空冷冻干燥能够较完整保留物质的营养成分,但成本较高,通常用于鲍鱼、海参等高值水产品的加工[12]。
近年来研究报道了干燥过程中鱼、虾、贝等水产品的脂质和挥发性物质变化。例如,Shah等[11]研究表明,鲱鱼在冷风干燥期间脂质氧化分解释放游离脂肪酸(free fatty acids,FFA),其中二十二碳六烯酸(docosahexaenoic acid,DHA)(C22:6n-3)对口感和气味的改善起重要作用;Li Deyang等[13]研究发现,相比于真空冷冻干燥,南美白对虾经热风干燥后脂质氧化程度更深;Gang Kaiqi等[14]发现,热风干燥导致海螺的PL、甘油三酯(triacylglycerol,TAG)含量降低,营养价值略有下降。Zheng Xiaoshan等[15]研究表明,PL能促进虾干加工过程中吡嗪类、醛类及芳香族化合物的生成,对虾干整体风味的形成具有积极作用。由此,干燥处理易导致脂质水解和氧化,影响水产品的营养价值。脂质是挥发性物质形成的重要前体物质,脂质的水解和氧化对水产品的风味特征也具有一定的影响。目前,鲜有研究报道仿刺参性腺在干燥过程中的脂质及挥发性物质的变化。因此,本研究以仿刺参性腺为原料,探究其经不同干燥方式(热风、冷风、微波、真空冷冻干燥)处理后脂质组成、营养价值及挥发性物质的变化,以期为仿刺参性腺加工过程中的品质控制和工艺优化提供参考。
1 材料与方法
1.1 材料与试剂
仿刺参性腺雌雄混合样品购自青岛海滨食品有限公司,均为养殖3~4 a的性成熟样品,系2022年春季采捕底播仿刺参时收集,在加工现场挑拣后于-20 ℃贮存。冷链运抵至实验室立即于-50 ℃贮存。实验使用同批次仿刺参性腺样品,水分质量分数为(92.53±0.03)%。
37 种脂肪酸混合标准品、内标十九烷酸甲酯 美国Sigma公司;氯仿、甲醇、氯化钠、乙腈、正己烷、正庚烷、95%乙醇、氢氧化钠、硫氰酸钾、硫酸联氨、异丙醇、TritonX 100(分析纯)上海国药集团化学试剂有限公司;TAG试剂盒 中生北控生物科技股份有限公司。
1.2 仪器与设备
M1-211A微波炉 美的集团股份有限公司;N-1001型旋转蒸发仪 美国EYELA公司;UV-2802型紫外-可见分光光度计 尤尼柯仪器有限公司;7890A气相色谱-质谱仪 美国Agilent科技公司;Pen-3型电子鼻 德国Airsense公司;GFL-125电热鼓风干燥箱 天津莱玻特瑞仪器设备有限公司;SNA9-对开门冷风干燥烘箱江苏宇通干燥工程有限公司;ALPHA 1-2 LD plus冷冻干燥机 德国Christ公司;FlavourSpec®型气相色谱-离子迁移谱(gas chromatography-ion mobility spectrometry,GC-IMS)仪 德国G.A.S公司。
1.3 方法
1.3.1 样品处理
将样品流水解冻、沥干水分后,均匀分成5 组,其中一组作为对照组(鲜样),另外4 组均匀平铺于玻璃培养皿中,分别采用以下方式进行干燥处理,直至水分质量分数为(15.0±0.5)%,再将干燥后样品研磨成粉,于-50 ℃贮藏备用
真空冷冻干燥:-50 ℃预冻,冷阱温度-60 ℃,真空度0.098 MPa,干燥时间72 h;热风干燥:温度设定90 ℃,干燥时间6 h,每隔1 h翻面;冷风干燥:温度设定20 ℃,干燥时间72 h,每隔6 h翻面;微波干燥:功率700 W,干燥时间15 min,每隔5 min翻面。
1.3.2 总脂测定
参照Folch等[16]的方法,略有改动。称取80 g样品,加入300 mL氯仿-甲醇混合液(2∶1,V/V),静置过夜。加入60 mL生理盐水,混匀后静置至分层。以无水硫酸钠过滤氯仿层,收集滤液45 ℃旋蒸,氮气吹干后,得到总脂样品。收集后于-50 ℃贮藏,1 周内完成后续测定,总脂含量以样品干质量计。
1.3.3 脂质组成测定
PL:称取0.1~0.2 g总脂样品,加20 mL消化液(浓硝酸∶高氯酸=4∶1,V/V)进行湿法消化,至消化液无色。将消化液定容至50 mL,采用钼蓝比色法测定PL含量[17]。
TAG:取100 μL 总脂样品,以稀释液(异丙醇∶TritonX 100=9∶1,mL/g)稀释至适当浓度,参照试剂盒说明书进行TAG含量测定。
FFA:称取0.1 g总脂样品,加入5 mL甲苯、1 mL铜试剂(吡啶调节pH值至6.1),振荡2 min,3 000 r/min离心5 min,取上清液测定715 nm处OD值[18]。
1.3.4 虾青素含量测定
参考孙来娣等[19]的方法,略有改动。准确称取0.200 0 g总脂样品于50 mL离心管中,准确加入15 mL乙腈涡旋混合。将样品倒入分液漏斗,加入15 mL正己烷,静置分层,弃正己烷层,重复2~3 次将提取液转移至50 mL容量瓶中,用乙腈定容至刻度,混匀。以乙腈作空白,在474 nm处测定OD值。单位为mg/kg,以总脂质量计。
1.3.5 脂肪酸组成分析
脂肪酸甲酯化:向脂肪提取物中加入2 mL 2% NaOH-甲醇溶液,85 ℃水浴30 min;加入3 mL 14%三氟化硼-甲醇溶液,85 ℃水浴30 min。冷却至室温后加入1 mL正己烷,振荡萃取2 min,静置分层。取上层清液100 μL,正己烷定容至1 mL。过0.45 μm滤膜后上机测试。
条件:TG-FAME色谱柱(50 m×0.25 mm,0.20 μm);升温程序:80 ℃保持1 min,以20 ℃/min的速率升温至160 ℃,保持1.5 min,再以3 ℃/min的速率升温至250 ℃,保持3 min;进样口温度:270 ℃,载气:He,流速:0.63 mL/min;分流进样,分流比100∶1;检测器:氢火焰离子化检测器;检测温度:280 ℃。
1.3.6 脂质营养质量评价指数
采用脂质营养质量指数评价脂肪酸营养价值[20],具体包括动脉粥样硬化指数(atherogenic indices,AI)、血栓形成指数(thrombogenic indices,TI)、低胆固醇脂肪酸/高胆固醇脂肪酸指数(the hypocholesterolemic/hypercholesterolemic index,H/H),计算如下:
式中:C12:0、C14:0、C16:0、C18:0、C18:1n-9、C18:2n-6、C20:4n-6、C18:3n-3、C20:5n-3、C22:5n-3、C22:6n-3分别表示相应脂肪酸的相对含量/%;c1表示单不饱和脂肪酸(monounsaturated fatty acid,MUFA)相对含量/%;c2表示n-6多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)相对含量/%;c3表示n-3 PUFA相对含量/%。
1.3.7 脂质氧化程度测定
酸价(acid value,AV)参照GB 5009.229—2016《食品中酸价的测定》测定[21]。
过氧化值(peroxidevalue,POV)参照GB 5009.227—2016《食品中过氧化值的测定》测定[22]。
硫代巴比妥酸(thiobarbituric acid reactive substances,TBARS)值参照GB 5009.181—2016《食品中丙二醛的测定》测定[23]。
1.3.8 电子鼻分析
取0.5 g样品于20 mL顶空瓶中,静置10 min进行电子鼻检测。参数设定:清洗时间150 s,气体流速200 mL/min,数据采集时间为200 s。采用电子鼻内置程序WinMuster对数据进行处理。
1.3.9 GC-IMS分析
准确称取0.5 g样品于顶空进样瓶,50 ℃平衡20 min后,通过自动顶空进样,用GC-IMS仪进行检测。通过NIST数据库与IMS迁移时间数据库比对,进行物质定性分析,并绘制挥发性成分指纹图谱。
1.4 数据分析
2 结果与分析
2.1 不同干燥方式下仿刺参性腺总脂及脂质组成变化
由图1a所示,新鲜仿刺参性腺总脂质量分数达14.70%,这与朱瑶等[24]的研究结果存在差异,这可能与样品是否处于性成熟期有关。与鲜样相比,真空冷冻干燥样品总脂无显著变化(P>0.05),热风、冷风和微波干燥样品总脂显著下降(P<0.05),其中热风干燥总脂降低最显著,这可能由于其较高的干燥温度和较长的干燥时间导致脂质热降解较冷风、微波干燥更剧烈,这与Wu Tao等[9]的研究结果一致。
仿刺参性腺的脂质主要由PL、TAG和FFA组成,由图1b可知,鲜样中的PL、TAG在不同干燥处理后均出现不同程度下降。经真空冷冻干燥后鲜样的PL、TAG、FFA均无显著变化(P>0.05),表明真空冷冻干燥能够较完整保留仿刺参性腺的脂质组分。与鲜样相比,冷风干燥后PL含量无显著变化(P>0.05),微波和热风干燥后变化显著(P<0.05),分别由6.58%降至5.72%、4.50%,表明较高的温度会促进PL的降解,同时较长时间的热加工会破坏细胞PL结构,水解程度加深[12]。热风干燥、微波干燥和冷风干燥均显著降低了样品中TAG含量(P<0.05),这与高温和氧气等作用下脂质发生氧化分解有关。与PL相比,TAG含量降低更加显著,这可能是脂肪酶活性高于磷脂酶所导致[25]。冷风干燥后FFA显著升高(P<0.05),这与较长的干燥时间促进脂质水解以及相对较低的干燥温度抑制了FFA分解有关。与冷风干燥相比,热风干燥样品FFA未见显著变化,可能与FFA的产生与分解形成一定的动态平衡存在紧密联系。微波干燥FFA显著低于热风、冷风干燥(P<0.05),表明微波处理可能导致更多FFA分解生成醛、酮、酸等挥发性物质,赋予样品更浓郁的香气[10]。
2.2 不同干燥方式下仿刺参性腺虾青素含量变化
由图2可知,经不同干燥方式处理后,仿刺参性腺中的虾青素含量显著降低(P<0.05),这可能与干燥过程中水分的流失有关。此外,不同干燥方式处理过程中温度、光照、时间等因素造成了虾青素氧化分解的程度不同[26]。真空冷冻干燥样品的虾青素含量显著高于其他3 种干燥方式(P<0.05),这是因为真空冷冻干燥温度低且干燥过程隔绝氧气,能够有效减缓脂质氧化的速率[27]。这与Li Deyang等[13]对比了凡纳滨对虾真空冷冻干燥后虾青素含量变化结果一致。在这几种干燥方式中,冷风干燥虾青素含量最低,为315.31 mg/kg,这是因为较长的干燥时间能够促进酯化虾青素的水解,产生更易氧化的游离虾青素[28]。

图2 不同干燥方式下仿刺参性腺虾青素含量变化Fig.2 Changes in astaxanthin content of dried A.japonicus gonads obtained by different drying methods
2.3 不同干燥方式下仿刺参性腺脂肪酸变化
由表1可知,仿刺参性腺鲜样共检测出25 种脂肪酸,其中饱和脂肪酸(saturated fatty acid,SFA)9 种,以棕榈酸(C16:0)和硬脂酸(C18:0)为主;MUFA 6 种,其中棕榈油酸(C16:1)含量较高;PUFA 10 种,二十碳五烯酸(eicosapentaenoic acid,EPA)(C20:5n-3)和花生四烯酸(arachidonic acid,ARA)(C20:4n-6)占比较高。EPA、ARA作为人体的必需脂肪酸,在调节脂质代谢、增强免疫力等方面具有重要作用[20],鲜样中EPA、ARA分别占总脂肪酸含量18.14%、5.25%,高于凡纳滨对虾[29]、鲅鱼[30]等水产品。鲜样经真空冷冻干燥处理后,MUFA相对含量略有升高,PUFA相对含量略有降低,SFA无显著变化(P>0.05),脂肪酸组成未发生改变。在微波、热风和冷风干燥后,C16:0、C18:0、C16:1等脂肪酸比例下降,SFA、MUFA均显著降低,且在微波干燥样品中降低最显著;PUFA均显著升高,而Colakoglu等[31]研究发现干制鳐鱼PUFA较鲜鱼有所降低。可能是原料种类、形态和干燥条件的差异造成了PUFA稳定性的差异,也可能因为仿刺参性腺经干燥处理后氧化分解的SFA和MUFA总量较PUFA更多,导致PUFA相对含量的上升。

表1 不同干燥方式下仿刺参性腺脂肪酸组成变化Table 1 Changes in fatty acid composition of dried A.japonicus gonads obtained by different drying methods%
AI和TI可以评估食物对冠心病发病率的潜在影响,较低的AI和TI表明食物的脂肪酸营养价值更高,对抗动脉粥样硬化、抗血栓形成起到更大的作用,更有益于人体健康。H/H与胆固醇代谢有关,数值越高越有益于人体健康[20]。如表2所示,仿刺参性腺鲜样AI为0.27、TI为0.15,均低于新鲜紫贻贝(AI为1.09、TI为0.34);H/H为2.70,高于紫贻贝H/H(1.04)[32]。AI、TI在干燥处理后不同程度降低,H/H显著升高(P<0.05),这说明上述干燥方式一定程度上提高了仿刺参性腺的营养价值。其中微波干燥AI、TI的降低和H/H的升高最明显,表明微波干燥样品脂肪酸营养价值最高。Gang Kaiqi等[14]在热风干燥海螺中发现AI和TI显著升高,与本研究结果不同,这可能与不同物种之间的脂肪酸组成差异有关。

表2 不同干燥方式下仿刺参性腺脂质营养质量评价指数变化Table 2 Changes in nutritional quality indexes of lipids in dried A.japonicus gonads obtained by different drying methods
2.4 不同干燥方式下仿刺参性腺AV变化
AV通常用于评估脂质水解的程度,AV的升高与脂类分解生成FFA有关[11]。图3显示,在不同干燥方式中,冷风干燥AV最高,为22.62 mg/g,这与其干燥时间长以及O2促进了脂质的氧化水解有关;而微波干燥、热风干燥耗时较短,真空冷冻干燥隔绝O2,这可能是其AV较鲜样无显著变化的原因。此外,高温或低温均会抑制脂肪酶活性,使FFA的生成速率下降,同时FFA能够进一步分解产生挥发性醛、酮、酸等小分子物质[33]。

图3 不同干燥方式下仿刺参性腺脂质AV变化Fig.3 Changes in AV of dried A.japonicus gonads obtained by different drying methods
2.5 不同干燥方式下仿刺参性腺POV变化
POV反映氢过氧化物的含量,可以指示脂质的初级氧化程度[34]。在脂质氧化初级阶段,氢过氧化物含量的升高表明脂质氧化程度的加深。然而由图4可知,4 种干燥方式样品POV均显著低于鲜样(P<0.05),这是由于氢过氧化物不稳定,易分解生成醛、酮等次级氧化产物,且高温会加速其分解[9],导致氢过氧化物降解速率高于生成速率,与Zhang Jinjie等[33]研究结果一致。相较于其他干燥方式,真空冷冻干燥样品POV最高,为1.45 mmol/kg,表明该方式下氢过氧化物的降解速率较低。
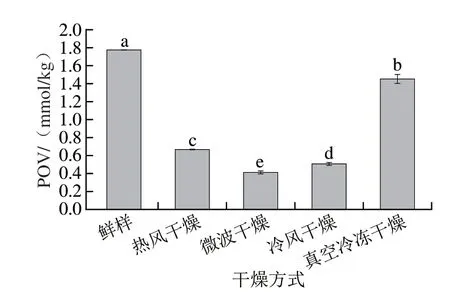
图4 不同干燥方式下仿刺参性腺脂质POV变化Fig.4 Changes in POV of dried A.japonicus gonads obtained by different drying methods
2.6 不同干燥方式下仿刺参性腺TBARS值变化
TBARS值可以表征脂质的次级氧化程度[35]。从图5可以看出,4 种干燥方式样品TBARS值较鲜样均显著提高(P<0.05),其中冷风干燥样品的TBARS值最高,为1.28 mg/kg,表明冷风样品中的脂质氧化最为剧烈,与Ortiz等[36]干燥大西洋鲑鱼的研究结果相似,这可能是干燥时间较长,脂质被氧化所导致。相比于其他干燥方式,真空冷冻干燥脂质氧化程度较低,为0.46 mg/kg。微波干燥的TBARS值显著高于热风干燥(P<0.05),与Fu Xiangjin等[37]干燥鲢鱼所得结论不同,这可能与原料形态、干燥时间等因素有关。
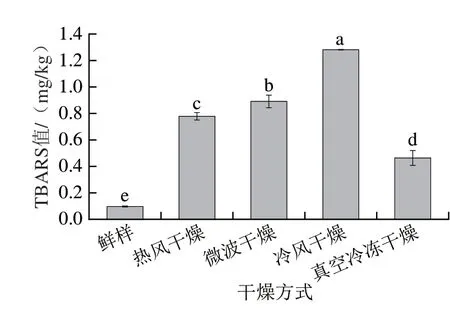
图5 不同干燥方式下仿刺参性腺TBARS值变化Fig.5 Changes in TBARS value of dried A.japonicus gonads obtained by different drying methods
2.7 不同干燥方式下仿刺参性腺电子鼻结果分析
由图6不同干燥方式处理后仿刺参性腺样品的电子鼻主成分分析(principal component analysis,PCA)可知,PC1和PC2的贡献率分别为98.88%和0.98%,总贡献率为99.86%,表明这两个PC基本涵盖了样本信息,可以表征不同干燥方式仿刺参性腺的气味组成。各样品区域相对独立,表明4 组样品的气味存在明显差异。此外,鲜样和真空冷冻干燥样品距离较近,说明真空冷冻干燥样品的气味变化更小。

图6 不同干燥方式下仿刺参性腺电子鼻PCA图Fig.6 PCA plot of electronic nose responses for dried A.japonicus gonads obtained by different drying methods
2.8 GC-IMS分析
采用GC-IMS进行挥发性化合物的鉴定,并绘制指纹图谱(图7)。在5 类样品中共定性得到28 种挥发性化合物,其中乙醇、乙酸丙酯、3-羟基-2-丁酮这3 种化合物含量较高,产生了二聚体。挥发性化合物分为8大类,包括7 种酮类化合物、6 种醇类化合物、5 种醛类化合物、5 种酯类化合物、2 种含硫化合物、1 种羧酸类化合物、1 种烯烃化合物和1 种含氮化合物。

图7 不同干燥方式下仿刺参性腺挥发性化合物指纹图谱Fig.7 Gallery plots of volatile compounds in dried A.japonicus gonads obtained by different drying methods
新鲜仿刺参性腺样品挥发性化合物以醛类和醇类为主,其中苯甲醛、丙醛、乙醇、正丙醇相对含量较高。4 种干燥方式均造成了丙醛含量的降低,这可能是因为丙醛对水的亲和力较强,干燥过程中水分流失一定程度上导致了丙醛的损失[38]。真空冷冻干燥温度较低且脂质氧化程度较低,因此干燥后挥发性物质的种类相对较少,风味较为平淡;乙醇、2-丁酮、α-蒎烯、乙酸丙酯是真空冷冻干燥样品中的主要气味物质;与鲜样相比,2-丁酮含量有所上升,主要来自于脂肪酸的β-氧化,呈现出一定的奶油香气[39]。乙酸丙酯(阈值为240 μg/kg)赋予样品清香味。α-蒎烯多来自脂肪酸烷基的裂解,具有松油味,但其阈值较高,对风味的贡献较低[40]。冷风干燥样品中α-蒎烯、乙酸丙酯含量高于真空冷冻干燥样品;另外,乙酸乙酯、戊醛、3-甲基-1-丁醇、3-羟基-2-丁酮、甲基丙烯基二硫醚含量较高;戊醛仅在冷风干燥样品中被大量检测到,其生成与亚油酸氢过氧化物的分解有关[41],这一定程度上表明冷风干燥的脂质氧化程度较其他干燥方式剧烈。3-甲基-1-丁醇可能是由3-甲基丁醛氧化而来[42],阈值较低(170 μg/kg),对样品风味的形成起到一定的作用。3-羟基-2-丁酮(阈值为55 μg/kg)赋予冷风干燥样品独特的奶油香味[43]。然而,高浓度的甲基丙烯基二硫醚具有刺激性的蒜味[44],可能导致样品整体可接受度的降低。热风干燥样品检出的挥发性化合物以酮类为主,其中6-甲基-5-庚烯-2-酮(阈值为1 000 μg/kg)具有柠檬草香气,丙酮、羟基丙酮等脂质氧化产物赋予样品一定的坚果香气[45]。微波干燥样品中3-甲基丁醛、3-戊酮、2-丙醇、乙酸丁酯含量较高。其中3-甲基丁醛(阈值为1.2 μg/kg)由亮氨酸在高温下Strecker降解形成,赋予样品巧克力味和坚果味[46]。此外,己醛、2,5-二甲基吡嗪仅在微波干燥样品中检测到。己醛(阈值为5 μg/kg)通常由亚油酸氧化为(2E,4E)-2,4-癸二烯醛后继续降解而得到,具有原生味和水果味[45]。2,5-二甲基吡嗪(阈值为1 700 μg/kg)通常由氨基酸Strecker降解产生的羰基化合物缩合而成,是美拉德反应的特征产物,赋予微波干燥样品令人愉悦的焙烤香气,与Zhang Jiahui等[47]的研究结果一致。这可能是微波干燥样品具有区别于其他样品的气味特征的原因。
根据上述挥发性化合物的信号强度绘制PCA评分图(图8),各样品区域相对独立,表明仿刺参性腺经不同干燥方式处理后风味发生了明显变化。此外,真空冷冻干燥样品区域与鲜样较为接近,表明其气味变化相对较小,这一结论与电子鼻结果一致。

图8 不同干燥方式下仿刺参性腺挥发性化合物PCA评分图Fig.8 PCA score plot showing variations in volatile compounds among dried A.japonicus gonads obtained by different drying methods
综上所述,干燥方式的不同对仿刺参性腺挥发性化合物的种类和含量具有显著影响。作为挥发性物质的形成的重要前体物质,脂质的氧化分解对样品气味有重要贡献。结合对脂质组成和稳定性的分析,冷风干燥的脂质氧化程度最剧烈,因此冷风干燥样品中挥发性物质的种类最多;真空冷冻干燥过程中脂质稳定性最好,故真空冷冻干燥样品中挥发性物质种类相对较少,气味较为平淡。
3 结论
不同干燥方式(热风干燥、冷风干燥、微波干燥、真空冷冻干燥)对仿刺参性腺样品的脂质、营养价值和挥发性物质有显著影响。真空冷冻干燥样品脂质组成较鲜样未见显著变化(P>0.05),脂质稳定性较好,但气味相对平淡。冷风干燥耗时较长,脂质氧化程度剧烈,挥发性物质种类较多,呈现出一定的奶油香气。热风干燥样品PL、TAG显著降低(P<0.05),挥发性物质以酮类为主,赋予样品柠檬草香和坚果香气。微波干燥样品脂肪酸营养价值最高,且吡嗪类物质使得微波干燥样品产生区别于其他样品的焙烤香气。研究结果可为仿刺参性腺的精深加工提供参考。

