微酸性电解水对空肠弯曲菌的杀灭特性及机制
宋欣坤,庞柳欣,牛玲玲,岳 婷,牛际涵,张春玲
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
空肠弯曲菌是革兰氏阴性微需氧菌,主要存在于家禽和野禽体内,是一种人畜共患的细菌病原体,会引发腹泻、流产、不育、乳房炎以及传染性肝炎等疾病[1]。人类可通过与动物及其生活环境接触,食用未煮熟的肉类、农产品或饮用受污染的乳品、水等感染空肠弯曲菌。空肠弯曲菌具有耐药性,在不利环境中会进入可存活但不可培养状态,难以被完全杀灭,存在食品安全隐患[2-3]。空肠弯曲菌可引发人类肠胃炎、发烧、血便等,甚至可引发米勒-费希尔综合征和格林-巴利综合征[4]。世界卫生组织已将空肠弯曲菌定义为常见的食源性致病菌之一[5]。通常屠宰多采用物理或化学方法去污除菌,主要包括身体清洁、物理和化学脱毛以及用热水或化学物质(次氯酸钠)漂洗等传统方法,不仅存在清洁程度较低的缺陷,还可能会对禽肉的质量产生负面影响。所以,进行补充干预去污十分必要,如脉冲光、超声波、冷大气等离子体、臭氧、二氧化氯、电解水等补充干预手段,它们具有毒性更低、形式更稳定、对产品质量影响更小等优点,是屠宰加工领域替代次氯酸钠等传统净化方法的候选方法,上述部分方法在实际应用中仍存在商业化难、能耗多等缺陷,而电解水由于制取方便、绿色高效的特点受到广泛关注。
微酸性电解水(slightly acidic electrolyzed water,SAEW)是在无隔膜电解槽中电解稀盐或稀盐酸溶液而生成的具有特殊理化性质的水溶液[6]。SAEW的pH值为5.0~6.5,有效氯成分主要是次氯酸(HClO),其杀菌能力是ClO-的80~150 倍。SAEW具有杀菌高效广谱、腐蚀性低、安全环保、pH值更加温和等优点,已在食品行业中广泛应用[7]。研究表明SAEW对大肠杆菌、单核细胞增生李斯特菌(以下简称单增李斯特菌)、金黄色葡萄球菌、蜡状芽孢杆菌等多种食源性致病菌具有良好杀灭效果[8-11]。
本研究以空肠弯曲菌作为研究对象,考察SAEW对纯培养空肠弯曲菌的杀灭效果,以及有机质对杀菌效果的影响,同时对SAEW杀灭多代空肠弯曲菌的效果进行评估,以确保SAEW杀菌方式的安全性;最后,对SAEW杀灭空肠弯曲菌的特性和机制进行研究,以期为SAEW对食品中空肠弯曲菌的杀灭提供理论依据。
1 材料与方法
1.1 材料与试剂
空肠弯曲菌(Campylobacter jejuni)ATCC 33560来源于美国模式菌株收集中心。
次氯酸钠 天津市致远化学试剂有限公司;哥伦比亚血琼脂、脱纤维羊血、微需氧袋、培养罐 青岛海博生物有限公司;牛血清白蛋白(bovine serum albumin,BSA)北京天勤一和生物科技有限公司;Live/Dead BacLight细菌细胞活性测定试剂盒L7012 美国赛默飞世尔科技公司;Bradford蛋白浓度测定试剂盒和ATP检测试剂盒 上海碧云天生物技术有限公司;其他有机溶剂均为国产分析纯。
1.2 仪器与设备
InfiniteTMM200 PRO酶标仪、victorX3多功能酶标仪瑞士帝肯集团公司;PTH027有效氯测量计 英国百灵达有限公司;FE28 pH/氧化还原电位(oxidation reduction potential,ORP)计 瑞士梅特勒-托利多仪器有限公司;Harmony-II SAEW生成设备 北京睿安德科技有限公司;Vortex-2涡旋仪 上海沪析实业有限公司;S-3400N场发射扫描电子显微镜 日本日立公司;DM5000B荧光显微镜 德国Leica公司;GHX-9050B-2细菌培养箱 上海福玛实验设备有限公司。
1.3 方法
1.3.1 SAEW的制备
本研究选用Harmony-II为电解水生成设备,制备pH值为5.0~6.5,有效氯质量浓度(available chlorine concentration,ACC)为10、20、30、40 mg/L和50 mg/L的SAEW,制备完成后立即检测其理化指标。SAEW的ACC由有效氯测定仪测定;pH值和ORP由双标度pH/ORP计测量。用相应ACC的NaClO溶液及无菌去离子水作为对照。本研究所用处理溶液的理化参数如表1所示。

表1 SAEW和NaClO溶液的理化指标Table 1 Physicochemical parameters of SAEW and NaClO solution
1.3.2 菌液制备
用无菌接种环将冻存管内的空肠弯曲菌接种于哥伦比亚血琼脂上进行活化,42 ℃微需氧条件(5% O2、10%CO2和85% N2)培养48 h。挑取单菌落划线于哥伦比亚血琼脂平板,42 ℃微需氧条件下纯化培养24 h。挑取单菌落于含有5%脱纤维羊血的Bolton肉汤中,42 ℃微需氧培养48 h后离心重悬,置于4 ℃保存备用。
1.3.3 SAEW对空肠弯曲菌的杀灭效果
分别将菌悬液与不同ACC(10、20、30、40 mg/L和50 mg/L)的SAEW按照1∶9(V/V)的比例混合处理1、2、5 min和10 min,以1∶1(V/V)的比例取反应液与5 g/L Na2S2O3溶液中和剂混合终止杀菌,涂布后置于42 ℃细菌培养箱中,微需氧条件培养48 h后用平板菌落计数法检测空肠弯曲菌的存活率,使用NaClO和无菌去离子水作为对照。同时,取杀菌时间为2 min的样品置于4 ℃保存,备用于后续实验。
1.3.4 蛋白质对SAEW空肠弯曲菌杀灭效果的影响
参照邴珊[12]的方法,将BSA制成质量浓度为3、10 g/L及30 g/L的干扰物,4 ℃保存备用。取9 mL ACC为30 mg/L的SAEW处理1 mL菌悬液,处理后的菌液与不同质量浓度的BSA等比例混合,处理2 min;取9 mL ACC为10、20、30、40 mg/L和50 mg/L的SAEW处理1 mL菌悬液,处理后的菌液与10 g/L的BSA等比例混合,处理2 min;取9 mL ACC为30 mg/L的SAEW处理1 mL菌悬液,处理后的菌液与10 g/L的BSA等比例混合,处理不同时间(1、2、5、10 min)。以1∶1(V/V)的比例取反应液与5 g/L的Na2S2O3溶液中和剂混合终止杀菌反应,涂布置于42 ℃细菌培养箱中,微需氧条件培养48 h后计数,使用NaClO和无菌去离子水作为对照。
1.3.5 SAEW多代杀菌效果的测定
参照梁铎[13]的方法,取菌液与10 mg/L SAEW按1∶9(V/V)比例混合,涡旋振荡充分后终止杀菌。平板涂布后42 ℃微需氧培养48 h。计数后挑选稀释度合适的平板,挑取菌落加入Bolton肉汤培养基,相同条件培养48 h,再次进行杀菌实验。每次杀菌实验为一代,重复此过程即为多代杀菌。结果以杀菌率表示,计算公式为:
1.3.6 SAEW处理对空肠弯曲菌细胞膜完整性的影响
参照Wang Yao等[14]的方法,使用Live/Dead BacLight细菌细胞活性测定试剂盒L7012进行荧光染色。将处理后的菌液离心、漂洗、重悬。加入3 μL 1∶1(V/V)混合的SYTO-9和碘化丙啶(propidium iodide,PI)染料,室温避光孵育15 min,用荧光显微镜观察并拍照。
1.3.7 扫描电子显微镜观察细菌形态变化
参照Shi Chao等[15]的方法通过电子显微镜观察细菌形态变化:将SAEW处理后的菌液离心,磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗2 次,2.5%戊二醛溶液固定过夜,PBS漂洗3 次,不同体积分数(30%、50%、70%、80%、90%和100%)乙醇溶液梯度洗脱样品。固定样品,脱水后镀金,通过扫描电子显微镜观测拍照。
1.3.8 SAEW处理对空肠弯曲菌细胞膜损伤的影响
1.3.8.1 SAEW处理后空肠弯曲菌细胞内DNA的泄漏情况
参照Cao Shuo等[16]的方法测定细胞内DNA的泄漏:处理后菌液离心,PBS漂洗后收集上清液,过滤,使用多功能酶标仪在260 nm波长处测量滤液的光密度(OD260nm)值。
1.3.8.2 SAEW处理后空肠弯曲菌细胞内蛋白质的泄漏情况
采用Bradford蛋白浓度测定试剂盒测定细胞内蛋白质的质量浓度:处理后菌液离心,PBS漂洗后收集上清液,使用酶标仪在570 nm波长处测定OD570nm值。依据使用的样品体积计算出蛋白质量浓度。
1.3.8.3 SAEW处理后空肠弯曲菌细胞内ATP的泄漏情况
参照Sánchez等[17]的方法测定细胞ATP浓度:处理后菌液在冰上超声,离心后收集上清液置于冰上备用,使用ATP检测试剂盒测定细胞内ATP含量,使用多功能酶标仪测定荧光强度。依据测定的标准曲线计算细胞内ATP的浓度。
1.4 数据处理
本研究的数据均是独立实验重复3 次获得,并采用SPSS对数据进行统计学分析,以的形式表示数据(n=3),采用Duncan’s ANOVA对结果进行显著性分析比较(以P<0.05表示差异显著)。
2 结果与分析
2.1 不同ACC的SAEW对空肠弯曲菌的杀灭效果
采用不同ACC的SAEW和NaClO溶液对空肠弯曲菌进行2 min杀灭处理。由图1可以看出,随着ACC的增加,SAEW对空肠弯曲菌的杀灭效果逐渐增强,呈浓度依赖性。相同ACC时,SAEW处理后空肠弯曲菌的减少量显著大于NaClO处理(P<0.05),表明SAEW杀灭作用更强。有研究表明,ACC为20 mg/L的SAEW处理1 h或2 h后,空肠弯曲菌减少1.5~1.7(lg(CFU/g)),抑制作用显著大于相同ACC的酸性电解水处理组[18]。Yang Gaoji等[19]研究也发现,相同ACC时,SAEW比NaClO对蜡样芽孢杆菌的杀灭效果更好。对单增李斯特菌的杀灭研究中也发现与150 mg/L的NaClO溶液相比,ACC约为60 mg/L的SAEW具有相同或更高的杀菌功效[20]。
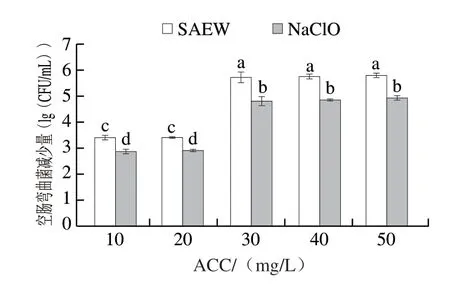
图1 不同ACC的SAEW和NaClO对空肠弯曲菌的杀灭效果Fig.1 Bactericidal effects of SAEW and NaClO at different ACC levels on C.jejuni ATCC 33560
2.2 SAEW处理不同时间对空肠弯曲菌的杀灭效果
采用ACC为30 mg/L的SAEW对空肠弯曲菌分别进行1、2、5 min和10 min的处理,结果如图2所示。随着处理时间的延长,SAEW和NaClO对空肠弯曲菌的杀灭效果均逐渐增强,并且不同处理间具有显著性差异(P<0.05)。研究表明,ACC为60 mg/L的SAEW处理10 min后可以完全杀灭肠炎沙门氏菌、金黄色葡萄球菌、蜡样芽孢杆菌和大肠杆菌[21],并且SAEW对蜡样芽孢杆菌的灭活效果在很大程度上取决于ACC水平和暴露时间以及菌株和生长条件[11]。在SAEW和NaClO处理1 min内空肠弯曲菌减少速度最快,分别减少了5.42(lg(CFU/mL))和4.72(lg(CFU/mL)),当处理时间为10 min时,SAEW处理和NaClO处理的空肠弯曲菌减少量均达到最大,分别为6.23(lg(CFU/mL))和5.22(lg(CFU/mL))。结果表明,相同处理时间条件下SAEW比NaClO的杀菌效果更好。

图2 SAEW和NaClO处理不同时间对空肠弯曲菌的杀灭效果Fig.2 Bactericidal effects of treatment time of SAEW and NaClO treatments on C.jejuni ATCC 33560
2.3 蛋白质对SAEW杀灭空肠弯曲菌的影响
2.3.1 不同蛋白质量浓度SAEW对空肠弯曲菌的杀灭效果
在不同质量浓度BSA干扰下,采用ACC为30 mg/L的SAEW处理空肠弯曲菌2 min,结果如图3所示。随着蛋白质量浓度增加,SAEW对空肠弯曲菌的杀灭效果逐渐减弱,BSA为0 g/L时,SAEW处理组空肠弯曲菌减少量为5.72(lg(CFU/mL)),BSA为30 g/L时,SAEW处理组为3.41(lg(CFU/mL)),与BSA质量浓度为0 g/L时相比下降了40.38%,不同蛋白质量浓度对SAEW杀菌效果的影响有显著差异(P<0.05)。相同蛋白质量浓度下,NaClO处理组杀灭效果弱于SAEW处理组。有研究发现SAEW杀菌效果会随着蛋白质浓度的增加而减弱[22]。Ni等[23]研究也发现,SAEW处理大肠杆菌、肠炎沙门氏菌和金黄色葡萄球菌的杀菌效率随着ACC的增加而增加,随着BSA质量浓度的增加而降低,并且增加蛋白质浓度可以加速SAEW的ACC的降低[24]。以上研究表明,蛋白质会显著影响SAEW和NaClO的杀灭效果,蛋白质量浓度越高,SAEW的杀菌效果越差,因此在SAEW的实际应用中应降低接触蛋白质的浓度,保证SAEW的杀灭效果。
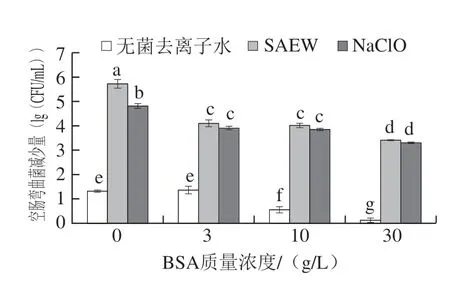
图3 不同蛋白质量浓度干扰下SAEW和NaClO处理对空肠弯曲菌的杀灭效果Fig.3 Bactericidal effects of SAEW and NaClO treatments on C.jejuni ATCC 33560 under different BSA concentration
2.3.2 蛋白质存在时不同ACC的SAEW对空肠弯曲菌的杀灭效果
在10 g/L蛋白质存在时,采用ACC分别为10、20、30、40 mg/L和50 mg/L的SAEW和NaClO溶液处理菌液2 min,结果如图4所示。随着ACC的增加,SAEW对菌液的杀灭效果逐渐增加,当ACC小于20 mg/L时,SAEW处理组和NaClO处理组的杀菌效果无显著差异(P>0.05),推测蛋白质在一定程度上干扰了ACC较低时SAEW中游离氯的作用,当ACC大于20 mg/L时,即使存在蛋白质干扰,SAEW的杀菌效果也强于NaClO,表明当ACC小于20 mg/L时,蛋白质消耗了大部分有效氯,导致杀菌效果大大减弱。在电解水应用于肉类工业的研究中发现,有机物存在时,与NaClO的杀菌效果相比,SAEW的杀菌效果更稳定[24]。因此在处理肉类等含有蛋白质的样品时,应选取合适ACC的SAEW处理样品。
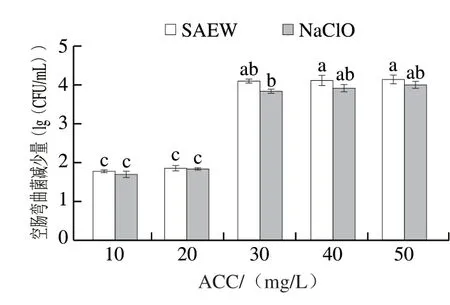
图4 蛋白质存在时不同ACC的SAEW和NaClO处理对空肠弯曲菌的杀灭效果Fig.4 Bactericidal effects of SAEW and NaClO treatments at different ACC levels against C.jejuni ATCC 33560 in the presence of exogenous protein
2.3.3 蛋白质存在时SAEW处理不同时间对空肠弯曲菌的杀灭效果
在10 g/L蛋白质干扰下,采用ACC为30 mg/L的SAEW处理空肠弯曲菌1、2、5 min和10 min,结果如图5所示。随着处理时间的延长,SAEW对空肠弯曲菌的杀灭效果增强,当SAEW处理10 min时,空肠弯曲菌减少数量达到最大值(4.12(lg(CFU/mL))),低于相同ACC的SAEW处理空肠弯曲菌纯培养液时的最大值(6.23(lg(CFU/mL)))。SAEW和NaClO处理1 min内空肠弯曲菌减少速率最快,1 min后趋于稳定。有研究发现,在模拟洗涤的过程中,与蔬菜产品相比,肉类消耗有效氯更快[22]。Park等[25]的研究也发现,随着蛋白质的增加,游离的有效氯含量降低。SAEW杀菌效率的不断降低是有机质不断消耗有效氯导致的。虽然蛋白质会减弱杀菌作用,但是SAEW杀菌效果仍然强于NaClO,因此在食品工业中应用SAEW时应考虑不同食品中蛋白质的数量和类型,合理选择处理时间,从而优化杀菌条件和效果。
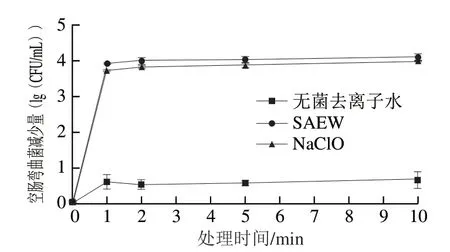
图5 蛋白质存在时SAEW和NaClO处理不同时间对空肠弯曲菌的杀灭效果Fig.5 Effect of treatment time of SAEW and NaClO on inactivation of C.jejuni ATCC 33560 under protein interference
2.4 SAEW多代杀菌效果
采用ACC为10 mg/L的SAEW对多代培养的空肠弯曲菌处理2 min,考察SAEW的杀灭效果,结果如图6所示。SAEW对第一代菌的杀菌率为26.3%,之后每代的杀菌率均在24.95%~29.80%,且差异较小。梁铎[13]通过连续多代处理,分析SAEW对单增李斯特菌的多代杀菌效果,第一代杀菌率为56.33%,之后每代的杀菌效果均在47.71%~82.75%之间,且差异不显著(P>0.05),这表明单增李斯特菌在10 代之内对SAEW不产生耐药性。由实验结果可知,10 代以内空肠弯曲菌不会对低浓度SAEW产生耐受性而降低杀菌效果,因此,可以采用SAEW杀灭空肠弯曲菌。

图6 SAEW对空肠弯曲菌的多代杀菌效果Fig.6 Comparison of multi-generational inactivation effects of SAEW on C.jejuni ATCC 33560
2.5 SAEW处理对空肠弯曲菌细胞活力的影响
通过荧光显微镜观察SAEW和NaClO处理对空肠弯曲菌细胞活力的影响,结果如图7所示。SYTO9是一种可渗透细胞的核酸染料,PI仅穿透膜受损的细菌,具有完整细胞膜的细菌被染成绿色荧光,膜受损的细菌显示红色荧光。由图7A可知,无菌去离子水处理的空肠弯曲菌多数为强绿色荧光,红色荧光数较少,表明对照组细胞膜几乎完好无损。随着ACC的增加,红色荧光数大幅增加,表明SAEW、NaClO对细胞膜完整性的破坏与浓度呈正相关,且相同ACC条件下NaClO处理组(图7b~f)的红色荧光明显少于SAEW处理组(图7B~F),表明SAEW对细胞膜的损伤程度更强。有研究使用SAEW处理腐败链球菌和腐生链球菌,也发现SAEW会破坏细胞膜完整性[26]。用ImageJ软件对荧光图片进行定量分析,结果如图8所示。随着ACC的增加,红色荧光与绿色荧光比值逐渐增加,表明细胞膜破坏程度加深,与荧光图片结果一致。当ACC大于等于40 mg/L时,SAEW处理和NaClO处理的红色荧光与绿色荧光的比值存在显著性差异(P<0.05),表明此时SAEW对细胞膜的破坏作用明显强于NaClO处理。以上研究表明,SAEW可能通过损害细胞膜完整性杀灭空肠弯曲菌。

图7 SAEW和NaClO处理后空肠弯曲菌荧光显微镜图像Fig.7 Fluorescence microscopic images of C.jejuni ATCC 33560 treated with SAEW and NaClO
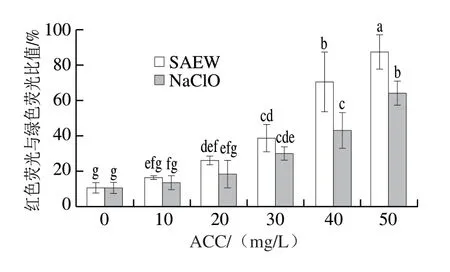
图8 SAEW和NaClO处理后空肠弯曲菌荧光显微镜图像红色荧光/绿色荧光比值定量分析Fig.8 Quantitative analysis of red/green fluorescence ratios in the fluorescence microscopic images of C.jejuni ATCC 33560 treated with SAEW and NaClO
2.6 SAEW处理对空肠弯曲菌形态的影响
对不同ACC的SAEW处理了2 min的空肠弯曲菌形态通过扫描电子显微镜进行观察,以无菌去离子水作为对照,结果如图9所示。无菌去离子水处理的菌体图像呈现较完整和光滑的弯曲形(图9A),而SAEW处理的菌体表面能清楚地观察到不规则、褶皱、凹陷、破损甚至破裂(图9B~F),且菌体表面损伤程度随着ACC的增加而增加。类似研究发现,SAEW会破坏和损伤大肠杆菌和枯草芽孢杆菌,使其形态发生改变,推测SAEW可能通过改变菌体形态、增强膜的渗透性和细菌悬浮液中的导电性,导致钾离子和蛋白质从细菌细胞中释放出来[27-28]。以上研究表明,SAEW处理会改变菌体形态,导致其表面呈现不同程度的损伤,因此可以推测SAEW可能通过改变和破坏菌体形态结构杀灭空肠弯曲菌。
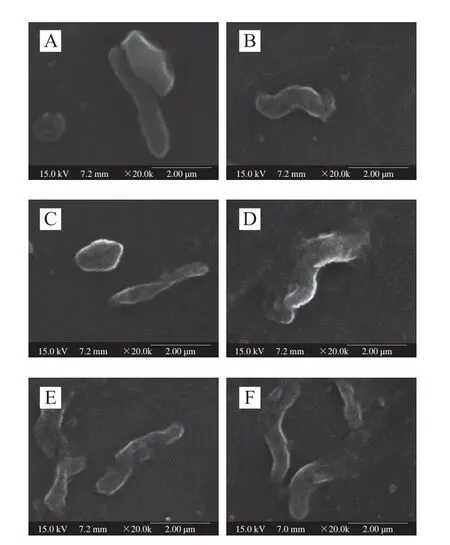
图9 SAEW处理后空肠弯曲菌场发射扫描电子显微镜图像Fig.9 Field emission scanning electron microscopy photomicrographs of C.jejuni ATCC 33560 treated with SAEW
2.7 SAEW处理对空肠弯曲菌细胞膜损伤的影响
2.7.1 SAEW处理后空肠弯曲菌细胞内DNA的泄漏情况
采用不同ACC和处理时间,观察SAEW对细胞内核酸泄漏的影响,结果如图10所示。处理组的OD260nm远高于对照组,且OD260nm与ACC呈正相关。然而,随着处理时间的延长,OD260nm先迅速上升后趋于平稳。相似的研究表明,Rhizopus stoloniferOD260nm随着超声功率和SAEW ACC的增加而增加,当联合使用500 W的超声和55 ℃ 50 mg/L的SAEW处理10 min时,OD260nm最高,表明此时胞内物质泄漏最严重,细胞膜被破坏,导致胞内成分释放[29]。有研究表明SAEW处理腐生链球菌时,腐生链球菌的细胞外DNA含量显著增加(P<0.05),且与SAEW的ACC呈正比[27]。以上结果表明,SAEW处理会导致空肠弯曲菌中核酸泄漏,与ACC呈浓度依赖性,因此可以推测SAEW通过增加细胞膜的通透性,导致细胞内核酸泄漏,从而杀灭空肠弯曲菌。
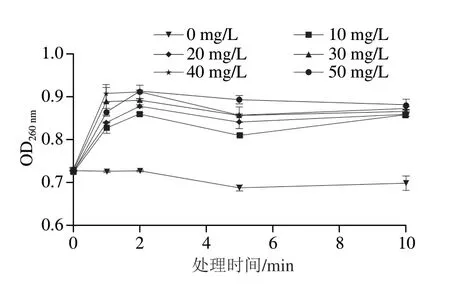
图10 不同ACC的SAEW处理不同时间对空肠弯曲菌核酸的影响Fig.10 Effect of different times of SAEW treatment at different ACC levels on leakage of intracellular nucleic acid from C.jejuni ATCC 33560
2.7.2 SAEW处理后空肠弯曲菌细胞内蛋白质的泄漏情况
蛋白质量浓度可以反映细胞膜的完整性,已测定的标准曲线表明OD570nm与蛋白质量浓度有良好的线性关系(y=0.577 2x+0.630 8,R2=0.996 2),根据标准曲线得到的样品中蛋白质量浓度的结果如图11所示。与对照组相比,蛋白质泄漏质量浓度随着ACC的增加而增加,呈浓度依赖性,且ACC大于等于30 mg/L时,蛋白质泄漏质量浓度显著增加(P<0.05)。有研究表明酸性电解水可以通过增加细胞膜的渗透性导致细胞内成分的泄漏,从而抑制细菌生长[30],与本研究结果一致。Osafune等[31]报道细胞质结构会被酸性电解水冲洗出细胞壁。因此,可以推测SAEW通过增加细胞膜的通透性,导致细胞质成分泄漏,从而杀灭空肠弯曲菌。

图11 不同ACC的SAEW处理2 min对空肠弯曲菌蛋白质的影响Fig.11 Effect of SAEW treatment for 2 min at different ACC levels on leakage of intracellular protein from C.jejuni ATCC 33560
2.7.3 SAEW处理对空肠弯曲菌细胞内ATP浓度的影响
AT P 在细胞的各种生理、病理中起着重要作用,ATP水平的变化会影响细胞的功能。已测定的标准曲线表明荧光强度与ATP浓度呈良好的线性关系(y=35 578x+3 621.3,R2=0.999 8),根据标准曲线得到的样品中ATP浓度的结果如图12所示。与无菌去离子水对照组相比,细胞ATP浓度随着ACC的增加而降低,呈浓度依赖性,且ACC大于等于30 mg/L时,ATP浓度极显著降低(P<0.01)。对照组ATP浓度为(0.30±0.01)μmol/L,当ACC为50 mg/L时,处理后的ATP浓度仅为(0.06±0.02)μmol/L。类似研究发现,3-苯丙酸和SAEW联合处理会造成Klebsiella oxytoca的ATP水平显著变化,表明其联合处理破坏了细胞膜的完整性,导致ATP泄漏,且细胞损伤随着暴露时间的延长而增加[32]。以上研究表明,SAEW会破坏细菌细胞膜的完整性并渗透到细胞中,导致ATP浓度下降。
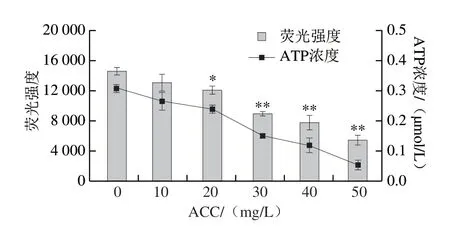
图12 SAEW处理对空肠弯曲菌细胞ATP浓度的影响Fig.12 Effect of SAEW treatment on leakage of intracellular ATP from C.jejuni ATCC 33560
3 结论
本研究表明,SAEW对空肠弯曲菌的杀灭效果与处理时间和ACC呈正相关,并且SAEW的杀灭效果显著高于相同ACC的NaClO,蛋白质存在时,SAEW的杀菌效果会随着蛋白质量浓度的增加而减弱,将空肠弯曲菌进行连续多代处理,在10 代内并未对低浓度SAEW产生明显的抗药性反应。SAEW处理破坏了空肠弯曲菌的形态和细胞膜的完整性,且破坏程度呈浓度依赖性。SAEW处理会导致空肠弯曲菌细胞内核酸、蛋白质、ATP泄漏,细胞活性下降等变化,推测SAEW通过破坏膜完整性杀灭空肠曲菌。

