胰高血糖素样肽-1 类似物研发进展*
冉雨叶,郑 珩
(中国药科大学生命科学与技术学院,江苏 南京 211198)
糖尿病为影响全球约5亿人的复杂代谢疾病,每年需支出9 000 多亿美元并呈逐年增加趋势[1]。在治疗糖尿病的众多药物中,胰高血糖素样肽-1(GLP-1)类似物由于其对血糖控制、体质量管理和心血管预后的有利影响,已成为一类重要的选择[2]。GLP-1是由肠上皮L 细胞分泌的一种肠源性肽,可增加胰岛β 细胞对葡萄糖刺激的胰岛素分泌,还可刺激胰岛β细胞新生并抑制其凋亡,从而起到降血糖作用[3]。但天然的GLP - 1 被二肽基肽酶- 4(DPP - 4)迅速降解和灭活,半衰期仅2 min[4]。通过延长半衰期开发出的GLP-1受体激动剂(GLP - 1RA)能模仿GLP - 1 的作用,抑制胰高血糖素(GCG)的释放,增强机体饱腹感,减少食物摄入。多项大型随机对照试验结果显示,接受GLP-1RA治疗的成人2 型糖尿病(T2DM)患者的心血管事件显著减少[5]。故临床已考虑将其用于心血管疾病高风险或糖尿病患者[6]。由于单靶点GLP- 1RA 领域竞争激烈,对于双靶点或多靶点激动剂的研究日益受到关注。与单靶点GLP- 1RA 相比,双靶点激动剂具有更好的疗效,有望成为T2DM 新的替代疗法。本研究中通过检索PubMed和Web of Science 数据库自建库起至2024年2月20 日的GLP - 1 类似物相关文献,介绍了全球处于不同临床阶段的多靶点GLP - 1RA,以及GLP - 1RA 的新适应证,并对相关基因的治疗手段进行了展望。现报道如下。
1 GLP-1RA 研发概述
1991年,Eng博士从吉拉毒蜥的毒液中提取了一种名为Exendin-4的由39个氨基酸组成的多肽[7]。2005年,以Exendin - 4 为有效成分的艾塞那肽研发成功,成为第一款被美国食品和药物管理局(FDA)批准用于临床治疗T2DM 的GLP-1RA。但由于艾塞那肽的氨基酸序列和人GLP-1 差异较大[8],可能导致机体产生特异性抗体,故并未占据太多市场份额。后续将艾塞那肽包含在聚D,L-乳酸-羟基乙酸中,与其他赋形剂一起通过在注射部位形成微球,改变其药物代谢速率[9],从而成功改造为每周给药1 次的长效制剂(该药最初以BYDUREON为商品名于2012年在美国上市)。
2009年,利拉鲁肽被欧盟批准用于治疗T2DM,其与天然的GLP-1 有97%的氨基酸同源性,但半衰期远长于GLP-1。这是因为利拉鲁肽在第26位赖氨酸上与十六烷酰谷氨酰基侧链结合,形成了1个脂肪酰化的分子,使它能高度非共价地结合于血浆蛋白(主要是白蛋白),从而减慢其皮下注射部位的释放速率和在血液中的扩散速率。利拉鲁肽由于脂肪酰化而对DPP-4 和中性内肽酶(NEP)2 种降解GLP-1 的酶具有较强的抵抗性,从而减慢了其代谢速率。脂肪酰化后还具有较高的分子量和亲油性,使其不易通过肾小球滤过,从而降低了肾排泄速率。此外,利拉鲁肽的脂肪酰化结构使它能在注射部位形成六聚体或更高级的多聚体,这些多聚体具有较低的溶解度和扩散性,从而减缓了从注射部位弥散的速率[10]。相比于每日2 次给药的艾塞那肽的普通剂型,副作用更小和仅需每日1次给药的利拉鲁肽无疑更受到市场青睐。
阿比鲁肽是一种由重组蛋白工程技术制造的融合蛋白,于2014年在美国上市。它由2 个相同的GLP - 1类似物与重组人白蛋白的N-端相连而成,形成稳定的复合物,从而延缓阿比鲁肽的肝脏和肾脏的清除速率,并延长其半衰期[11]。同年在美国上市的度拉糖肽是另一种融合蛋白,由2 个GLP-1 类似物和人免疫球蛋白G4(IgG4)的Fc 片段相连而成。GLP - 1 类似物位于Fc片段的N-端,通过1 个连接肽与Fc 片段相连。Fc 结构域可通过与Fc 受体FcRn 的相互作用延长代谢时间。同时,增加的分子量也延缓了度拉糖肽的肝脏和肾脏清除速率,从而延长其半衰期[12]。
2017年12月,以OZEMPIC 为商品名的司美格鲁肽由FDA 批准上市,相比于利拉鲁肽,司美格鲁肽N-端第8位DPP-4敏感的丙氨酸换成了氨基异丁酸,此外,第26位赖氨酸上结合的十六烷酰谷氨酰基侧链也变成了十八烷酰谷氨酰基侧链[13]。上述化学修饰使司美格鲁肽的半衰期延长为165~200 h,可每周仅皮下给药1次[14],在头对头试验中也打败了利拉鲁肽和度拉糖肽[15],成了疗效最好的单靶点GLP-1RA。
除了改短效制剂为长效制剂,GLP-1RA 的口服剂型也处于积极研发阶段。口服给药的肽类药物需克服生物利用度障碍,如胃肠道的稳定性和跨上皮转运[16]。2019年,口服司美格鲁肽成为首个获批的口服GLP -1RA[17]。它是由司美格鲁肽与渗透增强剂N-[8-(2-羟基苯甲酰基)氨基]辛酸钠(SNAC)共同配制而成,SNAC 能升高胃黏膜的pH,抑制酶的降解,并通过跨细胞途径促进司美格鲁肽的跨皮吸收[18]。
总之,GLP - 1 类似物的研发经历了从短效到长效,从注射剂到口服剂,并扩展到多靶点治疗的过程。目标均为提高药物的生物利用度,降低药物的毒性和副作用,增加药物的稳定性和延长持续时间,从而提高药物的疗效和用药的便利性。部分常见GLP - 1RA 中GLP-1类似物的序列信息[10,19-22]见图1[和人类GLP-1氨基酸序列不同的地方用淡黄色表示,Aib 为α-氨基异丁酸,ADO为8-氨基-3,6-二氧辛酸,AEEA为2-(2-氨基乙氧基)乙氧基乙酸]。
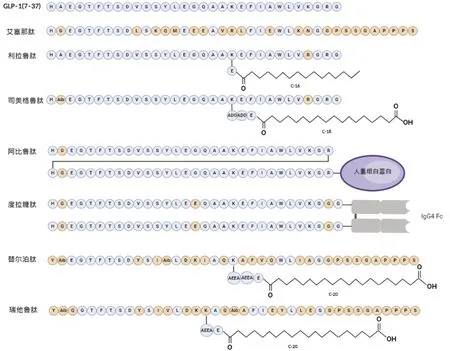
图1 部分常见GLP-1RA中GLP-1类似物的序列结构图Fig.1 Sequence structure of GLP - 1 analogues in some common GLP - 1RAs
2 单分子多靶点GLP-1RA
2.1 总述
HORDB 为开放获取和手动整理的数据库,包含激素肽的各种注释及目前已上市的多肽药物和其制剂的信息[23]。表1 中整理了除已上市多肽药物外,部分已上市或正在研发(截至2024年1月)的单分子多靶点GLP-1类似物(表中,GIPR为葡萄糖依赖性促胰岛素释放多肽受体;T1DM 为1 型糖尿病;NASH 为非酒精性脂肪性肝炎;OSAHS 为阻塞性睡眠呼吸暂停综合征),可见,单分子多靶点的GLP - 1 类似物研发集中在双靶点激动剂GLP - 1R/ GIPR 和GLP - 1R/ GCGR 上。此外,GLP -1R/GLP-2R 双靶点激动剂、GIPR 拮抗剂/GLP-1R、GLP - 1R/ AMY3R 双靶点激动剂、GLP - 1R/ FGF -21R 双靶点激动剂也各有一款药物进入了Ⅱ期临床试验,三靶点方面则以葡萄糖依赖性促胰岛素释放多肽(GIP)RA/GLP-1RA/GCGRA为主。
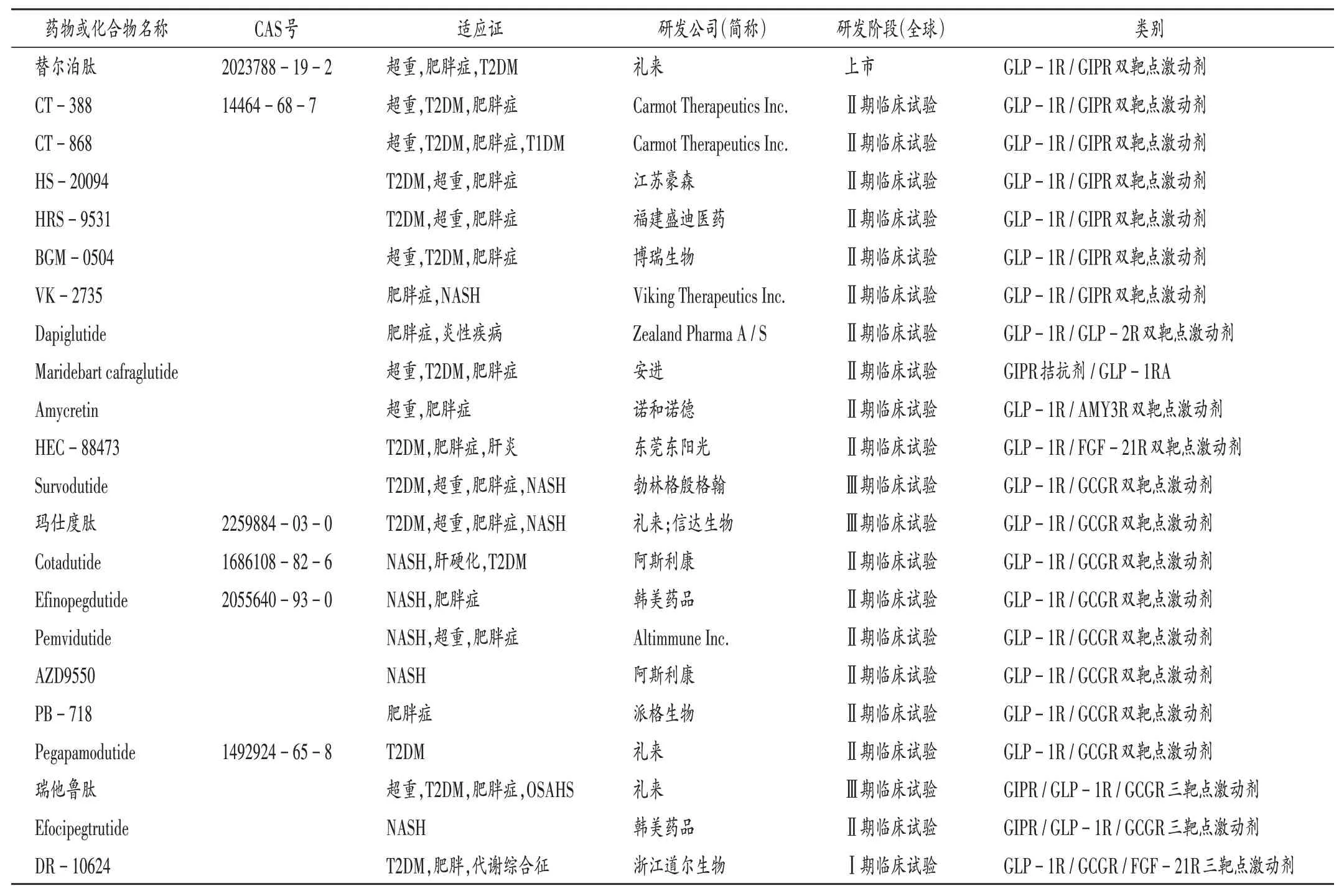
表1 部分已上市或正在研发的单分子多靶点GLP-1类似物Tab.1 Some mono - molecule multi - target GLP - 1 analogues on the market or under development
2.2 GIP-1R/GIPR 双靶点激动剂
GIP和GLP-1均为参与血糖控制的激素,虽然GIP作为健康个体的生理性肠促胰岛素之一发挥着重要作用,但它在T2DM 的治疗中无诱导作用。尽管有研究表明GLP - 1RA 和GIPRA 联用的效果优于单用GLP -1RA,但确切机制尚未明晰[24]。替尔泊肽属GLP - 1R/GIPR 双靶点肠促胰岛素受体激动剂,已于2022年5月获FDA批准用于成人T2DM的血糖管理。在Ⅲ期临床试验中与多个治疗糖尿病的药物进行头对头比较,在所有组别中均获得更高的糖化血红蛋白(HbA1C)及体质量减轻效果[25]。
与GLP - 1 相比,替尔泊肽能更有效地降低血糖。这是因为该药能模仿内源性GIP 的作用。同时,替尔泊肽机制体现为环磷酸腺苷(cAMP)在GLP-1R上合成过度抑制蛋白的募集。由于GIPR 的选择性和GLP-1R 独特的信号特征,这种偏向的激动作用可能会促进胰岛素的分泌。替尔泊肽也被证明可增强一种与脂质和葡萄糖代谢调节有关的脂肪因子——脂联素的水平[26]。
CT-388 和CT-868 是Carmot Therapeutics 公司的两款GLP - 1R/GLPR 双靶点激动剂。CT - 388 仅需每周皮下注射1 次,用于肥胖或T2DM 的治疗,可改善超重/肥胖成人的胰岛素敏感性。CT-868 是每日1 次皮下注射的双靶点激动剂GLPR/GLP-1R,用于超重或肥胖的T1DM的治疗[27]。临床试验登记号为NCT06062069的研究将评估超重和肥胖的成年T1DM 患者在接受CT - 868 治疗16 周后的血糖控制水平。国内江苏豪森的HS - 20094、福建盛迪的HRS - 9531 还有博瑞生物的BGM-0504都已进入Ⅱ期临床试验阶段。
Viking Therapeutics 公司的VK - 2735 是另一款GLP - 1R/GIPR 双靶点肠促胰岛素受体激动剂。其除具有良好的降糖效果外,还对各种脂肪肝具有潜在的治疗作用。Ⅰ期临床试验的受试者报告肝脏脂肪量经安慰剂调整后较基线减少47%(P<0.01)。在患有非酒精性脂肪性肝病(NAFLD)的受试者中,安慰剂调整后的肝脏脂肪减少约59%(P<0.01)[28]。
2.3 GLP-1R/GCGR 双靶点激动剂
GCG 是一种由胰岛α 细胞在低水平血糖时分泌的含29 个氨基酸的肽,可通过刺激糖原分解和糖异生来提高血糖浓度,从而改善低血糖状态。GLP-1R/GCGR双靶点激动作用的疗效已经内源性胰高血糖素原衍生物催产素调节素(OXM)得到证实[29]。
Survodutide 属新型皮下注射GLP - 1R/ GCGR 双靶点激动剂,用于治疗T2DM、肥胖症和NASH。通过在酰化肽中加入C18脂肪酸延长半衰期,根据剂量的不同达到每周或每半个月给药1次的频率。Ⅱ期临床试验结果显示,每周1 次Survodutide ≥1.8 mg 给药比司美格鲁肽减轻体质量效果更好,而降糖效果和司美格鲁肽相似[30]。
玛仕度肽是国内信达生物和礼来一起研发的一款GLP-1R/GCGR 双靶点激动剂。玛仕度肽的Ⅱ期临床试验结果显示,经过48周治疗,玛仕度肽9 mg较安慰剂体质量降幅达18.6%,在基线肝脏脂肪含量超过5%的受试者中,24 周后肝脏脂肪含量较基线平均下降73.3%,表现出良好的肝脏受益[31]。
GCGR 的凝血作用被认为可抵消GLP-1R 的激动作用,从而对GLP - 1R 和GCGR 双靶点激动剂的发展构成挑战。Cotadutide 和Bamadutide 是由阿斯利康和赛诺菲于2015年开始研发的2 种开创性的每日1 次GLP-1R/GCGR双靶点激动剂,但其降糖作用与1.8 mg利拉鲁肽相当[32-33],之后2家公司调整管线,均宣布退出这两款药物的继续研发。更有甚者,可能是由于过度刺激GCGR,在血糖参数甚至葡萄糖耐受不良方面未显示出任何益处[34],但企业已将其适应证转向其他领域,如NASH[35]或减重,如接受2.4 mg 剂量Pemvidutide 的患者中,超过50%的体质量至少减轻了15%,超过30%的体质量至少减轻了20%,但其空腹血糖或HbA1C无显著变化[36]。
2.4 GLP-1R/GLP-2R 双靶点激动剂
GLP - 2 主要刺激绒毛生长,并增强跨上皮吸收。单分子GLP - 1R 和GLP - 2R 联合刺激的概念已被证明在糖尿病模型中延长了半衰期,有利于GLP-1 介导的效应[37]。Dapiglutide是一种长效GLP-1R/GLP-2R双靶点激动剂,血浆半衰期约为120 h。一项临床试验登记号为NCT05788601 的Ⅱ期临床试验将评估其每周皮下给药1次的减重能力。
2.5 GIPR 拮抗剂/GLP-1RA
尽管GIPR/GLP-1R 双靶点激动剂协同作用能增加能量消耗,并降低血糖,但大量数据表明GIPR 双敲除小鼠对饮食诱导的肥胖具有抵抗作用[38]。GIPR 拮抗剂/ GLP - 1RA 显著降低肥胖小鼠和猴子的体质量和脂肪组织质量[39]。对全基因组关联研究(GWAS)的分析已确定在人类GIPR 位点活性降低的变异,这些变异可导致体质量下降[40]。一种人源化的GIPR 拮抗剂/GLP-1RA 抗体多肽偶联药物Maridebart cafraglutide 就是基于此设计的,其Ⅰ期临床试验的多次递增剂量(MAD)队列研究结果显示,与基线相比,经过85 d 的治疗后,接受低剂量和高剂量(140 mg和420 mg,均每4周皮下注射给药1 次)的两组受试者,体质量平均下降了7.2%和14.5%[41]。
2.6 GLP-1R/胰淀素3 受体(AMY3R)双靶点激动剂
胰淀素(AMY)与胰岛β 细胞共表达胰岛素,对胃排空和食物摄取有重要影响。胰淀素类似物也能促进饱腹感,并致使超重患者体质量显著下降,当与其他促进体质量减轻的药物,如GLP-1RA 合用时,在高脂饮食喂养的大鼠模型中引起明显的体质量减轻[42]。AMY是由诺和诺德研发的一种重组激素,是一种AMY3RA和GLP- 1RA,目前已进入Ⅱ期临床试验,用于治疗肥胖症和超重的研究。
2.7 GLP-1R/成纤维细胞生长因子21 受体(FGF-21R)双靶点激动剂
有研究指出,GLP - 1RA 可激活恒定自然杀伤T(iNKT)细胞,进而激活诱导FGF21 的产生和白色脂肪的产热褐变,有助于减肥[43]。通过慢病毒颗粒转导的过表达FGF21 和GLP-1 的间充质干细胞,可改善脂质代谢,同时降低T2DM 模型小鼠的血糖水平[44]。基于此研发的HEC - 88473 是一种GLP - 1/ FGF - 21R 双靶点融合蛋白,已进入Ⅱ期临床试验。
2.8 GIPR/GLP-1R/GCGR 三靶点激动剂
瑞他鲁肽针对GLP - 1R,GIPR,GCGR 3 个靶点,2023年6月,礼来公司宣布了针对肥胖适应证的瑞他鲁肽Ⅱ期临床试验数据。在24 周时,瑞他鲁肽达到了肥胖或超重(无糖尿病)参与者疗效评估的主要终点,受试者体质量下降了17.5%。瑞他鲁肽12 mg 每周1 次皮下注射治疗36 周后,HbA1C下降了2.16%,瑞他鲁肽4 mg 的降糖疗效与度拉鲁肽1.5 mg 相当[45]。对比T2DM 的治疗,瑞他鲁肽在减重适应证方面的表现更好,可能原因是GCGR 的凝血作用抵消了GLP - 1R 的部分激动作用。
2.9 GLP-1R/GCGR/FGF-21R 三靶点激动剂
临床试验登记号为NCT05378893 的MAD 研究评估了GLP-1R/GCGR/FGF-21R 三靶点激动剂DR-10624 在患有中度高甘油三酯血症的成年肥胖受试者中的安全性、耐受性、药物代谢动力学和药物效应动力学。
3 除糖尿病外的其他适应证
除糖尿病的治疗外,GLP - 1RA 还有其他适应证,如之前提到的超重和肥胖症、NASH 等。有很多适应证已进入了Ⅳ期临床试验,一些上市的GLP-1RA得到了注册申请,如2021年6月,商品名为Wegovy的司美格鲁肽注射剂被FDA批准用于超重和肥胖症的治疗。
搜索美国临床试验官网(https://clinicaltrials.gov/)中已上市的几款GLP - 1 靶点药物的Ⅳ期临床试验数据,收集到139条已完成、结果评价非消极的临床试验。上市药物有8种,分别是利拉鲁肽、艾塞那肽、司美格鲁肽、度拉糖肽、利司那肽、阿比鲁肽、贝那鲁肽、聚乙二醇洛塞那肽。其适应证以治疗糖尿病和减重的为主。其余较多的还有心血管疾病、多囊卵巢综合征(PCOS)、NASH、慢性肾脏病(CKD)等。详见图2(COPD 为慢性阻塞性肺疾病)。

图2 上市的GLP-1药物Ⅳ期临床试验分类(按适应证)Fig.2 Phase Ⅳclinical trials of GLP - 1 drugs on the market(by indications)
除T2DM 外,超重和肥胖症适应证的临床试验和申报也非常多。如前所述,许多GLP - 1 药物的降糖作用一般但减重作用良好,开发超重适应证将有利于老药新用。有报道详述了GLP - 1 与肥胖症的生理学机制,也讨论了2 种用于治疗肥胖的GLP - 1RA 的临床数据[46]。
GLP-1RA 对心血管疾病的影响已有报道,包括总结GLP - 1RA 的机制及其在T2DM 患者中的心血管结局试验(CVOT)数据,以及GLP-1RA 对心脏和血管的保护作用[47]。最新发表的SELECT试验研究了司美格鲁肽对超重或肥胖者心血管结局的影响,在17 604 例体质量指数(BMI)≥27 kg/m2且既往患有心血管疾病但无糖尿病的患者中,每周1次皮下注射2.4 mg司美格鲁肽,平均持续治疗33 个月,可将心血管原因、非致死性心肌梗死或非致死性卒中导致的复合死亡风险降低20%[48]。
PCOS 是女性常见的内分泌疾病,通常与代谢紊乱疾病有关。其定义基于排除其他病理(如先天性肾上腺皮质增生症、甲状腺异常和高催乳素血症)后符合3 个标准中的2个,产生机制不明,但是一些GLP-1药物可以减轻其标志性特征,如替尔泊肽[49]。
对于NASH,GLP-1RA 可间接减轻对肝脏炎症和纤维化程度,如通过减少能量供应和/或改善肝细胞代谢[50]。一项研究对随机对照试验(RCT)进行了系统评价和荟萃分析,测试了利拉鲁肽、艾塞那肽、度拉糖肽和司美格鲁肽特异性治疗NASH 的有效性和安全性,得出了利拉鲁肽和司美格鲁肽更有利于NASH 治疗的结论[51]。GLP-1R/GCGR 双靶点激动剂治疗NASH 的疗效可能更优于单靶点GLP-1RA,如临床试验登记号为NCT04944992 的结果显示,Efinopegdutide 20 mg/mL 多数指标均优于司美格鲁肽1.34 mg/mL。其24周后的肝脏脂肪含量较基线平均降低72.7%,这一结果和之前提到的GLP-1R/GCGR 双靶点激动剂玛仕度肽相当,均优于司美格鲁肽的42.3%。
CKD 常由糖尿病引起。糖尿病伴慢性肾病(糖尿病肾病,DKD)是一种进行性疾病,可能导致肾衰竭,并升高死亡率。DKD/ CKD 与心血管死亡率和发病率间关系密切,CVOT 的累积证据证实了T2DM 和CKD 患者的肾脏保护意义,1 篇综述回顾了部分GLP-1RA 已完成的和正在进行的临床试验的肾脏结果及真实世界证据[52]。而对CKD参与者进行专门、有适当把握度的肾脏结局试验证实了GLP - 1RA 对T2DM 和高心血管风险患者具有潜在的肾脏保护作用,诺和诺德于2023年10月宣布,在其代号为FLOW 的临床试验中,司美格鲁肽用于治疗CKD 和合并肾功能不全的T2DM,由于疗效优异而提前终止[53]。
GLP-1RA 通过协同改善与阿尔茨海默病(AD)相关的各种病理表现,在其治疗中发挥治疗作用。1 篇系统评价和荟萃分析发现,GLP-1RA 可显著提高AD 模型动物的学习和记忆能力,减少Aβ 的沉积和tau 蛋白在大脑中的过度磷酸化[54]。临床试验登记号为NCT04777396,简称为EVOKE 的Ⅲ期临床试验正在进行,以研究司美格鲁肽是否对早期AD有积极作用。
帕金森病(PD)是另一种常见的神经退行性疾病,GLP-1RA 治疗PD 的潜在机制类似于外周胰岛素抵抗的过程,可能会引发或加重PD 的神经退行性病变,而GLP-1RA 可有效降低胰岛素抵抗[55]。目前,临床试验登记号为NCT04232969 的Ⅲ期临床试验正在进行,旨在确认艾塞那肽的神经保护作用,并观察这种作用是否能在包括更多参与者的多中心环境中复制。
4 研发新趋势
在停用每周1次皮下注射司美格鲁肽和生活方式干预1年后,受试者恢复了之前减轻的体质量的2/3[56]。虽然研发长效和口服药物将有利于患者的依从性,但是,若能一劳永逸地享受到糖尿病治疗新技术带来的便利,在保证疗效和安全性的情况下,相信很多患者会选择该类治疗方式。而重组腺相关病毒载体(AAV)就可达到一次注射终身无需再次服用相关药物的效果。临床已有多款基于AAV 的药物被批准[57],将可以持续产生GLP-1 激素的基因携带到胰腺细胞将是GLP-1药物研发的新趋势。
最新研究显示,在T2DM 小鼠模型中,实验组进行单次基因治疗输注,每周向对照组注射司美格鲁肽。实验组小鼠10 周后空腹血糖降低了70%,略高于对照组的64%[58]。该公司计划于2024年进行首次临床试验,这将是GLP-1治疗的新方向。
5 展望
安全性问题:包括胰腺炎在内的胃肠道反应是GLP-1RA 的常见不良反应,为了更好地减小胃肠道反应[59],应设计多个临床递增给药剂量、减少给药频率,还应针对不同人群开发合理的给药剂量和剂型方案,针对细分患者群个体化推荐GLP-1 类似药。如在司美格鲁肽的开发中,设计了多组的临床试验,在司美格鲁肽代号为PIONEER 的系列临床研究中,基于之前PIONEER 1 至PIONEER8 并无单独研究亚洲人群的原因,PIONEER 9 研究了日本患者口服不同剂量司美格鲁肽(3 mg、7 mg 或14 mg)与安慰剂和皮下注射0.9 mg GLP-1RA利拉鲁肽的疗效和安全性[60]。同样,PIONEER 10研究评估口服不同剂量司美格鲁肽(3 mg、7 mg或14 mg)和皮下注射0.75 mg 度拉糖肽在日本T2DM 患者中的安全性和有效性[61]。2023年9月,诺和诺德分别完成了中国多地区临床试验登记号为NCT04109547 的PIONEER 11和登记号为NCT04017832的PIONEER 12。
依从性问题:结合多种延长半衰期的方式,GLP -1RA已在该领域取得了显著进展。如像Survodutide这样需每2 周皮下给药1 次的药物,以及Maridebart caraglutide 这种每月给药的抗体多肽偶联药物,由于它们显著延长了给药时间,从而极大地提升了患者的依从性。此外,口服制剂的开发代表了在改善患者依从性方面的重大进展,并减少了潜在的不良反应。现阶段GLP -1RA 仍面临患者依从性低、生产能力有限、成本高等挑战。因此,小分子GLP-1RA 的研发成为该领域未来的研究方向。目前有2 款GLP-1RA 小分子药物在临床研究中,分别为礼来的Orforglipron和辉瑞的Danuglipron。
经济性问题:目前大多数GLP-1 药物为合成多肽或重组多肽,技术壁垒和培养条件限制了其商业化进程,即使定价高昂,部分GLP - 1 药物如司美格鲁肽尚处于供不应求状态。而停药反弹现象则变相加剧了这一经济支出,使得研究转向另外的“赛道”,如利用AAV一劳永逸地产生GLP-1,从而发挥治疗作用。随着越来越多的疗效优于单靶点的双靶点和多靶点GLP- 1RA的研发,药物多适应证的申报也将有助于减少企业研发新药的成本,达到老药新用的效果。

