高糖环境下药桑提取物脱氧野尻霉素对MC3T3-E1细胞的影响
张文杰, 冯 凯, 陈意磊, 吴泽钰,2, 努尔比亚木·麦麦提依明,2,赵 今,2
(1新疆医科大学第一附属医院(附属口腔医院)牙体牙髓病科; 2新疆维吾尔自治区口腔医学研究所, 乌鲁木齐 830054)
1 材料和方法
1.1 材料小鼠成骨前体细胞株MC3T3-E1(武汉普诺赛生物生命科技有限公司,批号:CL-0378);脱氧野尻霉素(上海源叶有限公司, 批号: F01F12R138956); α-MEM完全培养基(美国Gibco公司,批号:8122235);茜素红染色液(美国Cyagen公司,批号:T230914C301);碱性磷酸酶显色试剂盒(碧云天生物科技有限公司,批号:062523230921),碱性磷酸酶检测试剂盒(碧云天生物科技有限公司, 批号:04321211115);细胞凋亡检测试剂盒(碧云天生物科技有限公司, 批号:061923231229);活性氧检测试剂盒(碧云天生物科技有限公司, 批号:05112320814),Trizol RNA分离试剂(美国Invitrogen有限公司,批号:343911);Takara逆转录试剂盒(美国Takara生物技术有限公司,批号:ALG2080A);荧光实时定量试剂盒(美国Takara生物技术有限公司,批号:AM11194A);WH-25恒温细胞培养箱(赛默飞生物科技有限公司);BS124S电子天平(Thermo生物科技有限公司);1510全波长酶标仪(赛默飞世尔仪器有限公司);DMI4000B倒置显微镜(上海国际贸易有限公司),TC-96基因扩增仪(杭州博日科技有限公);Quant StudioTM1 PluS实时荧光定量PCR仪(赛默飞世尔仪器有限公司);YC-1015L医用冷藏冰箱(赛默飞生物科技有限公司)。
1.2 方法
1.2.1 细胞培养 将冻存的MC3T3-E1细胞于恒温水浴锅中快速解冻。吸取细胞悬液至完全培养基中,1 000 r/min离心5 min,弃去上清液,加入新的完全培养基重悬细胞,转移至细胞培养瓶中,于37℃恒温培养箱中继续培养。
1.2.2 药物的配置 高糖完全培养基的配置:称取适量葡萄糖,充分溶解于α-MEM完全培养基中,制备成500 mmol/L的母液,保存于-20℃冰箱保存备用,使用时按比例将其稀释成50 mmol/L。不同浓度DNJ溶液的配置:制备10 mmol/L的DNJ母液,在超净台中过滤灭菌后,保存于-80℃冰箱保存备用。
1.3 指标的测定
1.3.1 不同浓度DNJ溶液对MC3T3-E1细胞的增殖影响 取对数生长期的MC3T3-E1细胞分为:空白组(完全培养基),阴性对照组(含细胞的完全培养基),高糖组(含50 mmol/L葡萄糖的完全培养基),实验组[含50 mmol/L高糖培养基+不同浓度DNJ(10 mmol/L、1 mmol/L、100 μmol/L、10 μmol/L、1 μmol/L、100 nmol/L、10 nmol/L、1 nmol/L)溶液],每组设立6个平行孔,按每孔100 μL加入96孔板中,与P4代MC3T3-E1细胞共培养1、3、5、7 d,于每日同一时间按CCK-8试剂盒说明书方法检测OD值,计算细胞增殖率。细胞增殖率=(OD实验组-OD空白组)/(OD阴性对照组-OD空白组)×100%。
1.3.2 实验分组 根据“1.3.1”项下实验结果进行分组,空白组(完全培养基干预)、高糖组(50 mmol/L糖浓度的高糖培养基干预)、实验组[50 mmol/L糖浓度的高糖培养基+不同浓度DNJ(100、10、1 μmol/L)溶液]。
[7]田成有.解读“民族精神”——读《论立法与法学的当代使命》[A].许章润,主编.萨维尼与历史法学派[C].桂林:广西师范大学出版社,2004.
1.3.3 MC3T3-E1细胞凋亡率的测定 取P3代MC3T3-E1细胞按1×104个/mL传代至6 cm培养皿中培养,贴壁后,按“1.3.2”项下方法分组并干预细胞,每组设立3个平行孔,放入细胞培养箱中干预3 d,消化各组细胞,用旧培养基终止消化,转移至离心管中,按细胞凋亡检测试剂盒说明书操作测定各组细胞凋亡率。
1.3.4 MC3T3-E1细胞活性氧含量的测定 取P3代MC3T3-E1细胞按1×104个/mL传代至6 cm培养皿中培养,贴壁后,按“1.3.2”项下方法分组并干预细胞,每组设立3个平行孔,放入细胞培养箱中干预3 d,结束后吸取旧培养基至对应离心管中。使用无酚红胰酶消化细胞,用旧培养基终止消化,转移至原离心管中,按活性氧试剂盒说明书操作测定各组细胞活性氧含量。
1.3.5 不同浓度DNJ在高糖环境下对MC3T3-E1细胞炎症因子的影响 将P3代MC3T3-E1细胞按2×104个/孔传代至12孔板,每组设立3个平行孔。贴壁后,按“1.3.2”项下方法分组,干预细胞3 d后,吸取细胞上清液,1 500 r/min离心20 min,吸取上清液,于-20℃冰箱保存备用。按ELISA试剂盒说明书操作,测定细胞上清液中白细胞介素-6 (Interleukin 6, IL-6)、白细胞介素-1β(Interleukin 1, IL-1β)、肿瘤坏死因子-α(Tumor necrosis factor α,TNF-α)和AGEs的含量。
1.3.6 MC3T3-E1细胞碱性磷酸酶染色 取P3代MC3T3-E1细胞传代至12孔板中,待细胞长至80%时,按“1.3.2”项下方法分组,加入成骨诱导液干预细胞,每组3个平行孔,分别干预7 d和14 d后,弃去旧液,每孔加入1 mL通用型组织细胞固定液,固定30 min,按碱性磷酸酶染色试剂盒说明书操作,配制染色液,每孔加入1 mL染液,孵育30 min后于倒置显微镜下拍照。
1.3.7 MC3T3-E1细胞碱性磷酸酶活性测定 按“1.3.6”项下方法传代MC3T3-E1细胞,分别干预7 d和14 d后,每孔加入60 μL无抑制剂的细胞裂解液,裂解细胞,吸取细胞裂解液至EP管中,于-80℃冰箱保存备用。分别用碱性磷酸酶活性试剂盒及BCA蛋白定量试剂盒测定ALP含量和蛋白浓度,使用酶标仪检测其OD值,绘制标准曲线,计算ALP活性。
1.3.8 MC3T3-E1细胞茜素红染色 将P3代MC3T3-E1细胞分别接种于3.5 cm培养皿中,待长至80%时,按“1.3.2”项下方法分组,加入成骨诱导液干预细胞,每组3个副孔,分别干预14 d和21 d,隔天换液。干预结束后,每孔加入1 mL通用型组织细胞固定液进行固定,30 min后每孔加入1 mL的茜素红染液,对培养皿内的矿化结节在常温下染色30 min,洗净后于倒置显微镜下拍照。
1.3.9 MC3T3-E1细胞中矿化结节含量的测定 按“1.3.8”项下拍照结束后,每个小皿中分别加1 mL氯化十六烷基吡啶溶液,放置摇床摇晃30 min,后吹打至结节完全溶解,吸取溶解液至96孔板中,每孔100 μL, 设立3个平行孔, 酶标仪测定562 nm波长处OD值, 矿化结节的定量=OD实验组-OD氯化十六烷基吡啶溶液。
1.3.10 MC3T3-E1细胞内凋亡、炎症和成骨相关mRNA水平的测定 将P3代MC3T3-E1细胞接种于6孔板中,按“1.3.2”项下方法分组加入成骨诱导液干预细胞,每组3个平行孔,分别干预3 d和7 d,后弃去细胞上清液,采用Trizol法提取细胞RNA,按Takara试剂盒说明书进行逆转录和实时荧光定量,采用PCR仪检测IL-1β、IL-6、TNF-α、胰岛素样生长因子1(Insulin-Like Growth Factor 1, IGF-1)、凋亡调节因子BAX(Apoptosis regulator BAX, BAX)、凋亡调节因子Bcl-2(Apoptosis regulator Bcl-2, Bcl-2)、1型胶原蛋白(Collagen type 1, COl-1)、碱性磷酸酶(Alkaline phosphatase,ALP)、骨钙素(Osteocalcin,OCN)、Runt相关转录因子2(Runt-related transcription factor 2, Runx2)、成骨特异性转录因子OSX(Osterix,OSX)的mRNA表达,采用 2-ΔΔCT法进行相对定量分析。
1.4 统计学处理采用SPSS 26.0和Graphpad统计学软件进行数据分析,若数据满足正态分布及方差齐性检验,采用单因素方差分析,组间比较采取LSD检验,方差不齐采用秩和检验,检验水准α=0.05。
2 结果
2.1 不同浓度DNJ对高糖环境下MC3T3-E1细胞增殖能力的影响与高糖组相比,当DNJ 100、10、1 μmol/L组细胞增殖能力增强,差异有统计学意义(P<0.05),故选择DNJ浓度100、10、1 μmol/L进行后续实验,见表1。
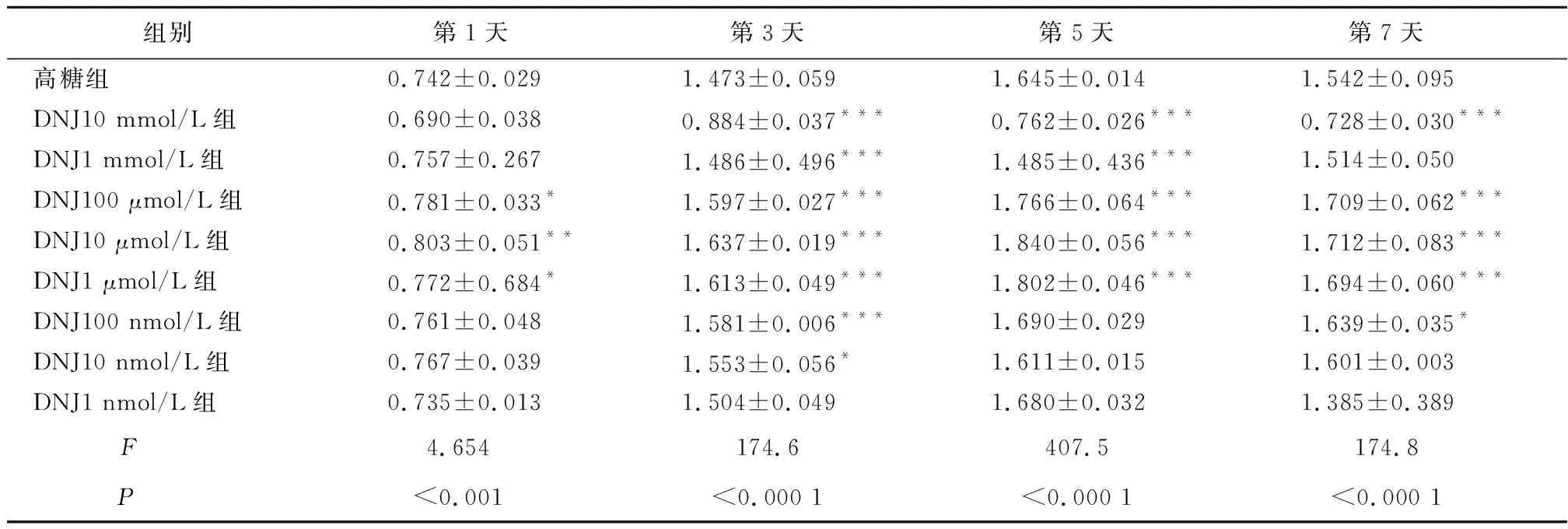
表1 不同浓度DNJ对高糖环境下MC3T3-E1细胞增殖能力的影响
2.2 高糖环境下DNJ对MC3T3-E1细胞凋亡的影响空白组和高糖组MC3T3-E1细胞凋亡率分别为(17.64±4.07)%和(70.77±0.38)%。实验组[高糖+不同浓度DNJ(100、10、1 μmol/L)溶液]的细胞凋亡率分别为(63.43±2.78)%、(35.53±3.15)%和(52.67±0.17)%。与空白组相比,高糖组细胞凋亡率增高,差异有统计学意义(P<0.01)。与高糖组相比,实验组细胞凋亡率降低,差异有统计学意义(P<0.05),见图1。
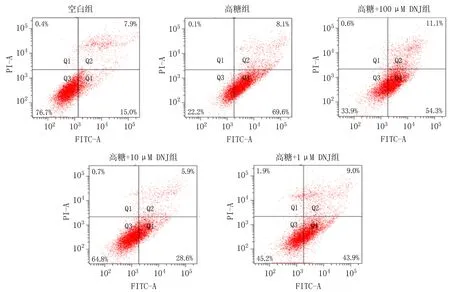
图1 各组MC3T3-E1细胞凋亡流式检测图
2.3 高糖环境下不同浓度DNJ对MC3T3-E1细胞内活性氧含量的影响空白组和高糖组MC3T3-E1细胞内活性氧含量分别为(50.87±0.17)%和(77.03±6.53)%。实验组[高糖+不同浓度DNJ(100、 10、1 μmol/L)溶液]细胞内活性氧含量分别为(57.35±0.69)%、(29.53±1.79)%和(36.70±2.33)%。与空白组相比,高糖组细胞内活性氧含量升高,差异有统计学意义(P<0.05)。与高糖组相比,实验组细胞内活性氧含量降低,差异有统计学意义(P<0.05),见图2。
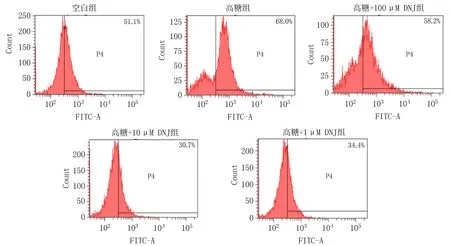
图2 各组MC3T3-E1细胞活性氧含量检测图
2.4 高糖环境下DNJ对MC3T3-E1细胞内炎症因子含量的影响与空白组相比,高糖组细胞上清液中IL-6、IL-1β、TNF-α和AGEs含量升高,差异有统计学意义(P<0.05)。与高糖组相比,实验组[高糖+不同浓度DNJ(100、10、1 μmol/L)溶液]细胞上清液中IL-6、IL-1β、TNF-α和AGEs含量降低,差异有统计学意义(P<0.05),见表2。

表2 高糖环境下DNJ对MC3T3-E1细胞上清液中炎症因子含量的影响
2.5 DNJ在高糖环境下对MC3T3-E1细胞ALP表达的影响与空白组相比,高糖组ALP表达降低,差异有统计学意义(P<0.01)。与高糖组相比,实验组ALP表达升高,差异有统计学意义(P<0.05),见图3、4。
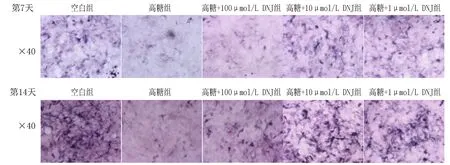
图3 第7、14天各组MC3T3-E1细胞碱性磷酸酶染色图
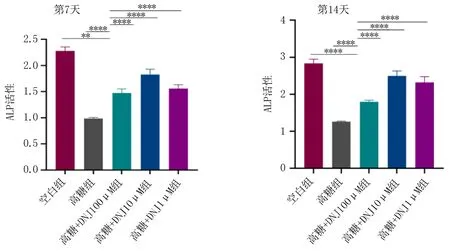
注:与高糖组相比, **P<0.01, ****P<0.0001。
2.6 高糖环境下DNJ对MC3T3-E1细胞矿化结节形成的影响与空白组相比,高糖组形成的矿化结节减少,差异有统计学意义(P<0.01)。与高糖组相比,实验组形成的矿化结节增多,差异有统计学意义(P<0.05),见图5、6。

图5 第14、21天各组MC3T3-E1细胞茜素红染色图
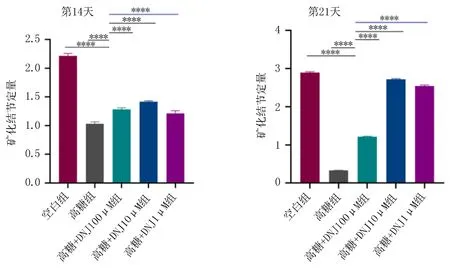
注: 与高糖组相比, ****P<0.000 1。
2.7 高糖环境下DNJ对MC3T3-E1细胞凋亡相关mRNA的影响与空白组相比,高糖组Bax表达增大,Bcl-2表达减小,差异有统计学意义(P<0.05)。与高糖组相比,实验组Bax表达减小,Bcl-2表达增大,差异有统计学意义(P<0.05),见表3。

表3 高糖环境下DNJ对MC3T3-E1细胞凋亡相关mRNA的影响
2.8 高糖环境下DNJ对MC3T3-E1细胞炎症相关mRNA的影响与空白组相比,高糖组IL-1β、IL-6和TNF-α表达增大,差异有统计学意义(P<0.05)。与高糖组相比, 实验组IL-1β、 IL-6和TNF-α的表达减小, 差异有统计学意义(P<0.05),见图7。
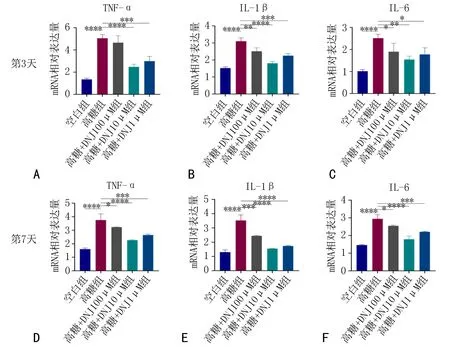
注: 与高糖组相比, *P<0.05, **P<0.01, ***P<0.001, ****P<0.000 1。
2.9 DNJ对高糖环境下MC3T3-E1细胞成骨相关mRNA表达的影响与空白组相比,高糖组Runx2、ALP、OCN和IGF-1等成骨相关mRNA表达下调。与高糖组相比,实验组成骨相关mRNA的表达上调, 差异有统计学意义(P<0.05), 见图8、9。

注: 与高糖组相比, *P<0.05, **P<0.01, ***P<0.001, ****P<0.000 1。

注: 与高糖组相比,*P<0.05, **P<0.01, ***P<0.001, ****P<0.000 1。
3 讨论
糖尿病主要通过炎症反应、氧化应激、骨代谢紊乱和AGEs积累这4种途径影响牙周炎[10-11]。本研究发现,高糖环境会导致MC3T3-E1细胞发生凋亡,上调促凋基因Bax和下调抑凋基因Bcl-2的表达,与文献[12-13]的研究结果一致。说明DNJ可以通过升高Bcl-2/Bax的比值,抑制因高糖刺激引起的细胞凋亡。活性氧在介导机体内的氧化应激,调控转录因子和凋亡等活动中发挥着关键作用。本研究发现高糖环境会导致活性氧的大量产生, 与Li等[14]的研究结果一致。若活性氧无法及时清除会产生氧化应激,被认为是导致细胞损伤、凋亡和骨代谢紊乱的主要原因[15]。本研究发现一定浓度范围内的DNJ可以抑制高糖环境下细胞内活性氧的产生,说明DNJ具有良好的抗氧化效果。
活性氧与AGEs的产生密切相关,大量活性氧堆积在牙周组织中会加剧牙周组织的破坏,促进细胞的凋亡,炎症和氧化应激等[16-17],并诱发IL-1β、TNF-α和IL-6等炎症介质的分泌增多,导致牙槽骨快速丧失,继而影响相关成骨指标的表达[18]。IL-6在骨的重塑和改建中发挥着重要的作用,促进骨质的破坏[19]。TNF-α和IL-1β参与多种炎性疾病,通过抑制骨细胞的成骨分化从而导致骨密度降低和骨质吸收[20]。本研究发现高糖环境可以增加MC3T3-E1细胞上清液中AGEs、IL-1β、TNF-α和IL-6的含量,上调IL-1β、TNF-α和IL-6的表达,与欧玉琼[21]的研究结果一致。加入DNJ后可以抑制因高糖刺激引起的炎症反应,降低AGEs含量,说明DNJ具有良好的抗炎效果。
研究表明,AGEs是糖尿病导致骨质疏松并发症的机制之一[22]。本研究采用碱性磷酸酶染色、ALP活性、茜素红和PCR检测高糖环境下成骨细胞的成骨能力,结果表明高糖环境会抑制成骨细胞的分化,与SUN等[23]的研究结果一致。加入DNJ干预后可以促进高糖环境下成骨细胞的分化能力,说明DNJ在一定浓度范围内可以缓解高糖环境下成骨细胞分化能力的减弱。
综上所述,DNJ在一定浓度范围内能够缓解因高糖刺激引起的细胞损伤凋亡、氧化应激和炎症反应,促进高糖环境下MC3T3-E1细胞的成骨分化,为DNJ用于糖尿病牙周炎的防治提供理论依据。

