槲皮素联合山柰酚抑制TNF信号通路保护大鼠背根神经节细胞免受高糖损伤
卯明艳,余炫颉,张丽君
(1.六盘水职业技术学院,贵州 六盘水 553000;2.湖北科技学院医学部药学院;3.咸宁市中心医院介入科;4.湖北科技学院医学部基础学院,湖北 咸宁 437100)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病(Diabetes Mellitus,DM)最常见和最严重的并发症之一[1],最终将影响近50%的成年DM患者,并与疼痛、足部溃疡和下肢截肢的发病率有关[2]。DPN对神经元和神经胶质细胞等周围神经系统组织造成损害[3]。尤其是背根神经节(dorsal root ganglia,DRG)神经元位于血脑屏障之外,并暴露于高血糖应激源中,它们更容易受到伤害[4]。研究表明,DRG的一些分子和形态学变化(如细胞应激和凋亡)与DPN的发生和进展息息相关[5],并且高糖(high glucose,HG)诱导DRG神经元凋亡是一种常见的DPN形态学损伤[6]。文献研究发现,HG诱导DRG神经元凋亡涉及到多个病理过程,主要包括应激反应、炎症反应、多元醇途径、ROS积累和AGE的产生。同时,多条信号通路也参与其中,包括PI3K/AKT/mTOR、NF-κB、Nrf2/HO-1/ARE和AMPK/PGC-1α。死亡受体通路(TNF信号通路)是介导凋亡的三大信号通路之一[7],但是该通路在HG诱导DRG神经元凋亡过程中研究尚不充足。
DPN不仅对个人的生活质量和经济造成极大影响,同时也成为了社会的经济负担,可有效的治疗方法尚在积极探索中。目前以有效控制血糖、定期足部检查和积极管理疼痛的形式进行筛查和治疗,达到延缓疾病发展进程[2]。近年来研究发现天然产物及其代谢物对DPN有较好的治疗作用,有望成为DPN新的治疗选择方向[8]。其中,槲皮素(Quercetin,Que)和山柰酚(Kaempferol,Kae)是黄酮家族的重要成员,广泛存在于各类饮食中,如水果,蔬菜,红酒等等,作为膳食补充剂,在增强免疫系统和促进健康生活中发挥重要作用[9]。Que的抗氧化、抗炎和免疫调节等生物功能使其成为病理机制涉及氧化应激、炎症和免疫的不健康状况的潜在候选者[10],并且在DM及其并发症中具有较好的治疗效果[11]。岳等人[12]和张等人[13]的研究表明Que的神经保护作用与激活Nrf-2/HO-1和AMPK/PGC-1α通路,抑制NF-κB通路,以及保护线粒体,防止其被损伤有关。Kae具有广泛的药理活性,包括抗氧化、抗炎、抗DM病和神经保护作用[14]。在一项研究中,Kae可降低氧化应激,减弱H2O2-和aβ诱导的细胞凋亡,对PC12细胞和初级皮质神经元起到保护作用[15]。虽然Que和Kae在DM及其并发症中都呈现出有益的治疗潜力,但对二者的协同作用研究尚不充分。前期借助网络药理学方法对二者协同防治DPN的作用机制进行了研究,结果发现Que和Kae的防治作用与调节炎症反应、氧化应激和细胞凋亡等病理过程和激活或抑制胰腺癌相关通路、AGE-RAGE和TNF等信号通路有关[16]。因此,本研究在细胞水平研究Que联合Kae通过抑制细胞死亡受体通路保护大鼠DRG细胞免受HG损伤,明确Que和Kae的协同作用,为DPN的防治提供研究基础和依据。
1 材料与方法
1.1 细胞培养大鼠DRG细胞购自北纳生物,标准条件(37 ℃、21% O2和5% CO2)下,用DMEM(葡萄糖浓度为25 mM)完全培养基培养细胞。DMEM完全培养基由89% DMEM基础培养基+10%胎牛血清+1%双抗配置而成,4 ℃环境中保存备用。细胞复苏后接种于培养皿中进行培养,每24 h更换一次培养液。细胞密度达到80%左右时,使用0.25% (w/v)胰蛋白酶溶液消化细胞进行传代。
1.2 DPN体外模型取对数期DRG细胞铺板,置于标准条件的培养箱中培养。将细胞分为以下几组:对照组仅在完全DMEM培养基中培养;HG组为额外加入20%的无菌D-(+)-葡萄糖溶液,使完全培养基中葡萄糖浓度达到35 mM、45 mM、55 mM、65 mM、75 mM、85 mM、95 mM、105 mM。处理条件是细胞铺板后立给予HG,处理24 h后进行CCK8检测,确定HG诱导DRG细胞损伤的DPN体外模型。
1.3 药物处理取对数期DRG细胞铺板,Que处理的细胞分为以下几个组:Con、HG组、HG+Que组(5 μM、10 μM、20 μM、40 μM、60 μM、80 μM和100 μM)。Kae处理的细胞分为Con、HG组、HG+Kae组(1 μM、2.5 μM、5 μM、10 μM、20 μM、30 μM和40 μM)。Que+Kae处理组的细胞分为Con、HG组、HG +Kae +Que组(2.5 μM+5 μM、2.5 μM+10 μM、2.5 μM+20 μM、5 μM+5 μM、5 μM+10 μM、5 μM+20 μM、10 μM+5 μM、10 μM+10 μM、10 μM+20 μM)。均置于标准条件的培养箱中培养24 h。借助CCK8试剂盒检测细胞活力,首先确定Que和Kae的最佳给药浓度,再将对细胞活力有促进作用的单药浓度进行交叉实验,最终明确组合药的最优浓度。
1.4 细胞活力Cell Counting Kit-8(简称CCK-8)试剂可用于简便而准确的细胞增殖和毒性分析。按照DPN体外模型和药物处理条件,清除培养液后每孔加1/10体积CCK8,继续培养1 h,利用酶联免疫监测仪读取波长为450 nm处的各孔光吸收值,通过OriginPro.2019b.Win软件计算并绘制细胞增殖曲线图,确定HG、单药及组合药最佳给药浓度,用于后续实验。
1.5 细胞内ROS水平检测DRG细胞6孔板铺板,每孔3×105/mL,分为6组,即Con组、Rosup组、HG组、HG+Que组、HG+Kae组和HG+Que+Kae组。细胞培养24 h后,首先准备ROS探针,用无血清培养液稀释H2DCFDA,比列是1∶1 000,使其工作浓度为10 μM。其次装载探针,去除陈旧培养基,无菌PBS溶液清洗2次,6孔板中每孔加入2 mL稀释好的H2DCFDA工作液,完全覆盖细胞,然后放置于37℃细胞培养箱内继续避光孵育30 min。再清洗细胞,无菌PBS溶液清洗细胞2次,彻底去除没有进入细胞内的H2DCFDA。最后荧光显微镜照相:将细胞置于显微镜下,通过FITC滤光片观察荧光。根据绿色荧光强弱判断细胞内活性氧水平。
1.6 免疫荧光检测细胞凋亡量DRG细胞6孔板铺板,每孔3×105/mL,分为5组,即Con组、HG组、HG+Que组、HG+Kae组和HG+Que+Kae组,24 h后将其从培养箱取出,沿壁去除陈旧培养基,再用无菌PBS润洗2次,然后每皿加入1 mL的染色工作液,并在每皿中分别加入5 μL Hoechst染色液和5 μL PI染色液,轻轻摇动培养皿,使液体分散均匀,完全覆盖皿底,至于4 ℃环境中孵育20~30 min,最后染色结束后,再沿壁去除染色液,无菌PBS溶液洗涤2次,放在荧光显微镜下观察并拍照。
1.7 蛋白质印迹分析蛋白表达水平DRG细胞6孔板铺板,每孔3×105/mL,分为5组,即Con组、HG组、HG+Que组、HG+Kae组和HG+Que+Kae组,24 h后将其从培养箱取出并去除陈旧完全培养基,无菌PBS清洗2次,至于冰上加入裂解液进行细胞裂解,4 ℃,12 000 r离心后提取上清液,进行蛋白定量及处理。使用10%雅酶PAGE凝胶进行电泳,电压为150 V,待标记物跑到底部停止电泳。250 mA转模100 min,雅酶无蛋白快速封闭液封闭15 min,TBST洗膜3次,每次10 min。加入一抗稀释液FADD(单抗,1∶1 000)、Caspase-3(单抗,1∶1 000)、Caspase-8(单抗,1∶1 000)、TNFR1(多抗,1∶1 000)、内参β-Actin(1∶2 000),4 ℃摇床过夜。次日回收一抗,TBST洗膜,常温孵育二抗(1∶15 000)1 h。最后TBST洗膜、显影,运用Image J对图像进行灰度值分析计算蛋白表达量。
1.8 统计分析使用SPSS 26.0软件完成统计分析。所有数据均表示为至少三个独立实验结果的“均数±标准差”。多组间统计分析采用单因素方差分析。P<0.05的值被认为具有统计学意义。
2 结果
2.1 CCK-8实验结果
2.1.1 DPN体外模型的建立 根据DRG细胞活力结果发现,与对照组相比,培养基中的葡萄糖浓度达到45 mM时,细胞活力呈浓度依赖形式逐渐降低,差异有统计学意义(P<0.05)。当葡萄糖浓度达到85 mM时对DRG的活力影响比较明显,细胞活力下降至62%左右,如图1所示。因此,后续实验均采用HG浓度为85 mM,作用24 h为DPN体外模型的建模条件。

图1 HG对DRG细胞活力的影响
2.1.2 Que给药浓度的确定 将不同浓度的Que作用于HG环境中的DRG细胞,经CCK-8检测发现,在HG环境中,Que对DRG细胞有一定的保护作用,可以增强细胞活力,由图2可知,随着Que浓度的升高,DRG细胞活力逐渐上升,当Que浓度达到20 μM时,促进细胞增殖作用最明显,差异具有统计学意义(P<0.05),当Que浓度达到80 μM时,DRG细胞活力反而呈下降趋势,并且随浓度的增高,细胞活力呈下降趋势,因此将20 μM作为Que给药最佳浓度。
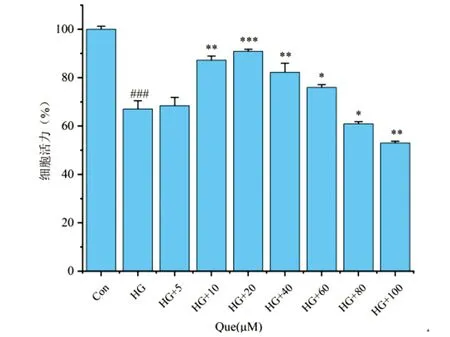
图2 不同浓度Que对HG环境中DRG的影响
2.1.3 Kae给药浓度的确定 将不同浓度的Kae作用于HG环境中的DRG细胞,经CCK-8检测发现,在HG环境中,Kae对DRG细胞有一定的保护作用,可以增强细胞活力,由图3可知,随着Kae浓度的升高,DRG细胞活力逐渐上升,当Kae浓度达到2.5 μM、5 μM和10 μM时,均有促进细胞增殖作用,差异具有统计学意义(P<0.05),当浓度达到5 μM时促进作用最明显。当Kae浓度达到20 μM及以后,DRG细胞活力反而呈下降趋势,遵循最小用药原则,将Kae的给药浓度被确定为5 μM。
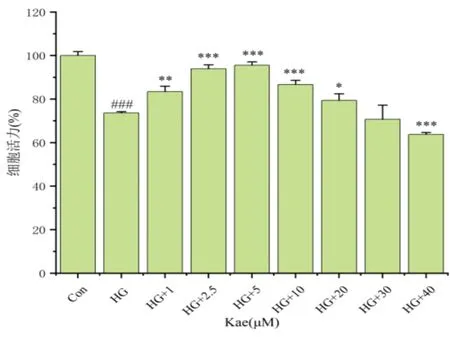
图3 不同浓度Kae对HG环境中DRG的影响
2.1.4 Que+Kae给药浓度的确定 结合Que和Kae单独给药对HG环境中DRG的保护作用,本实验中将10 μM、20 μM和40 μM浓度的Que和2.5 μM、5 μM和10 μM浓度的Kae随机组合,筛选最佳的组合浓度,突破一贯式的单药最优浓度叠加的模式。结果发现,Kae浓度不变时,随着Que浓度的增加,细胞活力上升后又呈下降趋势,详见图4,由图可知,当Kae和Que浓度分别达到5 μM和10 μM时,对HG环境中的DRG细胞活力具有最明显的促进作用,差异具有统计学意义(P<0.05)。并且组合药的促进作用强于单药的促进作用,差异也有统计学意义(P<0.05)。因此推断10 μM浓度的Que和5 μM浓度的Kae是最佳的组合浓度,将用于后续实验。
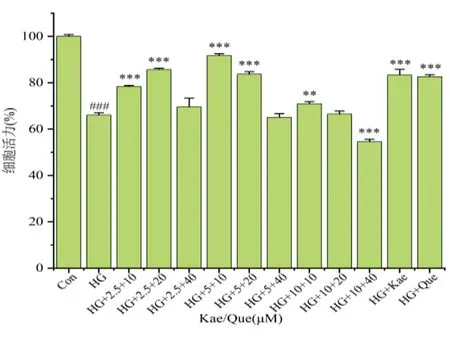
图4 不同浓度Que和Kae组合后对HG环境中DRG的影响
2.2 Que+Kae对HG环境中DRG细胞内ROS的影响通过ROS Assay Kit试剂盒的荧光探针DCFH-DA检测DRG细胞内ROS水平,由图5可以看出,HG组的绿色荧光明显多于Con组,说明DRG细胞内ROS水平高于Con组细胞内的ROS水平。与HG组相比,Que、Kae和Que+Kae组的绿色荧光均减少,Que+Kae组的荧光最少,说明单药或组合药均能降低HG环境中的DRG细胞内ROS的水平,其中组合药的作用强于单药作用。
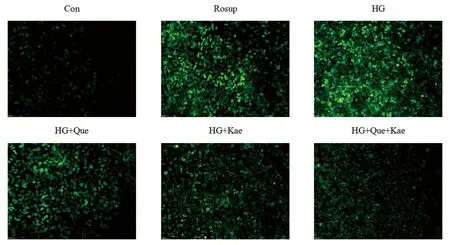
图5 Que+Kae对HG环境中DRG细胞内ROS的影响
2.3 Que+Kae对HG环境中DRG细胞凋亡的影响各组细胞经过Hoechst和PI染色后在荧光显微镜下观察发现,由图6可知,与Con组比较,HG组细胞对PI吸收较多,强红色荧光多,则说明细胞损伤严重;与HG组相比较,HG+Que组、HG+Kae,以及HG+Que +Kae组的强红色荧光明显减少,其中组合药荧光减少最明显,说明单药或组合药可以抑制HG环境中DRG细胞的凋亡,其中组合药的保护作用优于单药。

图6 单药或组合药对HG诱导DRG细胞凋亡的影响
2.4 Que+Kae对TNFR1、FADD、Caspase-8和Caspase-3表达的影响蛋白质印迹分析结果显示,与对照组相比,HG组TNFR1、FADD、Caspase-8和Caspase-3表达升高(P<0.05),差异有统计学意义。与模型组相比,HG+Que组、HG+Kae组或HG+Que+Kae组的TNFR1、FADD、Caspase-8和Caspase-3表达降低,如图7所示。其中HG+Que+Kae组降低越明显,HG+Que组有降低趋势,但是差异没有统计学意义(P>0.05)。
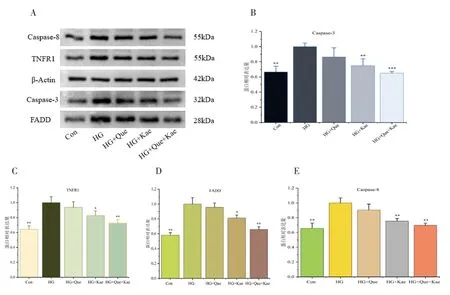
图7 各组细胞凋亡信号通路蛋白表达情况图
3 讨论
DPN的潜在机制是一个复杂的问题,尚在持续的研究中,但是高血糖症和微血管病的影响结果得到认可[17],其中高血糖作为DPN严重程度的关键决定因素备受关注[18]。DPN波及整个周围神经系统的细胞和(或)组织,尤其是DRG细胞[4]。研究表明,最适合DRG细胞体外存活和生长的葡萄糖浓度为25 mM,超过35 mM就会对DRG细胞造成不同程度的伤害[12]。孙青等人[19]的综述中阐述了HG浓度在25~300 mM范围内都会对DRG细胞造成损伤。Sharma等人也发现,暴露于HG环境中,DRG细胞的凋亡数量明显上升[20]。在本次研究中发现,当HG浓度达到85 mM,作用24 h后,DRG细胞活力受抑制,细胞内ROS水平及细胞凋亡量升高。
HG损伤DRG细胞涉及到多个病理过程,本研究中主要关注的是细胞凋亡和氧化应激。细胞凋亡是一个重要的生物学过程,受到多基因的严格控制,如Bcl-2家族、Caspase家族、癌基因C-myc、抑癌基因P53等[21]。DRG细胞是感觉传入躯体的节点,细胞快速凋亡和功能障碍是导致DPN患者肢体麻木和疼痛原因,被认为是DPN发生的主要原因[22]。DRG也被认为是DPN和糖尿病高血糖的靶组织,持续HG状态,葡萄糖的自氧化和蛋白质的糖基化致使DRG细胞产生ROS,不断积累将导致氧化损伤[23]。此外,ROS过量产生导致DRG细胞凋亡,并证实ROS是诱导细胞凋亡的重要因素之一[24]。其中,Caspase是细胞凋亡中最主要最核心的参与者,它的家族对天冬氨酸残基上的肽健具有特异性,能够快速识别并切割,在众多Caspase家族成员中,上游的caspase-8具有双重功能,既可诱导细胞死亡,又可抑制细胞死亡,它可以通过死亡受体TNFR1,诱导细胞凋亡[25]。下游的Caspase-3是细胞凋亡的执行者,正常情况下,Caspase-3没有活性,当细胞接受死亡信号时,可引起Caspase-3裂解、活化,活化的Caspase-3导致DNA修复蛋白、细胞骨架蛋白和Caspase激活的DNase抑制剂(ICAD)的蛋白水解,从而导致细胞凋亡[26]。细胞表面的死亡受体(TNFR1/2、Fas和DR3/4/5)和对应的配体(TNF-α、FasL、TRAIL、TWEAK)被配体激活,导致衔接蛋白、FADD和TRADD9等死亡诱导信号转导复合体形成,进一步激活上游启动型Caspase-8和下游执行型Caspase-3,导致细胞凋亡[25]。
在本研究中,HG可导致DRG细胞活力下降,细胞内ROS水平升高,细胞凋亡数量增加,参与到DPN的发生发展过程中。Que、Kae或Que联合Kae对HG环境中的DRG细胞具有保护作用,主要是通过提高细胞活力,降低细胞内的ROS水平,减轻氧化损伤,最后减少细胞凋亡数量。作用机制是通过下调TNF受体1(TNFR1)、衔接蛋白FADD、上游启动性蛋白Caspase-8和下游凋亡执行者Caspase-3等关键蛋白的表达,抑制细胞死亡受体通路保护DRG免受HG损伤。

