GRSF1/GPX4轴调控的铁代谢紊乱在小鼠脑缺血再灌注损伤中的作用
刘雅静 李亚男 李冰玉 王 苏 刘 恋
铁作为机体必不可少的微量元素之一,对生命活动具有十分重要的意义。适量铁离子可参与细胞能量代谢,而过多的铁离子又可抑制机体自我修复功能进而启动铁死亡加重损伤[1]。研究证实,细胞对铁稳态有着严格的调控机制却没有适当的清除机制,机体中铁的储存量增多,可引起氧化还原失衡,最终导致组织向不可逆的细胞死亡方向进展[2]。已有研究证实,铁离子是神经元损伤和死亡的关键调节因子,缺血脑组织中铁代谢相关蛋白发生改变会导致铁离子聚集,而过量的铁离子可通过芬顿反应催化生成大量羟自由基,诱导细胞损伤,加重急性缺血期受损组织的损害并减少再灌注带来的有益效果[3,4]。
研究发现富含鸟嘌呤序列的结合因子1(guanine-rich sequence-binding factor 1,GRSF1)在胚胎发育过程中可上调磷脂谷胱甘肽过氧化物酶(glutathione peroxidase 4,GPX4)的表达进而促进脑发育,而GPX4作为抑制铁死亡的重要因子,有报道称其可通过GRSF1/GPX4轴抑制铁离子的聚集、改善心肌氧化应激进而减轻损伤[5,6]。然而GRSF1/GPX4轴是否可以通过调控铁代谢进而改善脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)目前尚未见相关报道。本研究旨在探讨GRSF1/GPX4轴调控的铁代谢紊乱在CIRI中的作用,以期为改善CIRI的预后提供新思路。
材料与方法
1.实验动物及分组:清洁级健康雄性C57BL/6小鼠18只,湖南斯莱克景达实验动物有限公司提供,动物许可证号:SYXK(湘)2019-0004。本研究已获得笔者医院动物实验伦理委员会审批[伦理学审批号:WDRM动(福)第20200303号]。随机分为假手术组、脑缺血再灌注组、脑缺血再灌注+GRSF1过表达组。脑缺血再灌注组及脑缺血再灌注+GRSF1过表达组采用线栓法制备小鼠大脑中动脉栓塞模型,缺血60min再灌注24h;脑缺血再灌注+GRSF1过表达组造模前7天予以脑组织内注射GRSF1过表达慢病毒(上海吉凯基因医学科技股份有限公司)。
2.主要材料:BCA蛋白浓度测定试剂盒购自上海碧云天生物技术股份有限公司;GRSF1抗体(货号:A18227)、GPX4抗体(货号:A1933)、TfR1抗体(货号:A5865)购自武汉爱博泰克生物科技有限公司,IRP2抗体(货号:23829-1-AP)、铁蛋白抗体(货号:10727-1-AP)购自武汉三鹰生物技术有限公司,β-actin抗体(货号:GB11001)购自武汉赛维尔生物科技有限公司。
3.脑室注射慢病毒:0.3%戊巴比妥钠腹腔注射麻醉小鼠,固定小鼠头部于鼠脑立体定位架,消毒后沿头部正中线切皮暴露头骨。参考课题组既往研究进行定位后用微量注射泵垂直颅骨刺入,向小鼠侧脑室缓慢注射2μl的GRSF1过表达慢病毒悬液。
4.动物模型制备:麻醉小鼠后在小鼠颈部垫枕仰卧位固定,消毒后于颈部正中切口,显微镜下暴露并分离左侧颈总动脉及颈外动脉分支,分别结扎颈总动脉近心端及颈外动脉,利用动脉夹夹闭颈总动脉远心端阻断血流,尽可能靠近颈总动脉结扎处剪一小口,插入线栓通过动脉分叉处继续向前推进,稍感阻力则停止,固定线栓并缝合切口。线栓置入60min后拔出恢复灌注。再灌注24h后行神经功能评分,小鼠不能自主活动或死亡记4分,行走时向对侧倾倒记3分,向对侧转圈记2分,提尾时对侧前肢不能伸直记1分,无异常记0分。
5.TUNEL法检测细胞凋亡:4%多聚甲醛固定24h,脱水包埋后切片,脱蜡水化,滴加蛋白酶K工作液,37℃水浴锅孵育30min,随后破膜室温孵育10min,浸入TUNEL混合液37℃孵育60min,PBS漂洗后滴加DAPI染液,室温避光孵育,最后用抗荧光淬灭封片剂封片,显微镜下观察拍照,使用Image J软件进行定量分析。
6.Western blot法检测GRSF1、GPX4、铁调节蛋白(iron regulatory protein 2,IRP2)、转铁蛋白受体1(transferrin receptor 1,TfR1)、铁蛋白:根据样品顺序依次上样,电泳仪恒压80V 30min,观察溴酚蓝通过浓缩胶后调整为恒压120V继续电泳至溴酚蓝将到底部。PVDF膜经甲醇激活,电转仪恒流200mA 120min进行转膜,快速封闭液封闭后TBST洗膜1次,随后一抗孵育4℃过夜,TBST洗涤,加入辣根过氧化物酶标记的山羊抗兔二抗孵育1h,TBST洗涤后使用ECL显影液避光孵育及利用显影仪显影,利用Image J软件进行灰度值分析。
结 果
1.小鼠神经功能评分和凋亡率的比较:与假手术组比较,脑缺血再灌注组小鼠神经功能评分升高,大脑皮质缺血半暗带区神经元凋亡率升高(P<0.05);与脑缺血再灌注组比较,脑缺血再灌注+GRSF1过表达组神经功能评分减小,各区域神经元凋亡率降低(P<0.05),详见表1、图1。
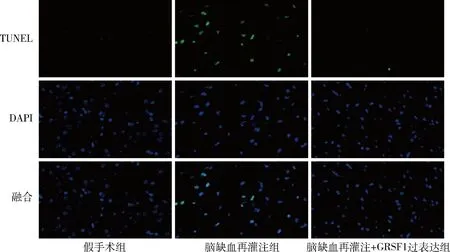
图1 TUNEL染色观察各组神经元凋亡情况

表1 小鼠神经功能评分及神经元凋亡率的比较
2.小鼠GRSF1/GPX4轴的表达变化:与假手术组比较,脑缺血再灌注组小鼠GRSF1、GPX4降低(P<0.05);与脑缺血再灌注组比较,脑缺血再灌注+GRSF1过表达组GRSF1、GPX4升高(P<0.05),详见表2、图2。
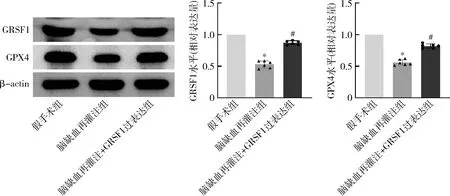
图2 小鼠GRSF1/GPX4轴的表达变化及Western blot法条带图

表2 小鼠GRSF1/GPX4轴的表达变化
3.小鼠铁代谢水平的表达变化:与假手术组比较,脑缺血再灌注组小鼠IRP2、TfR1、铁蛋白升高(P<0.05);与脑缺血再灌注组比较,脑缺血再灌注+GRSF1过表达组IRP2、TfR1、铁蛋白降低(P<0.05),详见表3、图3。

图3 小鼠铁代谢相关蛋白表达的Western blot法条带图及灰度值统计图

表3 小鼠铁代谢水平的变化比较
讨 论
大脑中铁代谢缓慢,铁离子在中枢神经系统中的累积远超其他组织,因此深入探究铁代谢及其涉及的信号通路在神经系统疾病中的发病机制具有重要价值。研究证实铁离子增加可触发氧化应激损伤和炎性介质的积累进而导致大脑长期处于应激与炎性状态,加剧细胞发生死亡的风险[7]。近年来有研究指出,即使是正常周龄的小鼠发生脑缺血再灌注损伤后也会出现衰老细胞增多,铁离子蓄积的现象[8]。而作为机体内重要的抗衰老因子,研究发现,GRSF1沉默后细胞内铁离子及TfR1表达增加,GPX4表达下降[6]。因此有研究认为,GRSF1耗竭诱导的铁代谢紊乱可能是脑缺血再灌注损伤的关键机制之一。
然而在脑缺血再灌注损伤进程中GRSF1诱导铁代谢紊乱的具体机制又是如何?GPX4作为体内重要的抗氧化酶,可通过谷胱甘肽作为辅助因子催化脂质过氧化物减少,抑制GPX4则会导致不饱和脂肪酸氧化和脂肪酸自由基的生成,进一步增加神经元对缺血缺氧的敏感度,促进铁死亡的发生[9]。研究发现,在小鼠骨骼肌成肌细胞中GRSF1可直接靶向调控GPX4进而调节成肌细胞的分化,同时在胚胎脑发育中GRSF1与GPX4共表达,GRSF1可上调GPX4的水平,大鼠心肌细胞沉默GRSF1后会引起GPX4下降,铁离子增多进而加重损伤[5,6,10]。本研究参考课题组既往报道建立小鼠大脑中动脉栓塞模型,笔者发现,与假手术组比较,脑缺血再灌注组中GRSF1及GPX4表达减少,小鼠神经功能评分与细胞凋亡率升高[11];而过表达GRSF1可显著增加GPX4的表达,减轻脑损伤。
铁蛋白、TfR1、铁转运蛋白1(ferroportin1,FPN1)等,作为调节体内铁离子代谢的相关蛋白,铁离子经小肠吸收后通过TfR1进入细胞,并在体内还原为二价铁,胞内铁离子会以直接或间接的形式维持细胞的正常生理功能并参与生理活动,同时IRP2还可通过与其mRNAs非翻译区内的铁反应元件(iron-responsive elements,IREs)结合在转录后调节铁蛋白、TfR1的表达参与铁代谢[12]。
生理条件下血-脑脊液屏障可保护大脑免受全身铁离子浓度波动的影响,但在病理条件下,如CIRI会严重抑制神经元铁外流相关蛋白的表达,从而导致铁堆积[13]。此外,缺血还可增加细胞因子的表达,上调铁代谢调节肽导致FPNl减少,抑制铁释放;同时缺血后TfR1及Dmt1表达增加,促进缺血性脑卒中铁超载的发生,并且过量的铁离子还可进一步诱导氧化应激和铁死亡对大脑产生再次损伤,是加重CIRI的关键机制[14]。
已有实验表明,铁超载后IRP2与IRE解离进而IRP2增多,同时TfR1表达升高,促使铁离子向细胞内转运并以铁蛋白的形式储存[15]。此外Wang等[16]研究发现,在大鼠缺氧缺血性脑损伤模型中可见IRP2及TfR1增多。本研究结果显示,与假手术组比较,脑缺血再灌注组铁代谢相关分子IRP2、TfR1及铁蛋白升高;过表达GRSF1后IRP2、TfR1及铁蛋白降低,提示铁代谢紊乱诱导的铁死亡是参与CIRI的重要细胞死亡形式,通过调控GRSF1/GPX4轴可有效减轻铁离子超载进而改善脑损伤。
综上所述,在脑缺血再灌注期间机体铁代谢紊乱进而诱导铁死亡发生是加重脑损伤的关键机制,通过GRSF1/GPX4轴改善铁代谢紊乱进而抑制铁死亡减轻CIRI,可能是临床防治脑缺血再灌注损伤的新思路。
利益冲突声明:所有作者均声明不存在利益冲突。

