微滤联合大孔树脂纯化蓝莓果脯糖浆中花色苷的工艺优化
朱成成,隋世有,魏文毅,2,贾 建,刘 伟,田 伟,孟令伟,金丽梅,3,4,*,李志江,3
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.黑龙江省农产品加工工程技术研究中心,黑龙江大庆 163319;3.黑龙江省杂粮加工及质量安全工程技术研究中心,黑龙江大庆 163319;4.国家杂粮工程技术中心,黑龙江大庆 163319)
花色苷具有清除自由基[1]的生理功能,在提高人体免疫力[2]、预防心血管疾病[3]、抗炎抗癌[4]等方面具有重要作用。蓝莓果脯加工过程产生大量的果脯糖浆,目前主要应用于果酱[5]、饮料[6]、凝固型酸奶[7]等产品中。蓝莓果脯糖浆除含有糖类之外,还富含花色苷等物质[8]。因此,从蓝莓果脯糖浆中回收花色苷,对于扩大蓝莓花色苷的来源,实现资源的有效利用,加快高附加值产品的开发等具有重要意义。
大孔树脂是目前最有效的花色苷纯化技术之一[9-10],其原理是利用树脂对花色苷分子的吸附和解吸特性实现纯化目的[11]。大孔树脂的类型常根据花色苷的极性强弱不同来筛选,例如胥萍等[12]在血橙花色苷纯化过程中,优化出D101 大孔树脂进行纯化,得到花色苷的色价为48.4,纯化效果明显。夏锦锦等[13]以AB-8 对黑宝石李果实花色苷粗提液纯化,使得花色苷纯度提高了2.10 倍。韩蕈泽[14]同样采用弱极性AB-8 大孔树脂联合高速逆流色谱对蓝靛果花色苷粗提液进行纯化,花色苷纯度达到93.81%。当原料中杂质较多时,若未对其进行前处理而直接进样,势必对大孔树脂的多孔结构造成堵塞[15],同时带来花色苷回收率少、纯度较低等问题[16]。特别是蓝莓果脯的成分较复杂,使用大孔树脂分离时,有必要对原料液进行预处理,以提高后续树脂纯化花色苷的效果。
膜技术具有低温操作、分离效率高等优点,在果汁澄清及花色苷纯化方面具有极大的优势。陈虹吉[17]以0.22 μm 聚醚砜微滤膜、100 kDa 超滤膜对杨梅果汁进行澄清时,果汁的混浊度有效降低,花色苷的稳定性也得到保持。Vladisavljević等[18]以0.2 µm 陶瓷微滤膜对红覆盆子果汁进行澄清,结果表明透过液中花色苷的损失最小。Chaparro 等[19]采用微滤技术对西瓜汁进行分离纯化,实现了花色苷和蛋白质、糖等杂质之间的显著分离。膜技术除了直接用于花色苷提取物的纯化分离之外[20],还常用作大孔树脂纯化花色苷预处理方法,以利于提高花色苷的分离纯化效果[21]。如张亚红等[22]运用切割分子量(MWCO)6 kDa 的超滤膜与D101 大孔树脂联合技术对蓝莓花色苷进行纯化,花色苷纯度可达35%。苏鹤等[23]利用截留分子量10 kDa 超滤膜结合大孔树脂对紫薯花色苷进行纯化,花色苷色价由1.59 提升至32.89。然而目前针对蓝莓果脯糖浆中花色苷分离纯化研究未见相关文献报道。
因此,本文拟采取微滤联合大孔树脂对蓝莓果脯糖浆花色苷进行分离纯化研究,确定微滤分离及大孔树脂纯化的最佳工艺参数条件,研究成果为进一步实现从蓝莓果脯糖浆中回收花色苷提供科学理论依据。
1 材料与方法
1.1 材料与仪器
蓝莓果脯糖浆 黑龙江伊春九鑫食品经销有限公司;无水乙醇、苯酚、葡萄糖、浓硫酸 分析纯(AR),辽宁全瑞试剂有限公司;考马斯亮蓝-250 分析纯(AR),上海金穗生物科技有限公司;大孔树脂AB-8、D101、HPD600 郑州和成新材料科技有限公司;微滤膜为聚乙烯醇纤维膜(孔径0.22 μm) 上海摩速科学器材有限公司。
UV-1500 分光光度计 上海美析仪器有限公司;FA2004 分析天平 沈阳拓宇衡器有限公司;XFUF07601 杯式过滤器 美国Millipore 公司;HL-2S 恒流泵 上海青浦沪西仪器厂;RE2000B 旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 技术路线 蓝莓果脯糖浆→抽滤→微滤分离→大孔树脂筛选→静态试验→动态试验→旋转蒸发→花色苷浓缩液。
1.2.2 蓝莓果脯糖浆的微滤处理 参考课题组前期优化得到的工艺参数进行微滤试验,即首先使用去离子水对蓝莓果脯糖浆进行2 倍稀释,经抽滤去除杂质,取上述抽滤液150 mL 倒入已安装好微滤膜(孔径0.22 µm)的杯式过滤器中,控制操作压力0.08 MPa,浓缩倍数为5 倍,膜面转速为418.6 r/min,收集微滤透过液,测定花色苷、总糖、蛋白质和可溶性固形物含量,并将其进一步用于大孔树脂的分离纯化。
1.2.3 大孔树脂的筛选
1.2.3.1 大孔树脂预处理 通过大孔树脂静态试验对AB-8、D101、HDP600 进行筛选。首先对其进行预处理,即分别将AB-8、D101、HDP600 大孔树脂与无水乙醇按照1:4(g:mL),密封浸泡24 h 充分溶胀后,用去离子水清洗树脂,直至无醇味,去离子水浸泡大孔树脂备用。
1.2.3.2 静态吸附解吸试验 参考余亚选等[24]研究方法,首先分别称取3 g 上述三种预处理的树脂置于锥形瓶,加入蓝莓果脯糖浆花色苷微滤液30 mL,在25 ℃、110 r/min 水浴条件下振荡24 h 至吸附平衡后过滤,于520 nm 处测定滤液中花色苷吸光度,按公式(1)计算树脂静态吸附率。
向上述吸附平衡后的树脂中加入70%乙醇30 mL(盐酸调pH3.0),在25 ℃、110 r/min 条件下振荡24 h 后过滤,于520 nm 测定滤液中花色苷吸光度,按公式(2)计算树脂静态解吸率。以上试验重复3 次取平均值。
1.2.4 动态吸附解析试验
1.2.4.1 单因素实验 参考刘敬华等[25]的方法,将上述筛选出的大孔树脂经预处理后湿法装入Ф2.4×45 cm 玻璃柱中,柱高30 cm,精确量取20 mL 微滤透过液经恒流泵通入大孔树脂,控制上样流速分别为1.0、1.5、2.0、2.5、3.0 mL/min,吸附完成后用4 倍柱体积的酸化乙醇(1 mol/L HCl 调至pH 3.0)进行洗脱,乙醇浓度分别50%、60%、70%、80%、90%,洗脱流速为分别为1.0、1.5、2.0、2.5、3.0 mL/min,收集洗脱液并考察各单因素对花色苷回收率、总糖去除率的影响。每一次吸附解吸试验完成后,均使用去离子水对大孔树脂进行清洗至无醇味。
上述单因素实验中,当研究上样流速的影响时,固定乙醇浓度70%和洗脱流速2.0 mL/min;当研究乙醇浓度的影响时,固定上样流速2.0 mL/min 和洗脱流速2.0 mL/min;当研究洗脱流速的影响时,固定上样流速2.0 mL/min 和乙醇浓度70%。
1.2.4.2 响应面优化试验 根据以上单因素实验,采用Box-Behnken 设计,以蓝莓果脯糖浆中花色苷的回收率为响应值R1,以A 上样流速、B 乙醇浓度、C 洗脱流速为自变量,通过响应面分析对蓝莓果脯糖浆花色苷大孔树脂纯化条件进行优化,因素水平及编码见表1。
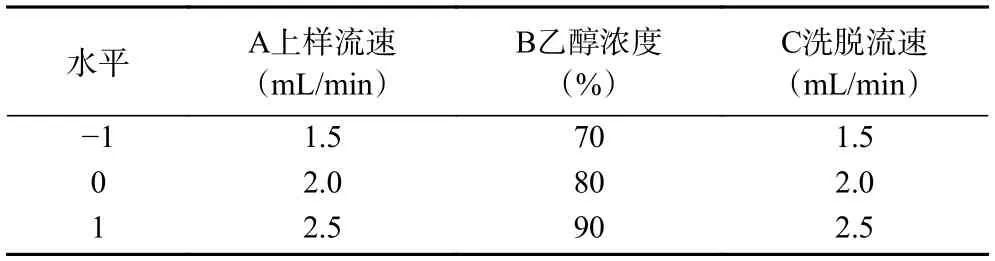
表1 响应面试验因素水平Table 1 Responsive surface experimental factors and levels
1.2.5 旋转蒸发浓缩 将大孔树脂纯化花色苷的收集洗脱液,置于旋转蒸发瓶中,控制操作压力0.1 MPa,水浴温度50 ℃,旋转速度60 r/min。为便于与纯化前后花色苷浓度相比较,控制旋转蒸发浓缩至4 倍,并对浓缩液中的花色苷、总糖、蛋白质含量进行测定。
1.3 指标测定
1.3.1 花色苷含量测定 参考李安等[26]采用pH 示差法测定花色苷。移取1 mL 样液,分别用pH 1.0、pH 4.5 缓冲溶液定容至25 mL,于40 ℃水浴平衡1 h 后在520 nm 下测其吸光度,按公式(3)计算花色苷含量,平行测定三次。
式中,C 为花色苷质量浓度mg/100 mL;A 为pH1.0 时样液在520 nm 处的吸光度与pH4.5 时样液在520 nm 处吸光度的差值;Mw为矢车菊素-3-葡萄糖苷分子量,449.2 g/mol;Df为稀释倍数;ε为矢车菊素-3-葡萄糖苷摩尔消光系数,29600 L/(mol·cm)。
1.3.2 总糖含量测定 参考王彦平等[27]采用苯酚-浓硫酸法测定。移取样液1 mL,稀释10 倍后,取1 mL稀释样液,加入5%苯酚,5 mL 浓硫酸,沸水浴15 min 后,取出冷却至室温,加水定容至25 mL,混匀后在490 nm 测吸光度并计算,平行测定三次。
1.3.3 蛋白质含量测定 参考王艾平等[28]采用考马斯亮蓝法测定。移取样液1 mL,加入5 mL 考马斯亮蓝溶液,混匀后在600 nm 测吸光度并计算,平行测定三次。
1.3.4 可溶性固形物测定 参考NY/T 2637-2014折射仪法,取适量样液滴在折射仪观测镜片上进行读数[29]。
1.3.5 pH 测定 按照GB 5009.239-2016。取适量样液使用pH 计测定pH[30]。
1.3.6 花色苷回收率
式中,X 为花色苷回收率,%;C1为纯化后花色苷浓度,mg/100 mL;V1为纯化后花色苷体积,mL;C2为纯化前花色苷浓度,mg/100 mL;V2为纯化前花色苷体积,mL。
式中,Y 为总糖去除率,%;C3为纯化后总糖浓度,mg/100 mL;V3为纯化后总糖溶液体积,mL;C2为纯化前总糖浓度,mg/100 mL;V2为纯化前总糖溶液体积,mL。
1.3.8 色价的测定 参考栾浩等[31]方法并略作修改,取1 mL 样品溶液加入氯化钾-盐酸缓冲液(pH 1.0)定容至25 mL,于1 cm 比色皿中在520 nm 处测定吸光度并计算色价。
1.4 数据处理
本文采用Origin 2020 进行数据统计与处理,采用SPSS 26.0 对数据进行分析,并采用Design-Expert 12 进行响应面试验设计及分析。
2 结果与分析
2.1 微滤预处理蓝莓果脯糖浆
蓝莓果脯糖浆经微滤前后料液的主要成分如表2 所示。由表2 可见,蓝莓果脯糖浆原料和微滤透过液中总糖含量分别为129.32 和31.76 mg/mL,可溶性固形物含量由52.18%下降到14.32%,蛋白质含量接近0。原料和透过液中花色苷浓度分别为18.40 和6.84 mg/100 mL,这是由于原料液中糖类、果胶等物质在外加压力的作用下,容易在滤膜表面形成膜污染,从而使花色苷也受到部分截留[20],因此透过液中的花色苷含量也大幅降低。另外,由于蓝莓果实中有机酸的累积[32],使蓝莓果脯糖浆pH 为2.55,表现出较强酸性。因此,在大孔树脂纯化花色苷前,采取微滤分离可有效去除原料中的部分蛋白质、糖类及果胶等杂质,减轻树脂吸附柱污染的同时,也利于树脂有效纯化回收中的花色苷。

表2 蓝莓果脯糖浆原液及微滤透过液成分分析Table 2 Composition analysis of the composition of blueberry candied fruit syrup and microfiltration solution
2.2 大孔树脂纯化工艺
2.2.1 静态吸附解吸试验 大孔树脂是主要以范德华力和氢键作用力对花色苷分子进行吸附[33]。因此,不同种类树脂根据比表面积、孔径大小的不同对目标分离物具有一定的选择性[34]。三种大孔树脂对花色苷的吸附和解吸情况如表3 所示。不同种类的树脂对花色苷的吸附程度不同,与D101、HDP600 树脂相比,AB-8 大孔树脂对微滤液中花色苷的吸附率最高,其值为91.26%,远高于D101(80.34%)、HDP 600(78.45%),且三种树脂解吸性能大小为AB-8>D101>HDP600,其解吸率分别为95.05%、78.12%、73.52%。AB-8 树脂吸附、解吸率高的可能原因为树脂比表面积孔径较适于花色苷分子自由进入[13],且微滤处理后中杂质的减少,利于提高树脂对花色苷吸附解吸效率[23]。因此确定使用AB-8 大孔树脂进行花色苷纯化。

表3 不同型号树脂对花色苷的吸附和解吸性能比较Table 3 Comparison of the adsorption and desorption performance of different types of resins for anthocyanins
2.2.2 动态吸附解吸试验单因素实验结果
此外,安徽六国公司还因地制宜地开展好绿化美化工作。如今,粉刷一新的车间装置楼,被矮牵牛和万寿菊簇拥着、还有彩虹不时造访的弘毅楼广场,扮靓着工厂,美了员工的心情,更给客户留下了好印象。
2.2.2.1 上样流速的影响 上样流速对果脯糖浆纯化效果的影响如图1 所示。由图1 可知,随上样流速的增加,洗脱液中花色苷回收率与总糖去除率均呈先逐渐增加再降低的趋势。当上样流速为2.0 mL/min时,花色苷回收率为82.42%,总糖去除率为76.46%,这是由于花色苷分子受树脂范德华力吸引被吸附在树脂多孔结构内,使得花色苷减少损失,回收率达到较高值[35]。与此同时,样液中糖类物质未与树脂颗粒表面长时接触,糖类物质便随溶液流出,因此取得了较好的纯化效果。当流速高于2.0 mL/min 时,花色苷回收率、总糖去除率均为逐渐降低,可能是上样流速的增加,花色苷分子未被树脂吸附便流动出去,造成损失使回收率降低[36]。当上样流速增加到3.0 mL/min时,受样液中糖类物质粘性于树脂表面及颗粒之间间隙的阻碍,导致部分花色苷未被树脂有效吸附,花色苷损失持续增加[37]。因此,确定上样流速为2.0 mL/min。
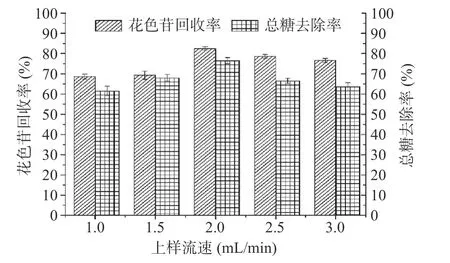
图1 上样流速对果脯糖浆花色苷纯化的影响Fig.1 Effect of feed flow rate on the purification of anthocyanins from candied fruit syrup
2.2.2.2 乙醇浓度的影响 乙醇浓度对果脯糖浆纯化效果的影响如图2 所示。由图2 可知,随洗脱剂乙醇浓度的增加,花色苷回收率、总糖去除率呈先增大后略微减小趋势。当乙醇浓度为80%时,AB-8 大孔树脂对花色苷回收率达82.51%、总糖去除率达80.64%,可能是乙醇溶液的极性性质较轻易断开树脂吸附的花色苷分子,使花色苷溶解于乙醇溶液被洗脱出来,使得花色苷纯化效果明显[16]。继续增加乙醇浓度,大孔树脂对花色苷回收率有所降低,这是由于乙醇浓度增大为90%时,会造成树脂的醇溶现象,即树脂内部多孔结构处于充分溶胀状态,不利于吸附花色苷,降低了花色苷纯化效果[38]。因此,确定80%乙醇为洗脱溶剂。
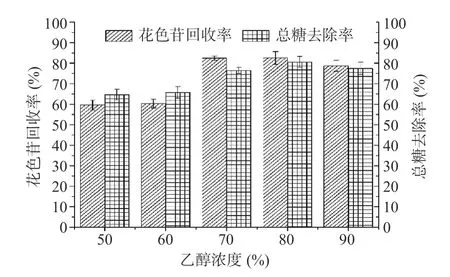
图2 乙醇浓度对果脯糖浆花色苷纯化的影响Fig.2 Effect of ethanol concentration on the purification of anthocyanin from candied fruit syrup
2.2.2.3 洗脱流速的影响 洗脱流速对果脯糖浆纯化效果的影响如图3 所示。由图3 可知,洗脱流速由1.0 mL/min 增大到3.0 mL/min 过程中,花色苷回收率趋势为先逐渐增大后减小,总糖去除率呈缓慢增加后减少再略有增加的趋势。这是由于洗脱液流速过快导致树脂吸附的花色苷未被完全解吸,且糖类物质吸附在树脂表面,使树脂间隙变小,花色苷未溶于洗脱剂并分离流出,从而降低花色苷回收效率[11];洗脱剂流速过慢时,会导致花色苷解吸时间过长,且蓝莓果脯糖浆中糖物质具有一定粘性,易造成树脂损耗增加的同时,不利于花色苷的集中分离[39]。因此,综合考虑后选择洗脱液流速2.0 mL/min。
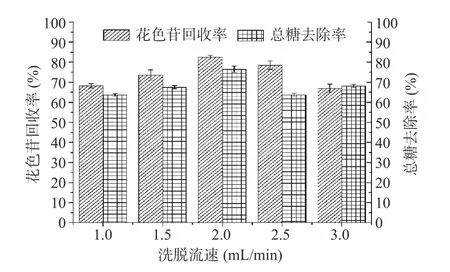
图3 洗脱流速对果脯糖浆花色苷纯化的影响Fig.3 Effect of elution flow rate on the purification of anthocyanin from candied fruit syrup
2.2.3 动态吸附解吸试验响应面优化试验结果 通过响应面动态优化试验,上样流速、乙醇浓度、洗脱流速三个因素对于大孔树脂花色苷回收率的影响结果见表4。
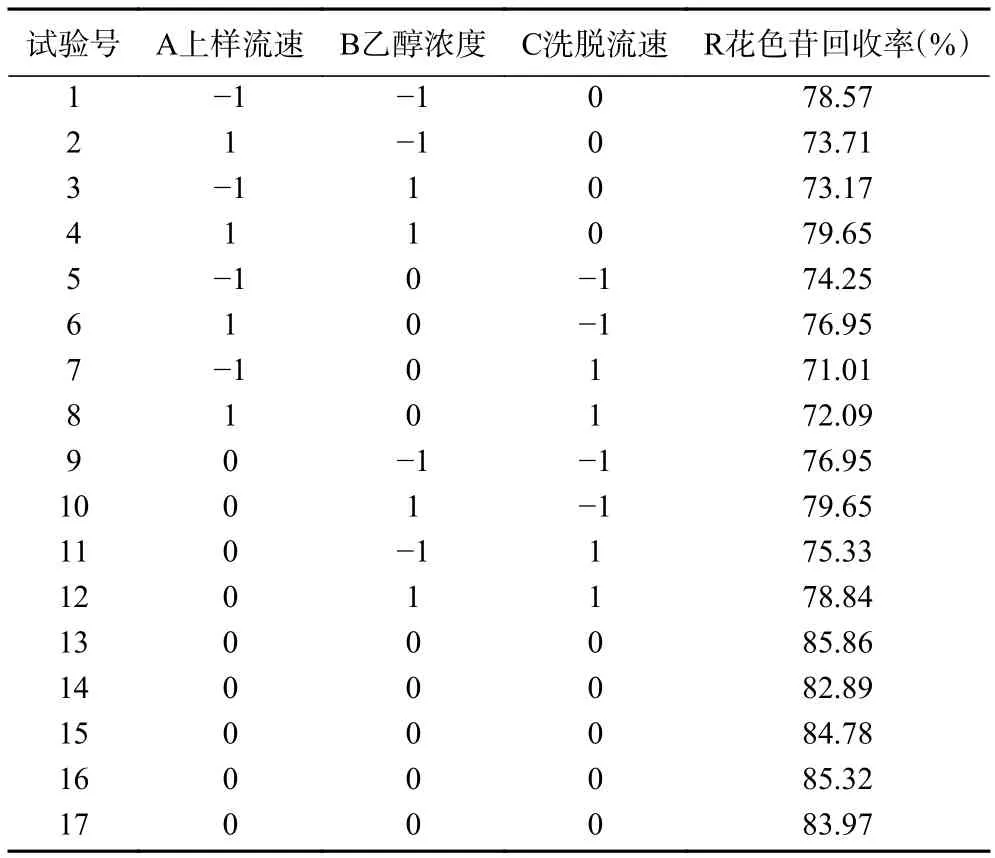
表4 Box-Behnken 响应面试验结果Table 4 Box-Behnken response surface experimental results
2.2.4 回归模型建立及方差分析 对表4 试验结果数据进行回归分析,得到响应自变量(上样流速、乙醇浓度和洗脱流速)与响应值(花色苷回收率)之间的二次多项回归方程:
R=84.56+0.68A+0.84B-1.32C+2.83AB-0.41AC+0.20BC-6.20A2-2.09B2-4.79C2,二次回归模型显著性检验与方差分析结果见表5。
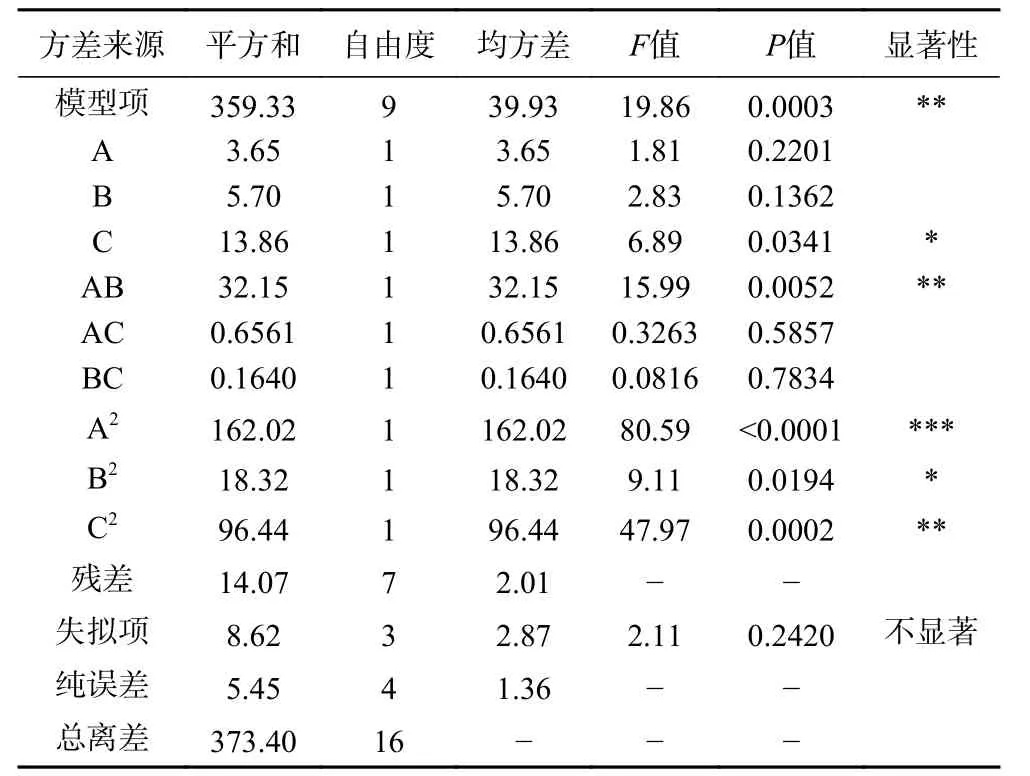
表5 回归模型方差分析Table 5 Regression model analysis of variance
从表5 可以看出,此模型的P<0.01,响应面回归模型达到极显著水平。决定系数R2=0.9623,表明预测值与实验值有较好的相关性。影响花色苷纯化回收率的因素主次顺序为C 洗脱流速>B 乙醇浓度>A 上样流速。模型中A2对花色苷回收率的影响高度显著(P<0.0001),AB、C2对花色苷回收率的影响极显著(P<0.01),C、B2对花色苷回收率的影响显著(P<0.05),失拟项各项数据分析表明该模型失拟不显著(P=0.2420>0.05),说明此模型与试验实际拟合度良好,因此可用该回归方程替代试验真实点来进行结果分析。
2.2.5 各因素交互作用分析 由图4 可看出,乙醇浓度向峰值方向移动,等高线的密度明显低于上样流速方向,等高线形状呈椭圆形,由此可说明,乙醇浓度与上样流速对于蓝莓果脯花色苷的回收率为显著影响。两个因素交互作用图也可得知,在乙醇浓度因素方向,响应面曲线较为陡峭,说明乙醇浓度对花色苷的回收率影响较大,随着洗脱剂乙醇浓度的提高,花色苷回收率先升高后降低。乙醇浓度对花色苷回收率的影响显著。同时沿上样浓度方向变化稍微明显,响应面曲线略陡峭,说明上样流速与乙醇浓度对花色苷回收率的影响差别小。
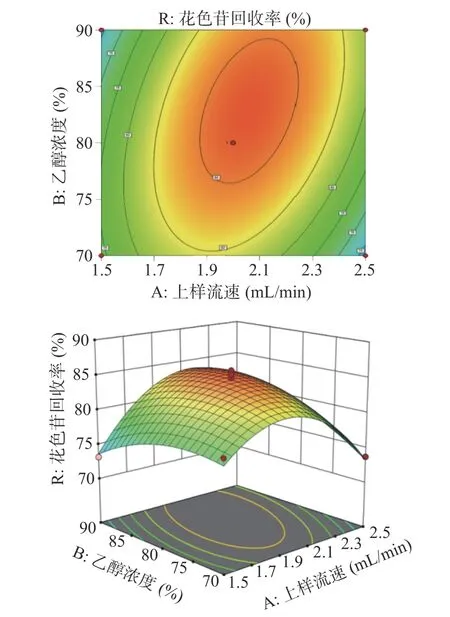
图4 上样流速和乙醇浓度交互作用及等高线图Fig.4 Interaction and contour plots of up-sampling flow rate and ethanol concentration
由图5 可看出,沿着洗脱流速朝峰值方向移动的等高线密度也相对低于沿上样流速方向。由两者交互作用图可看出,在上样流速因素方向响应面曲线坡度较为陡峭;但洗脱流速因素方向的响应曲面坡度较缓,表明上样流速与洗脱流速的交互作用对花色苷回收率的影响较小。随上样流速的增加,上样流速对花色苷回收率影响并不显著。由此可见,洗脱流速对花色苷回收的影响明显高于上样流速。
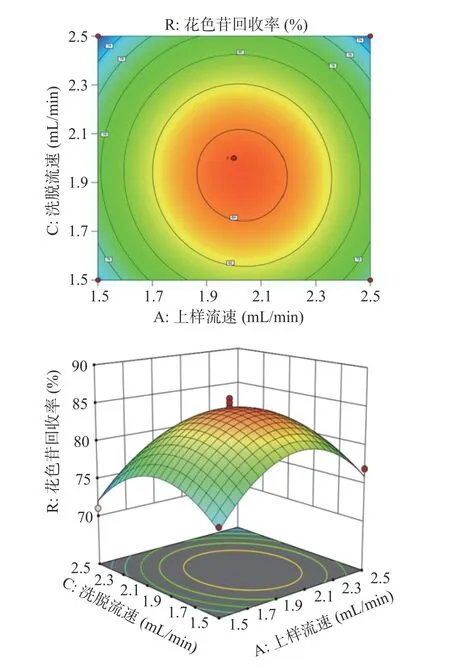
图5 上样流速和洗脱流速交互作用及等高线图Fig.5 Interaction and contour plots of up-sampling flow rate and elution flow rate
由图6 可看出,乙醇浓度和洗脱流速沿峰值方向的等高线密度较为稀疏,交互作用三维图中响应面线的坡度较为平缓;说明当上样流速一定时,乙醇浓度及洗脱流速的交互作用对花色苷回收率的影响不显著。

图6 乙醇浓度和洗脱流速交互作用及等高线图Fig.6 Interaction and contour plots of ethanol concentration and elution flow rat
2.2.6 验证试验 使用AB-8 大孔树脂对蓝莓果脯糖浆花色苷的纯化过程中,在各因素水平范围内,洗脱流速显著高于上样流速和乙醇浓度对花色苷回收率的影响。由回归模型分析得到,AB-8 大孔树脂对花色苷回收率最佳工艺参数为上样流速2.06 mL/min、乙醇浓度82.80%、洗脱流速1.93 mL/min。考虑到实际操作因素,对试验条件参数进行调整,调整后的工艺参数为上样流速2.0 mL/min、乙醇浓度83%、洗脱流速2.0 mL/min,在此条件下纯化回收蓝莓果脯糖浆中的花色苷,重复三次,实际测得的花色苷回收率为86.68%±1.06%,接近预测值88.46%±1.25%,且总糖去除率为84.13%±2.24%。表明响应面优化该纯化方法具备一定的实际应用价值。
2.3 大孔树脂洗脱液浓缩后指标分析
由于前期对大孔树脂进料液进行4 倍稀释,现将洗脱液浓缩4 倍以便于与原料液的组成进行对比。花色苷洗脱液经旋转蒸发浓缩至相同进液体积后,其组成含量如表6 所示。由表6 可知,大孔树脂花色苷质量浓度为5.56 mg/100 mL,总糖浓度质量为5.24 mg/mL,与表1 中微滤透过液中花色苷和总糖的含量6.84 mg/100 mL、31.76 mg/mL 相比,花色苷的回收率约为81.30%,总糖的去除率约为83.50%,蛋白质完全去除。且经微滤联合大孔树脂纯化后的果脯糖浆中花色苷色价为31.43,约为原液中花色苷色价6.14 的5 倍,与栾浩等[31]研究结果相似。表明AB-8 大孔树脂对于蓝莓果脯糖浆废液中花色苷的回收效果较为明显。
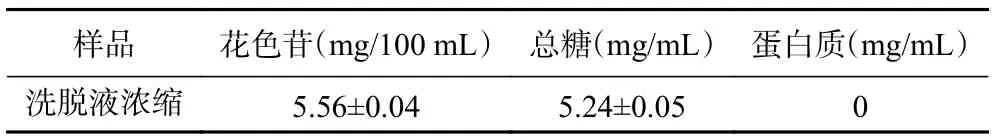
表6 大孔树脂洗脱浓缩液指标分析Table 6 Index analysis of macroporous resin eluent concentrate
3 结论
本文采用了微滤联合大孔树脂对蓝莓果脯糖浆花色苷进行分离纯化。优化了AB-8 树脂对蓝莓果脯中花色苷的纯化工艺,通过响应面分析得最佳条件为:上样流速2.0 mL/min、乙醇浓度83%、洗脱流速2.0 mL/min,此条件下所得花色苷回收率为86.68%,总糖去除率为84.13%。将花色苷解吸液浓缩后,经微滤联合大孔树脂纯化后的蓝莓果脯糖浆中花色苷色价为31.43,约为原液中花色苷色价6.14 的5 倍。本研究开发的微滤与大孔树脂联合技术,对于从蓝莓果脯糖浆中有效回收花色苷提供一定的技术参考。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

