基于pyrF 的乳酸乳球菌食品级表达载体的构建
王 帅,邓木兰, ,梁志成,周泓宇,何少媚,张 智,穆云萍,李芳红,*,赵子建,*
(1.广东工业大学生物医药研究院,广东广州 510006;2.华南理工大学医学院,广东广州 510006;3.深圳大学生命与海洋科学学院,广东深圳 518060)
乳酸乳球菌(Lactococcus lactis,L.lactis)是一种广泛存在于自然界的食品级微生物,因其具有营养和免疫等益生功能[1],被FDA(食品药品监督管理局,Food and Drug Administration)公认为GRAS(一般认为安全的,Generally Recognized as Safe)的微生物,在食品发酵、乳制品的生产和保存中的应用有着悠久的历史[2]。L.lactis是一种生长速度快、易于操作、遗传背景清楚的革兰氏阳性菌,某些菌株全基因组测序已经完成,因其良好的宿主基因工程能力,L.lactis常被用来作为表达异源蛋白的宿主菌,逐渐成为了食品和医药研究领域的热点[3-8]。
然而,传统的L.lactis表达系统存在一些问题,例如大多以抗生素作为筛选标记,抗性基因的横向转移导致抗生素污染已成为全球问题[9-12]。另外,传统的L.lactis表达系统的潜在危害主要是因其表达载体中含有来源于病原微生物或非安全型微生物DNA 片段,这极大地限制了其实际应用。因此,寻找新的非抗性食品级筛选标记,构建食品级表达载体使得乳酸菌在食品和医疗行业具有更广泛的应用是乳酸菌基因工程需要探索的方向之一[13]。作为食品级表达系统,L.lactis必须具备:a.遗传特性清楚且稳定;b.表达载体中的表达元件等功能性DNA 片段必须来自食品级微生物;c.选择标记必须是食品级的[14]。因此,为满足这三个基本条件,越来越多的研究者着手以来源于食品级微生物的DNA 片段构建的食品级表达系统的研究[15]。
安全且稳定的筛选标记是食品级表达载体的关键因素之一。乳清酸核苷-5-磷酸脱羧酶基因(orotidine-5'-phosphate decarboxylase,pyrF)是目前应用最为广泛的一类营养缺陷型筛选标记之一,pyrF基因是L.lactis尿嘧啶核苷酸生物合成和代谢过程的关键酶,将pyrF基因突变或缺失,L.lactis突变菌株不能将体内底物乳清酸转化为乳清酸核苷酸,从而导致尿嘧啶营养缺陷型菌株的产生,其在培养时需要额外添加尿嘧啶才能正常生长,而出发菌株能将5-氟乳清酸(5-fluoroorotic acid,5-FOA)转化为对细胞有毒的5-氟尿嘧啶,从而导致野生型菌株不能在含5-FOA 的培养基中生长[16]。基于以上筛选原理,可通过5-FOA 筛选获得尿嘧啶营养缺陷型菌株,然后利用不加尿嘧啶的培养基筛选回补原养型菌株,在酵母、丝状真菌等和其他细菌物种中都有着重要的应用[16-17]。
因此,本研究以pyrF基因为筛选标记,通过同源重组法构建NZ3900 ΔpyrF营养缺陷型菌株,并利用食品级L.lactis的相关表达元件[18-19],构建L.lactis食品级表达载体,以ZsGreen 为报告基因实现ZsGreen 在NZ3900 ΔpyrF缺陷型菌株中的稳定表达。本研究为L.lactis食品级无抗性筛选标记的遗传改造提供新的思路。
1 材料与方法
1.1 材料与仪器
乳酸乳球菌L.lactisNZ3900 购自德国MoBi-TecGmbH 公司,由本实验室-80 ℃保存;ZsGreen基因 来自本实验室保存的pLVX-IRES-ZsGreen质粒,经密码子优化并在C 端加入6×His-tag 蛋白标签,由华大基因公司合成;本研究所有DNA 序列和所用引物(表1) 均由华大基因公司合成;SacII 和Hind III 限制性内切酶(1 U/μL)、Taq 酶(5 U/μL)、T4DNA 连接酶(350 U/μL) TaKaRa 公司;DNA Marker 南京诺唯赞生物科技股份有限公司;蛋白Marker 北京索莱宝科技有限公司;尿嘧啶、5-氟乳清酸、抗坏血酸、葡萄糖、蔗糖、甘油 上海生工生物工程技术服务有限公司;M17 培养基 生物风;细菌基因组快速提取试剂盒、胶回收试剂盒、质粒提取试剂盒 OMEGA 公司;His-Tag(D3I1O)偶联辣根过氧化物酶(HRP Conjugate)抗体 美国CST 公司;本研究主要培养基及溶液:G17 培养基、电转感受态SG17 培养基、Elliker 培养基、蔗糖-甘油溶液、电转复苏培养基、Elliker-FOA 培养基具体配方参考文献[20]。
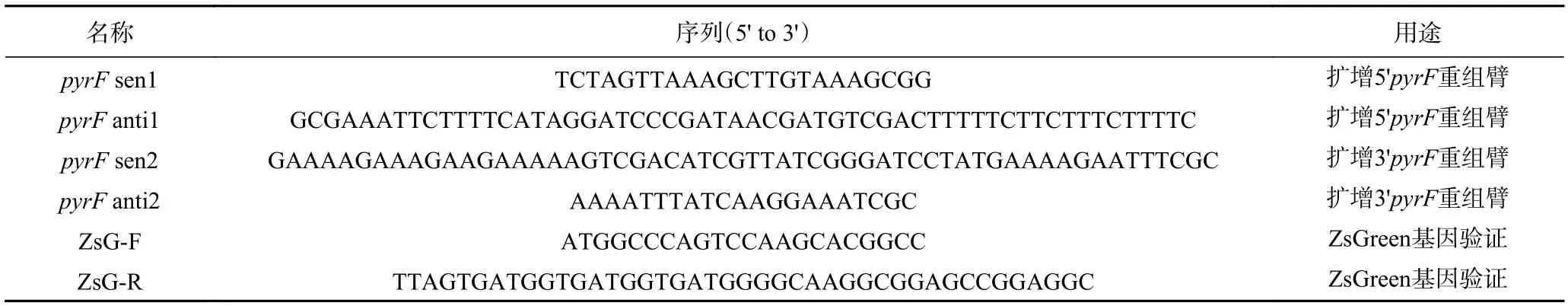
表1 本研究所用到的引物Table 1 Primers used in this study
T100+^TM+Thermal+Cycler PCR 仪、Micro-Pulser 电穿孔仪(1652100)、伯乐的电泳转化膜系统(165-8000)、ChemiDoc+XRS+凝胶成像及分析系统 美国Bio-Rad 公司;Leica DM2500 荧光显微镜 德国徕卡;SW-CJ-1BU 超净工作台 苏州净化设备有限公司;LBI-80 恒温培养箱 上海龙跃仪器设备有限公司;TS-200B 空气浴摇床 上海天呈实验仪器制造有限公司;DELTA320pH 计 Mettler Toledo。
1.2 实验方法
1.2.1 pLD 载体的合成 根据L.lactis的基因组DNA 全序列(GenBank:CP002094.1)查询得到repA、repC、pyrF、P8、Tusp45和TpepN等相关基因的序列,P32的基因 组 DNA 全序列 从 GenBank:AP018499.1 查询得到、由深圳华大基因公司合成,pLD 载体详细结构示意图如图1 所示。
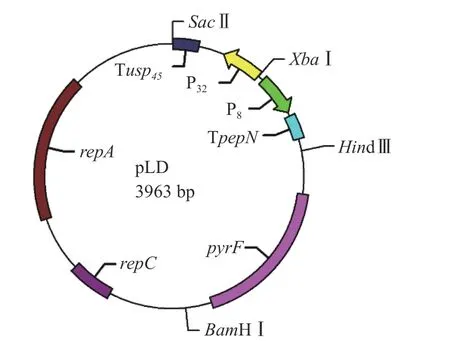
图1 表达载体pLD 的结构示意图Fig.1 Structure diagram of expression vector pLD
1.2.2 电转感受态L.lactisNZ3900 的制备 将NZ3900 甘油冻存菌划线于G17 平板上,置于30 ℃静置培养活化2 d。挑取单克隆菌落,接种到50 mL的G17 培养基中,30 ℃静置培养,当菌液OD600=0.3 时,于室温下3000×g 离心5 min 收集NZ3900。用5 mL 蔗糖-甘油溶液(冰上预冷)重悬和洗涤菌体,4 ℃,6000×g 离心3 min,弃上清液,用1 mL 蔗糖-甘油溶液(冰上预冷)重悬菌体,此时即为电转感受态,80 μL/EP 管分装,储存于-80 ℃保存备用。
1.2.3pyrF突变盒pyrF-PT 的构建 用OMEGA的细菌基因组快速抽提试剂盒提取,按照说明书操作提取NZ3900gDNA,以其为模板,利用pyrFsen1/pyrFanti1 和pyrFsen2/pyrFanti2 引物分别扩增出5'pyrF重组臂pyrF-P 和3'pyrF重组臂pyrF-T,目标片段DNA 序列大小分别为658 bp 和604 bp,PCR扩增条件:预变性94 ℃,5 min;94 ℃ 30 s,55 ℃50 s,72 ℃ 40 s,产物进行25 个循环,72 ℃延伸7 min。将pyrF-P 和pyrF-T 的DNA 片段进行电泳并切胶纯化回收,作为overlap PCR 模板,引物为pyrFsen1/pyrFanti2,PCR 扩增条件:预变性94 ℃,5 min;94 ℃ 30 s,55 ℃ 50 s,72 ℃ 1 min,产物进行25 个循环,72 ℃延伸7 min,扩增出pyrF突变盒pyrF-PT 的DNA 序列,为1262 bp。然后电泳并切胶纯化回收,将所得的DNA 片段定量并于-20 ℃保存备用。
1.2.4L.lactisNZ3900 ΔpyrF突变株的构建 将纯化的pyrF-PT DNA 片段电转化入L.lactisNZ3900:吸取冰上融化的80 μL 感受态NZ3900 于事先预冷的电转杯中,再加入10 μL(含5 μg 的pyrF-PT DNA)待转化DNA。设置电转程序如下:2000 V,25 μF,200 Ω,5 ms。电击后加入1 mL 电转复苏培养基混匀,将电转杯置于冰上5 min,然后放入培养箱30 ℃孵育2 h,3000×g 离心5 min,弃去上清液体然后用200 μL 生理盐水重悬,涂布于Elliker-FOA 平板上,30 ℃培养72 h。
1.2.5L.lactisNZ3900 ΔpyrF突变株的鉴定 挑取Elliker-FOA 平板上的单菌落,接种于100 mL 含有50 mg/L 的尿嘧啶的G17 培养基中,30 ℃静置培养2 d,提取L.lactisNZ3900 ΔpyrFgDNA,用1%琼脂糖电泳鉴定,部分送往华大基因公司进行序列鉴定。然后将构建成功的L.lactisNZ3900 ΔpyrF突变株制备为电转化感受态细胞。
1.2.6 pLD-ZsG 载体的构建 将pLD 质粒与P32-ZsG-Tusp45DNA 片段分别进行SacII 和Hind III双酶切反应后对产物进行琼脂糖凝胶电泳并切胶回收备用。将纯化的pLD 质粒酶切片段与P32-ZsGTusp45DNA 酶切片段进行连接反应,16 ℃水浴连接过夜,重组载体命名为pLD-ZsG。
1.2.7 LL-pLD-ZsG 工程菌株的构建及鉴定 将pLD 和pLD-ZsG 质粒分别电转入NZ3900 ΔpyrF感受态细胞中,涂布于Elliker 平板上。30 ℃培养72 h,将重组菌株分别命名为LL-pLD 和LL-pLDZsG。然后提取质粒DNA,提取步骤参考任志娟等[21]的研究。将质粒DNA 进行酶切,反应完成后取5 μL 酶切产物进行1%琼脂糖凝胶电泳鉴定,部分质粒DNA 送去华大基因公司进行测序。LLpLD-ZsG 重组工程菌株蛋白样的制备:在室温下5000×g 离心3 min 收集LL-pLD-ZsG 菌体,液氮研磨成细粉状后取菌体50 mg 至1.5 mL 离心管中,加入1 mL RIPA 细胞裂解液振荡均匀,按比例加入5×蛋白上样缓冲液(4:1 v/v)充分振荡混匀,100 ℃水浴变性10 min,室温下5000×g 离心3 min,取上清液作为蛋白样保存。ZsGreen 蛋白验证步骤参考文献[22]。
1.2.8 LL-pLD-ZsG 重组工程菌的荧光观察 将转化pLD-ZSG 片段的Elliker 筛选平板上长出的阳性转化子转接到3 mL 含有40 mg/L 的尿嘧啶的Elliker 液体培养基中,30 ℃下静置培养48 h 后,室温下3000×g 离心1 min,弃上清液,用1 mL 的PBS溶液重悬菌体,将菌液制片并于Leica DM2500 荧光显微镜下观察绿色荧光蛋白在菌体中的表达情况(对照组为相同培养条件的NZ3900 ΔpyrF),激发光波长为493 nm。
1.2.9 LL-pLD-ZsG 工程菌株的连续传代培养稳定性测定 将LL-pLD-ZsG 重组工程菌株从Elliker平板上挑取阳性菌落,接种于100 mL 的Elliker 培养基中,在30 ℃培养箱进行培养24 h,至OD600约0.4 的时候即作为第1 代LL-pLD-ZsG 重组工程菌株,然后取1 mL 的第1 代工程菌株培养菌液于室温下5000×g 离心1 min,弃上清液留菌体沉淀,然后用PBS 洗涤,室温下5000×g 离心1 min,然后用PBS重悬菌体。取1×104CFU PBS 重悬的第1 代工程菌株接种到100 mL 的Elliker 培养基中,在30 ℃培养箱进行培养24 h,至OD600约0.4 的时候即作为第2 代工程菌株,按照上述步骤收集工程菌株并传代,重复培养到30 代。然后分别提取1、5、10、15、20、25、30 代的重组工程菌的质粒并进行SacII 单酶切,将酶切产物进行琼脂糖凝胶鉴定,将第30 代重组工程菌的质粒送华大基因公司进行测序。以第1 代培养菌液和第30 代培养菌液制作为蛋白样,然后进行Western blotting 鉴定。
1.3 数据处理
本文采用的数据库GenBank(www.ncbi.nlm.nih.gov);PCR 引物设计软件:Primer premier 5;基因和蛋白序列处理软件:DNAssist(v3.0);密码子优化JCat online tool(http://www.jcat.de/)。
2 结果与分析
2.1 突变盒pyrF-PT 的构建
利用基因组DNA 提取试剂盒提取NZ3900gDNA,通过琼脂糖凝胶电泳鉴定结果如图2a,在10 kbp 上方可以看到条带,说明NZ3900gDNA 提取成功。以NZ3900gDNA 为模板,扩增5'pyrF重组 臂pyrF-P 和3'pyrF重组臂pyrF-T 的DNA 片段,并以pyrF-P/pyrF-T 为模板进行overlap PCR,扩增出pyrF突变盒pyrF-PT,琼脂糖凝胶电泳鉴定结果如图2b,目的序列的DNA 片段分别约为658、604和1262 bp,与预期大小一致,且测序结果表明pyrFP、pyrF-T 和突变盒pyrF-PT 扩增成功。
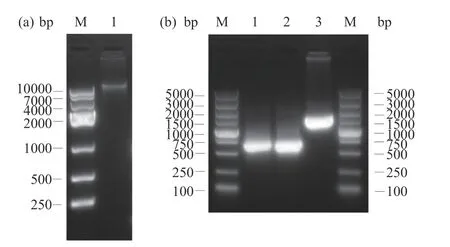
图2 突变盒pyrF-PT 的构建Fig.2 Construction of mutation cassette pyrF-PT
2.2 NZ3900 ΔpyrF 突变株的鉴定
将突变盒pyrF-PT 电转化至NZ3900 出发菌中,构建NZ3900 ΔpyrF突变株,在含有尿嘧啶和5-FOA 的固体培养基中进行NZ3900 ΔpyrF突变株筛选。基因组PCR 鉴定如图3 所示,结果表明NZ3900出发菌的pyrF基因大小约为1976 bp,而NZ3900 ΔpyrF突变株的pyrF基因区大小约为1262 bp 左右,比出发菌减少了714 bp,经过测序表明,pyrF基因的编码序列被成功地敲除。
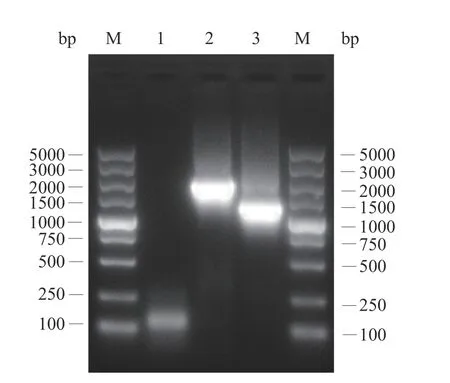
图3 pyrF 突变盒的PCR 鉴定Fig.3 PCR detection of pyrF mutation cassette
2.3 pLD-ZSG 载体的构建
将合成的P32-ZsG-Tusp45DNA 片段和pLD 载体分别进行SacII 和Hind III 双酶切,纯化后由连接酶连接,构建pLD-ZsG。将其电转至NZ3900 ΔpyrF突变株,构建原养型LL-pLD-ZsG 工程菌株并扩增pLD-ZsG 质粒,提取pLD-ZsG 进行双酶切鉴定,琼脂糖凝胶电泳结果如图4,在约1073 bp 和3686 bp处可见目标条带,与双酶切的P32-ZsG-Tusp45DNA和pLD 质粒的酶切片段大小一致,且测序结果表明pLD-ZsG 载体构建成功。
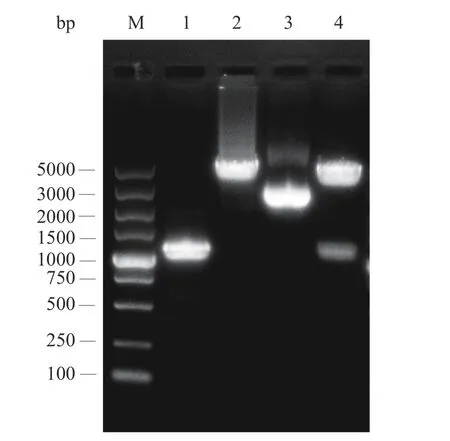
图4 pLD-ZsG 质粒双酶切结果Fig.4 Result of pLD-ZsG plasmid digested
2.4 LL-pLD-ZsG 重组工程菌中绿色荧光的观察
本研究以ZsGreen 绿色荧光蛋白作为报告基因,构建的LL-pLD-ZsG 原养型重组工程菌在荧光显微镜下可观察到明亮的绿色荧光菌体,而NZ3900 ΔpyrF突变株在相同条件下无绿色荧光(见图5)且NZ3900 ΔpyrF出发菌和LL-pLD-ZsG 重组工程菌在形态上并无差别,表明pLD-ZsG 表达载体成功转入NZ3900 ΔpyrF突变株,使得ZsGreen 基因在NZ3900 ΔpyrF突变株进行有效的转录和表达。

图5 LL-pLD-ZsG 的荧光显微镜图Fig.5 Fluorescence microscope image of LL-pLD-ZsG
2.5 LL-pLD-ZsG 重组工程菌中ZsGreen 蛋白的表达
通过Western blotting 验证ZsGreen 蛋白在NZ3900 ΔpyrF突变株中的表达情况,结果如图6 所示,在NZ3900 出发菌、LL-pLD 空载工程菌、LLpLD-ZsG 重组工程菌中只有LL-pLD-ZsG 工程菌的菌体蛋白在约28 kDa 处有特异性目的条带出现,该条带的大小与预期相符,表明绿色荧光蛋白ZsGreen 能在NZ3900 ΔpyrF中表达,同时也说明pLD 能实现外源基因在NZ3900 ΔpyrF突变株中的转录和表达。
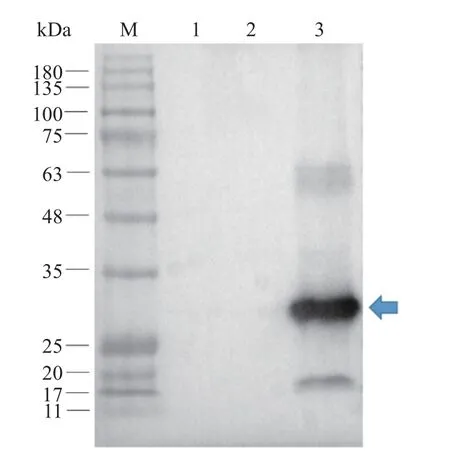
图6 Western blotting 验证LL-pLD-ZsG 中ZsGreen 的表达Fig.6 Western blotting verified the expression of ZsGreen in LL-pLD-ZsG
2.6 LL-pLD-ZsG 重组工程菌传代稳定性的鉴定
提取不同代的LL-pLD-ZsG 重组工程菌的pLD-ZsG 质粒进行SacII 单酶切,酶切产物进行琼脂糖胶电泳鉴定,结果如图7 所示,1、5、10、15、20、25、30 代的重组工程菌的质粒经过单酶切后大小均一致约为4759 bp,表明LL-pLD-ZsG 工程菌在30 代以内质粒没有丢失或发生改变,具有一定的遗传稳定性。
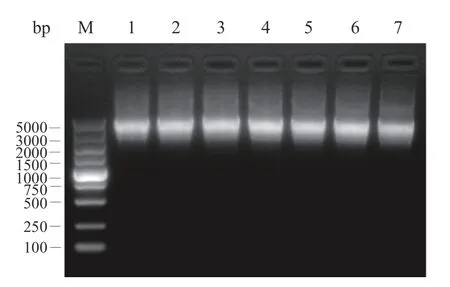
图7 LL-pLD-ZsG 质粒遗传稳定性鉴定Fig.7 Genetic stability assessment of LL-pLD-ZsG plasmid
通过Western blotting 验证LL-pLD-ZsG 工程菌经过30 次传代后,是否仍能稳定表达外源蛋白,结果如图8 所示,以第1 代LL-pLD-ZsG 工程菌为阳性对照,结果表明LL-pLD-ZsG 工程菌经过30 次传代后仍能正确表达ZsGreen,分子量大小约为28 kDa,再次证实了LL-pLD-ZsG 重组工程菌至少在传代培养的30 代以内保持质粒不丢失,具有一定的遗传稳定性。
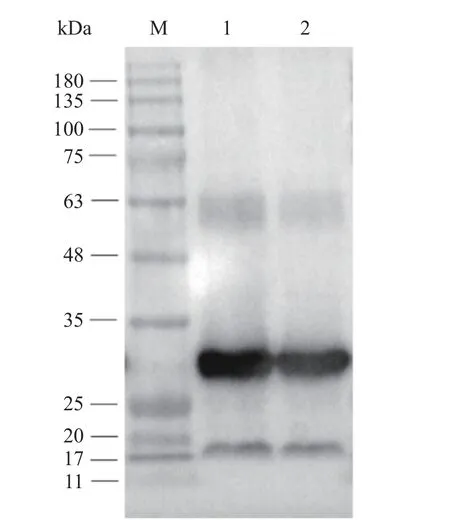
图8 Western blotting 鉴定第1 代与30 代的LL-pLD-ZsG工程菌株Fig.8 Western blotting results of 1st and 30th generation of recombinant LL-pLD-ZsG
3 讨论与结论
在L.lactis的前期研究中,以抗生素作为筛选标记的非食品级表达载体,构建了大量的乳酸菌抗性基因工程菌株,在多肽、酶、多糖、细菌素等代谢物质的合成表达方面的大量应用,促进了乳酸菌工业化的应用进展,为制备酶制剂、乳酸菌口服疫苗提供了理论基础和实验依据[23]。然而,抗生素在生物体或者环境中漂移扩散,破坏生态,影响生物多样性,给全球生态和世界经济带来了沉重的负担[9-10]。
目前,研究者为了构建L.lactis食品级表达载体开发了糖类筛选标记、细菌素筛选标记、抗金属离子筛选标记、噬菌体筛选标记以及营养缺陷型筛选标记等[24-27]。营养缺陷型筛选标记是理想的安全选择性标记,Dickely 等[28]以supB基因作为选择标记,构建pFG1 表达载体,进行克隆表达。Sorensen 等[29]用supD基因构建了pFG200 载体,实现了多种外源蛋白的过表达。以上两种选择标记均属无义突变抑制基因,可在多种培养基上进行选择,由于其使用灵活,相比较于其他“食品级”筛选标记有许多优点,但tRNA 抑制基因可能会导致多重效应[30]。而孙强正等[14]以营养缺陷型thyA基因为筛选标记,构建pSQZ 食品级表达载体,实现具有保护活性蛋白的表达。以上的研究可以看出,营养缺陷型筛选标记在L.lactis的食品级表达载体构建中的应用较少,因此,本实验利用pyrF/5-FOA 营养缺陷型筛选标记,构建L.lactis食品级表达载体,为L.lactis食品级表达载体的构建提供新的选择。尿嘧啶营养缺陷型是一种在微生物中常用的营养缺陷型筛选标记,因其来自于宿主本身,属于同源转化,避免了甲基化[31-32],是理想的安全型筛选标记。本研究基于pyrF/5-FOA营养缺陷型筛选标记,构建L.lactisNZ3900 ΔpyrF突变株,并以其为出发菌,通过电转化法转染包含pyrF回补标记和报告基因ZsGreen 的pLD-ZsG 质粒构建LL-pLD-ZsG 原养型工程菌株,成功实现外源基因的表达,为L.lactis的遗传改造提供了有效的食品级筛选标记。
L.lactisNZ3900/pNZ8149 是目前食品工业和医学领域中最常用且唯一商业化的NICE 表达系统[33],由于其需要添加诱导剂Nisin 来诱导外源蛋白的表达,不适用于口服疫苗、生物活性多肽的应用;且在食品工业发酵过程中需要添加诱导剂,操作过程麻烦、增加生产成本[5]。而相较于NICE 表达系统,pyrF/5-FOA 表达体系的优势在于它不需要添加任何的诱导剂和抗生素的条件下,可实现外源基因的稳定表达,这为L.lactis食品级表达系统的实际应用提供了可能。L.lactis组成型表达系统表达外源蛋白产量较低是目前亟待解决的问题。本研究所构建的表达载体pLD 也存在这样的问题。因此,在后续研究中继续改造该组成型表达载体,从强启动子筛选、增加多拷贝数等方向进行改造,以期提高外源蛋白在L.lactis组成型表达系统的表达量,进而提高该食品级表达载体的表达能力。
本研究基于pyrF/5-FOA 筛选机制构建的食品级表达载体pLD 不含有任何抗生素抗性基因、各组分均来自食品级微生物,且宿主菌也为食品级微生物,完全符合FDA 所规定的严格的食品级规范,很好地解决了生物安全性问题,提供了一种高效简捷的构建可供口服的食品级表达载体的方法,为利用L.lactis生产食品级药物多肽提供了研究基础和理论依据。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

