自然发酵对青金桔酚类物质及其抑制消化相关酶活性的影响
张红建,刘帅光,马泽威,王青松,田 燕,郑联合,
(1.海南省粮油科学研究所,海南琼海 571400;2.海南大学食品科学与工程学院,海南海口 570100)
青金桔(Citrus microcarpa)为芸香科柑橘族金柑属,是宽皮柑橘(Citrus reticulateBlanco)和金桔(Fortunellaspp.)的杂交品种[1],主要分布于我国海南省、台湾地区以及马来西亚、印度尼西亚、泰国、菲律宾等热带及亚热带地区,其产量可达5~8 吨/年。目前海南省青金桔产量在25 万吨/年左右,占全国青金桔总产量的90%以上。酚类化合物是植物中普遍存在的次级代谢产物,也是柑橘类水果中主要的功能活性物质,具有抗氧化、降血脂、防止肥胖、改善糖尿病等多种生物活性[2-5]。青金桔皮中酚类物质含量可达到1054~1894 mg/100 g[6],主要以根皮素-3',5'-二-C-β-葡萄糖苷、橙皮苷、川陈皮素、桔皮素等为主[7]。研究表明,以上酚类物质具有较好的抗氧化、抑制酪氨酸酶活性[1],以及降血糖、降血脂、降胆固醇等生理功能[4]。青金桔产量较高,其所含酚类物质等具有较好的功能活性,但目前青金桔深加工产品较为缺乏,现主要用于榨汁。并且,榨汁后产生大约45%的皮渣副产物,由于缺乏相应的加工技术,其基本被丢弃,从而造成较大的资源浪费和环境污染[8]。
果蔬自然发酵是指新鲜果蔬在添加或不添加辅料的条件下,通过果蔬自身携带及环境中的微生物的新陈代谢作用,合成具有多种生物活性的酶类和代谢产物的过程。因其具有设备投入少、操作简单、发酵产品风味独特,能实现对集中收获果蔬的快速加工等特点,现已成为果蔬加工研究的热点[9]。青金桔富含水、有机酸、果胶、糖类、维生素以及丰富的微量元素[10],在不添加任何其他物质的条件下,可作为自然发酵的天然培养基。因此,采用全果浆自然发酵可实现青金桔100%全利用,最大程度保留青金桔营养和风味。研究表明,微生物发酵果蔬过程中可产生纤维素酶等[11],促使植物细胞壁结构物质水解,促进可溶性酚类物质释放,从而改善发酵产物生理活性[12]。尽管如此,目前针对青金桔酚类物质的报道主要集中在提取及抗氧化性的变化[7,13],缺乏青金桔酚类物质种类系统、全面的研究,关于青金桔在发酵前后酚类物质的变化情况尚不不清楚,青金桔酚类物质对α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶等消化相关酶活性抑制情况也未见报道,这对青金桔的深加工及综合利用影响较大。非靶向代谢组学技术具有高通量、高灵敏度、检测范围广等特点,可最大程度检测样品中的代谢物,从而较为全面地反映样品的总代谢物特征,其在动植物代谢研究方面被广泛应用[14-16]。
为全面、系统地阐明青金桔酚类物质种类及自然发酵对青金桔酚类物质变化、消化相关酶活性抑制情况。本研究对青金桔全果浆进行自然发酵,比较了发酵前后青金桔可溶性总酚、总黄酮、结合酚含量及抑制α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶活性的变化情况。基于超高效液相色谱-四极杆/静电场轨道阱傅里叶转换联用质谱仪(UPLC-Q Exactive Orbitrap-MS)代谢组学技术,对自然发酵前后酚类物质种类、酚类差异代谢物及其代谢通路进行分析,最后利用相关系数分析探讨酚类差异代谢物与可溶性总酚、α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶抑制率的相关关系,为自然发酵在青金桔加工中的应用提供参考。
1 材料与方法
1.1 材料与仪器
青金桔 海南青金桔食品科技有限公司;甲醇色谱纯,德国CNW 公司;甲酸 色谱纯,上海阿拉丁生化科技股份有限公司;乙腈(色谱纯)、α-淀粉酶(≥5 units/mg,来源于猪胰)、胰脂肪酶(8×USP)、4-硝基苯基乙酸酯(分析纯) Sigma-aldrich 西格玛奥德里奇(上海)贸易有限公司;α-葡萄糖苷酶(≥50 units/mg,来源于酵母)、对硝基苯基-α-D-吡喃葡萄糖(分析纯) 上海源叶生物科技有限公司。
DMM-40 型胶体磨 上海秦硕化工机械设备有限公司;LGJ-10NS/GC 型冷冻干燥机 北京亚星仪科科技发展有限公司;CenLee16X 台式高速离心机 湖南湘立科学仪器有限公司;PLUS-E2-20TJ 实验室级超纯水机 南京易普易达科技发展有限公司;FlexA-200 酶联免疫分析仪 杭州优米仪器有限公司;UPLC-Q Exactive Orbitrap-MS 超高效液相色谱-四极杆静电场轨道阱傅里叶转换联用质谱仪Thermo Fisher Scientific 公司。
1.2 实验方法
1.2.1 青金桔全果浆发酵样品的制备 青金桔清洗晾干后,全果打浆,过筛,放入发酵罐中自然发酵10 d。分别在未发酵(A 组)以及发酵10 d 后(B 组)取样,4 个生物学重复分别命名为A1、A2、A3、A4 和B1、B2、B3、B4。取样后样品存放于-80 ℃冰箱中12 h,取出冷冻干燥12 h,装入带有磨口的棕色瓶中,-18 ℃储存,备用。
1.2.2 可溶性总酚提取及样液制备
1.2.2.1 可溶性总酚提取 酚类物质提取参考Rodríguez 等[15]的方法,并进行了适当修改,具体方法如下。准确称取冷冻干燥后的样品0.2 g 于15 mL 离心管中,加入10 mL 70%甲醇浸泡,将样品置于超声清洗器中,360 W、50 ℃超声30 min。样品提取液用0.22 μm 孔径滤膜过滤。
1.2.2.2 UPLC-Q Exactive Orbitrap-MS 测试样液制备 取以上部分提取液于1.5 mL 离心管中,-40 ℃静置1 h,于4 ℃、12000 r/min 下离心15 min。移取200 μL 上清,上机测定。质控样(quality control samples)由等量A、B 组总酚提取液混合制备而成。
1.2.3 总酚含量的测定 方法参考Lou 等[6],并进行适当修改。具体如下,125 μL 上述提取液或标准物质与125 μL 的福林酚试剂(Folin &Ciocalteu 酚试剂)反应3 min。混合物加入到1.25 mL 20%的Na2CO3溶液中,室温条件下、黑暗环境反应30 min,过0.22 μm 孔径滤膜,取200 μL 于750 nm 处测定吸光值。以70%甲醇溶液为空白,标准物质为没食子酸(GA)(50~500 μg/mL)。总酚以mgGA 当量/100 g 冻干样品表示。每个样品测试4 次,取平均值。
1.2.4 总黄酮测定 方法参考Lou 等[7],并进行适当修改。具体如下,取可溶性总酚提取液500 μL 置于2 mL 离心管中,向其加入30 μL 5% NaNO2溶液,振荡摇匀,置于室温条件下5 min;继续加入30 μL 的10% AlCl3溶液,振荡摇匀后置于温室下放置6 min;加入200 μL 1 mol/L NaOH 溶液,最后用70%甲醇溶液将反应混合液总体积定容至1 mL;将溶液再次振荡混匀,在室温下反应30 min。用酶标仪测定其在510 nm 处的吸光度。以70%甲醇溶液作为空白对照,用20.0~100.0 μg/mL 芦丁作为标准黄酮化合物,绘制芦丁的标准曲线。样品中总黄酮含量以mg芦丁/100 g 冻干样表示。
1.2.5 结合态多酚测定 方法参考Multari 等[17],并进行适当修改。具体如下,取上述可溶性总酚提取后剩余滤渣,转入真空冷冻旋转蒸发仪中,于50 ℃的条件下蒸干。加入10 mol/L NaOH 溶液2 mL(渣:NaOH 溶液=1:10,W/V),室温条件下水解16 h,溶液再用HCl(10 mol/L)调整pH 至2.5,释放的酚类采用5 mL 冷的乙醚(DE)和乙酸乙酯(EA)混合物(DE/EA,1:1,V/V)进行振荡萃取15 min,4000 r/min 离心10 min,以上重复3 次。合并3 次所得的DE/EA 层,采用真空旋转蒸发仪50 ℃干燥,干燥后样品溶入一定量色谱级甲醇中,溶液保存于带有磨口的棕色试剂品中,于-18 ℃储存待用。后续测定方法参考本文中1.2.3。
1.2.6 消化相关酶抑制率的测定
1.2.6.1α-淀粉酶抑制率的测定 方法参考Fu 等[18],并进行适当修改。将250 μL、50 U/mL 的猪胰腺α-淀粉酶溶液(溶于20 mmol/L pH6.9 磷酸盐缓冲液)与200 μL 提取液在37 ℃水浴中孵育10 min,加入1%可溶性淀粉溶液160 μL,于37 ℃水浴条件下反应15 min,加入100 μL DNS 溶液终止以上反应。以上混合液于沸水浴中反应5 min,取出冷却,取150 μL 于波长540 nm 处测定其吸光值。
式中:IR 表示α-淀粉酶抑制率,%;ABS控制表示酶与底物反应的吸光值;ABS控制空白表示不加酶时底物的吸光值;ABS样品表示样品、酶与底物反应的吸光值;ABS样品空白表示样品与底物反应的吸光值。
1.2.6.2α-葡萄糖苷酶抑制率的测定 参考Fu 等[18]的方法,并进行适当修改。10 μL 提取液与50 μLα-葡萄糖苷酶(1.0 U/mL 溶于0.1 mol/L pH6.8 的磷酸盐缓冲液中)添加到96 孔板中,振动均匀,于37 ℃条件下孵化15 min。然后将50 μL 的pNPG(5 mmol/L溶于0.1 mol/L pH6.8 的磷酸盐缓冲液中)添加到96 孔板中,振动均匀,继续于37 ℃条件下孵化15 min。添加150 μL 0.5 mmol/L 的碳酸钠溶液终止反应,于415 nm 处测吸光值。酶活力以从pNPG 中释放的p-硝基酚表示。
式中:IR 代表α-葡萄糖苷酶抑制率,%;ABS控制代表酶与底物反应的吸光值;ABS控制空白表示不加酶时底物的吸光值;ABS样品表示样品、酶与底物反应的吸光值;ABS样品空白代表样品与底物反应的吸光值。
1.2.6.3 胰脂肪酶抑制率的测定 方法参考Podsędek 等[19],并进行适当修改。配制50 mmol/L 4-硝基苯基乙酸酯,再用纯水稀释至10 mmol/L。猪胰脂肪酶用水溶解为10 mg/mL,13000 r/min 离心5 min,取上清液。反应体系如下:10 μL 提取液、50 μL 脂肪酶、140 μL 0.1 mol/L Tris 缓冲液(pH7.4),37 ℃孵育10 min,再加入50 μL 10 mmol/L 的4-硝基苯基乙酸酯。37 ℃反应15 min 后于400 nm 处测其吸光度。胰脂肪酶抑制率为:
式中:IR 为胰脂肪酶抑制率,%;ABS控制表示酶与底物反应的吸光值;ABS控制空白表示不加酶时底物的吸光值;ABS样品表示样品、酶与底物反应的吸光值;ABS样品空白表示样品与底物反应的吸光值。
1.2.7 UPLC-Q Exactive Orbitrap-MS 测定酚类物质种类及相对含量 色谱条件:色谱柱为ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm);柱温为40 ℃;流速0.3 mL/min;流动相组成A:水(0.05%甲酸),B:乙腈(100%);进样量:5 μL,自动进样器温度4 ℃;采用梯度洗脱,程序如下:0~1.0 min,95%A;1~12.5 min,95%~5% A;12.5~13.5 min,5% A;13.5~13.6 min,5%~95% A;13.6~16.0 min,95% A。质谱检测参数:采用一级全扫描(Full Scan,m/z 70~1050)与数据依赖性二级质谱扫描(dd-MS2,TopN=10),分辨率:70000(一级质谱)&17500(二级质谱);碰撞模式为高能量碰撞解离(HCD);加热器温度300 ℃、毛细管温度为350 ℃、鞘气流速为45 arb、辅助气流速为15 arb、尾气流速为1 arb;正离子模式时电喷雾电压为3.0 kV、S-Lens RF Level 为30%;负离子模式时电喷雾电压:-3.2 kV、S-Lens RF Level 为60%。
1.3 数据处理
可溶性总酚含量、消化相关酶抑制率及UPLCQ Exactive Orbitrap-MS 测试均进行4 次生物学重复,其中可溶性总酚含量及消化相关酶抑制率结果均以平均值加减标准差表示。
UPLC-Q Exactive Orbitrap-MS 非靶向代谢组学数据分析均在美吉生物云平台(https://www.majorbio.com/web/www/index)进行处理。对单个峰进行过滤,只保留单组空值不多于50%或所有组中空值不多于50%的峰面积数据。采用最小值二分之一法填补原始数据中的缺失值,利用总和法进行归一化。处理后的数据通过与HumanMetabolome Database(HMDB)(http://www.hmdb.ca)、Metlin(https://metlin.scripps.edu)、massbank(http://www.massbank.jp/)、mzclound(https://www.mzcloud.org/)等数据库及自建数据库进行比对,对酚类物质进行定性。采用正交偏最小二乘法判别分析(OPLS-DA)对差异酚类物质进行筛选,差异酚类物质上传至KEGG 网站,进行功能通路及通路富集分析。
2 结果与分析
2.1 自然发酵前后青金桔可溶性总酚、总黄酮、结合酚及抑制α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶活性变化
α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶是人体中与消化相关的关键酶,对其活性的抑制可减少膳食中糖脂类物质的吸收,对预防Ⅱ型糖尿病、改善肥胖具有促进作用[20]。自然发酵对青金桔可溶性总酚、总黄酮、结合酚及抑制α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶活性的影响结果见图1。由图1 可知,自然发酵可使可溶性总酚、总黄酮、结合酚含量及对α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶的抑制率均显著上升(P<0.05),其中总酚含量、总黄酮、结合酚分别提升9.20%、23.68%、31.18%,α-淀粉酶、α-葡萄糖酶及胰脂肪酶抑制率分别提升11.90%、12.64%、28.50%。本次实验结果与Kim 等[21]、董玉婷等[22]研究结果一致。发酵过程中酵母、乳酸菌等微生物,可合成、释放纤维素酶、β-糖苷酶等水解酶,断裂酚类与植物细胞壁结构物质间、糖类及肽类间的化学键,促使不溶性结合态多酚转化为可溶性多酚,缀合态多酚转化为游离态多酚,增加可溶性总酚含量、提升其功能活性[12,17]。本研究中发酵后结合酚含量没有因转化为可溶性酚类而降低,反而呈现显著增加(P<0.05)。其原因可能是发酵等加工使植物细胞壁结构被破坏,结合酚更容易被提取,此结果也与Lou 等[7]、Multari等[17]研究结果一致。
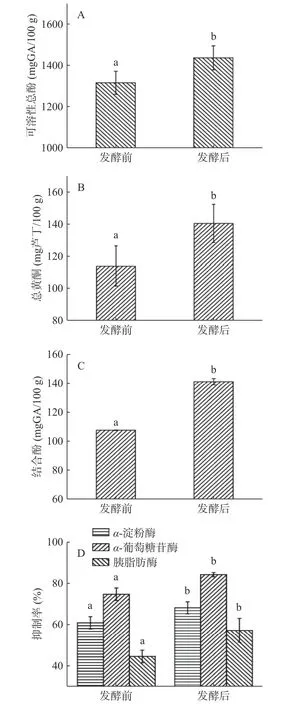
图1 自然发酵前后青金桔可溶性总酚、总黄酮、结合酚及抑制α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶活性变化Fig.1 Changes of soluble total phenol,total flavone,bound phenol and inhibitory activities of α-amylase,α-glucoase and pancreatic lipase of Citrus microcarpa before and after natural fermentation
2.2 自然发酵前后青金桔酚类物质的鉴定
基于UPLC-Q Exactive Orbitrap-MS 对自然发酵前后青金桔酚类物质进行测定,利用HMDB、Metlin、massbank、mzclound 及自建数据库对自然发酵前后青金桔酚类物质进行定性,发酵前后总离子流图如图2,鉴定到的酚类物质种类结果见表1。在正、负离子模式下从自然发酵青金桔中共检测出52 种酚类物质,与未发酵青金桔酚类物质种类一致,即自然发酵未改变酚类物质种类。青金桔酚类物质中,黄酮类物质种类最多,达到了18 种,其次为酚酸类8 种,二氢黄酮类7 种,香豆素类6 种,二氢査耳酮类5 种,黄酮醇类2 种,异黄酮、木质素类及花青素类均为1 种,其他酚类3 种。Roowi 等[23]基于HPLC-PDA-MS2对青金桔中酚类物质进行了定性,确定了根皮素-3',5'-二-C-β-葡萄糖苷、橙皮苷、维采宁-2 等7 种酚类物质;Lou 等[7]对不同溶剂提取的青金桔酚类进行了测定,共检测到类黄酮物质6 种,酚酸类物质5 种。本次实验结果涵盖了已报道青金桔中所有的酚类物质种类[1],并首次在青金桔中发现了异鼠李素、牡荆素、枇杷苷等30 种酚类物质。
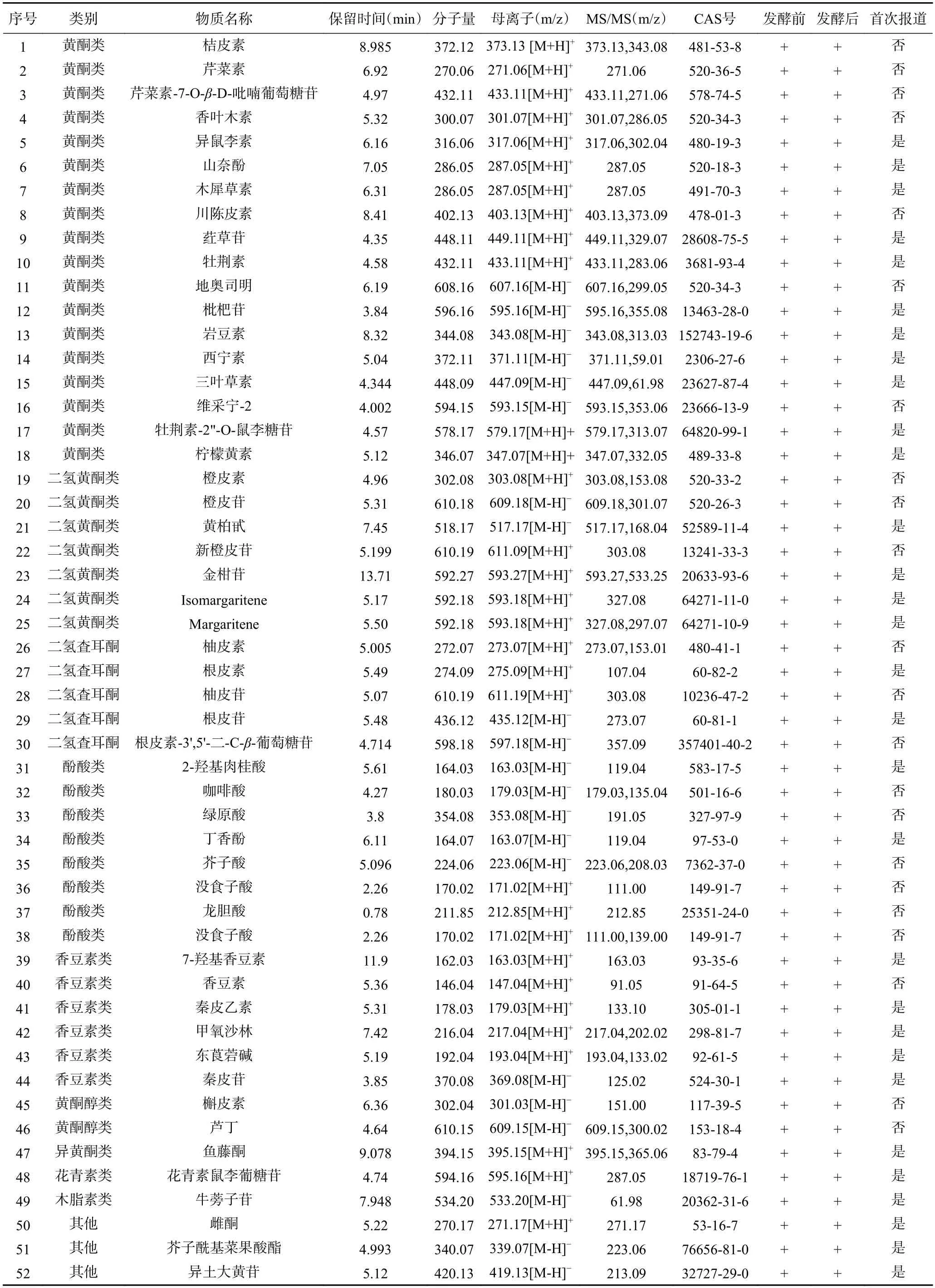
表1 自然发酵前后青金桔中酚类物质种类Table 1 Types of phenols in Citrus microcarpa before and after natural fermentation
图2 青金桔自然发酵前后酚类提取物总离子流图Fig.2 TIC of phenolic extract of Citrus microcarpa before and after natural fermentation
2.3 自然发酵前后青金桔酚类物质差异性分析
2.3.1 青金桔酚类物质主成分分析 主成分分析(principal component analysis,PCA)得分图可反映样品的相似性程度,图中样品越聚集,表明样品相似性越强。由图3 可知,质控样(quality control samples,QC)样品聚集性较高,表明仪器设备运行稳定、实验方法可靠、数据质量高。A、B 组样品聚集程度都较高,其中A 组样品分布于PCA 图中左上角,B 组样品分布于右上角,且第一主成分(PC1)和第二主成分(PC2)的解释率分别为83.85%、7.84%,两者累计贡献率达到91.69%。因此,A、B 组中各组内样品间重复性较好,A、B 组间样品差异显著,自然发酵处理可有效改变青金桔酚类物质组成。
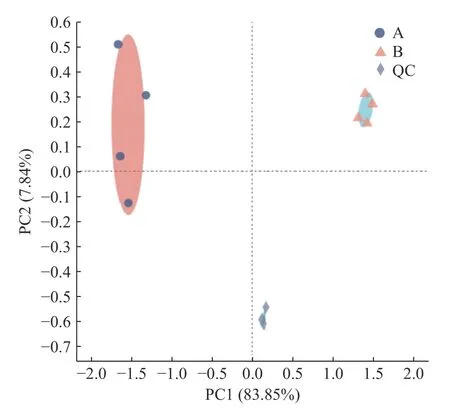
图3 自然发酵前后青金桔酚类物质PCA模型的得分图Fig.3 PCA scores of phenolic substances of Citrus microcarpa before and after natural fermentation
2.3.2 自然发酵前后青金桔酚类差异代谢物的筛选与分析 以PLS-DA 模型中变量影响投影值(variable influence on projection,VIP)>1、差异倍数(fold change)>1 或<0.5 且P<0.05 为标准,对自然发酵前后青金桔中酚类差异代谢物进行筛选,其结果见表2。由表2 可知,自然发酵后共有10 种酚类物质发生显著变化,占全部酚类物质种类的19.23 %,其中包括5 种黄酮类、3 种香豆素类、2 种酚酸类。差异代谢物中,除甲氧沙林下调外,其余9 种物质均上调,根据FC 值可以看出,山奈酚上调倍数最大,达到13.82,其次为芹菜素(10.99)、咖啡酸(5.02)、三叶草素(3.06)、芥子酸(2.55)、东莨菪碱(2.17)、7-羟基香豆素(1.24)、川陈皮素(1.15)、牡荆素(1.07)。
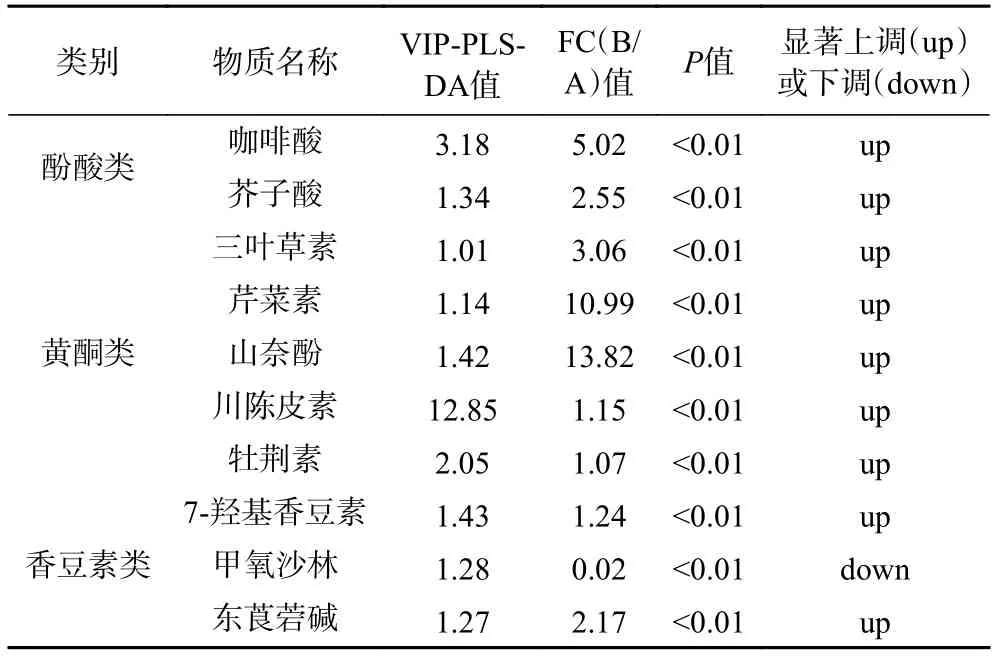
表2 自然发酵前后青金桔中显著差异的酚类物质Table 2 Significant difference of phenolic substances in Citrus microcarpa before and after natural fermentation
Hu 等[12]对固态发酵条件下不同菌种发酵柑橘果渣后酚类物质变化情况进行了测定,发现植物乳杆菌P10、枯草芽孢杆菌BF2 等单独或混合发酵均能使得糖苷类黄酮如柚皮苷、橙皮苷及苷元类黄酮如橙皮素、柚皮素、川陈皮素等含量显著增加。这一结果与本研究基本一致。而Kim 等[21]采用自然发酵剂对柑橘副产物进行液体发酵时,仅橙皮素、柚皮素等苷元类黄酮增加,而芦丁、柚皮苷等糖苷类黄酮减少。这可能与发酵方式及微生物所产酶种类有关,采用固态发酵或半固态发酵时,发酵基质等流动性差,微生物只能利用周边营养物质,故迫使其多产纤维素酶、木聚糖酶等[24],促进结合态多酚与植物细胞壁结构物质分离,糖苷类、苷元类酚类物质均增加。而液体发酵过程中,微生物可能优先产β-糖苷酶等,促使糖苷类黄酮上与葡萄糖等糖类物质链接的O-糖苷或C-糖苷等断裂,糖苷类黄酮转化为苷元类黄酮,导致糖苷类黄酮减少,苷元类黄酮增加[25]。
2.3.3 青金桔酚类差异代谢物通路富集分析 为明确哪些代谢通路在自然发酵过程中对青金桔酚类物质变化产生影响,本研究对自然发酵前后青金桔中酚类差异代谢物的代谢通路进行了富集分析,具体的代谢通路及相应的代谢物见图4 及表3。图4 中每个气泡表示一条代谢通路,气泡的大小代表该通路中富集到差异代谢物种类的多少,气泡越大,表示该通路中酚类差异代谢物种类越多。气泡所在位置和颜色表示P值大小,P值越小,颜色越红,富集程度越显著。由图4 及表3 可知,自然发酵影响青金桔酚类物质变化的代谢通路有6 条,其中显著富集的有4 条,分别为苯丙烷类化合物的生物合成通路、黄酮和黄酮醇生物合成通路、类黄酮生物合成通路及多种次生代谢产物的生物合成Ⅰ通路。该研究结果与张子洁等[26]研究结果一致。

表3 显著差异酚类物质参与的代谢途径Table 3 Metabolic pathways involved in significant differences of phenolic substances
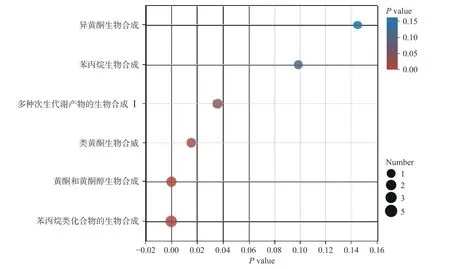
图4 自然发酵前后青金桔中差异酚类物质的KEGG 富集图Fig.4 KEGG enrichment of differential phenolic substances in Citrus microcarpa before and after natural fermentation
植物中酚类物质以糖代谢中部分中间体为前体物质,经由莽草酸途径产生苯丙氨酸,再经苯丙烷代谢途径产生香豆酰-CoA、黄酮代谢途径合成査耳酮、二氢查耳酮。二氢查耳酮作为其他黄酮类化合物的主要前体物质,经过不同的分支合成途径,最终生成黄酮、黄酮醇、异黄酮、黄烷酮和花青素等[27]。本研究富集到的显著代谢通路中包含了苯丙烷代谢途径、黄酮代谢途径及其分支代谢通路,涉及到酚类代谢差异物质有7-羟基香豆素、芹菜素、山奈酚、东莨菪碱、咖啡酸、芥子酸、牡荆素、三叶草素。本研究中未富集到莽草酸途径,可能是其核心代谢物质莽草酸、香豆酰-CoA 等作为非酚类物质未被鉴定。
因此,除多种次生代谢产物的生物合成Ⅰ通路因涉及甲氧沙林降解而可能引起可溶性总酚下降外,苯丙烷类化合物的生物合成通路、黄酮和黄酮醇生物合成通路、类黄酮生物合成通路等都与自然发酵过程中青金桔酚类物质增加有关。
2.4 青金桔酚类差异代谢物与生物活性相关性研究
α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶作为主要存在于小肠中影响人体糖脂类物质消化、吸收的关键酶,抑制其活性对防止肥胖、改善糖尿病等代谢紊乱症具有显著作用。本研究利用Spearman 相关系数分析了青金桔中酚类差异代谢物与其抑制α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶活性间的互作关系。相关性分析热图见图5。由图5 可知,除甲氧沙林外,其余9 种差异代谢物均与可溶性总酚含量及抑制消化相关酶活性呈正相关。其中,7 种酚类差异代谢物与抑制胰脂肪酶活性呈显著正相关(相关系数>0.6 且P<0.05),物质分别为川陈皮素、芹菜素、咖啡酸、山奈酚、7-羟基香豆素、芥子酸、东莨菪碱;6 种酚类差异代谢物与抑制α-葡萄糖苷酶活性呈显著正相关(相关系数>0.7 且P<0.05),物质分别为川陈皮素、芹菜素、咖啡酸、山奈酚、牡荆素、三叶草素;6 种酚类差异代谢物与抑制α-淀粉酶活性呈显著正相关(相关系数>0.6 且P<0.05),物质分别为川陈皮素、芹菜素、咖啡酸、山奈酚、牡荆素、东莨菪碱。而以上10 种酚类差异代谢物与可溶性总酚含量均未表现出显著相关性(P>0.05)。
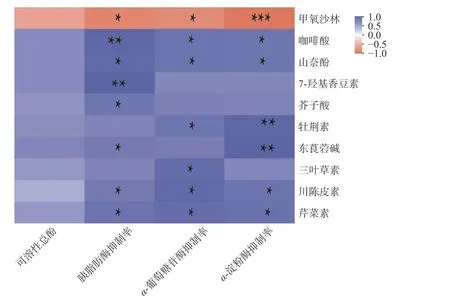
图5 青金桔酚类差异代谢物与生物活性相关性热图Fig.5 Thermal map of correlation between phenolic differential metabolites and biological activity of Citrus microcarpa
本研究中川陈皮素、芹菜素、咖啡酸、山奈酚等四种酚类对抑制α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶活性均呈显著正相关(P<0.05),由此可推测以上四种物质对消化相关酶活性具有一定抑制作用。相关研究表明,芹菜素[28]、山柰酚[28]、咖啡酸[29]对胰脂肪酶抑制的IC50值分别为4.53×10-4mol/L、2.29×10-4mol/L、0.88 mg/mL。酚类物质主要通过与酶结合,诱导酶结构发生改变,从而发挥抑制作用。酚类物质种类不同,其与酶结合的作用力也不同。Yan等[30]研究发现川陈皮素主要通过氢键与胰脂肪酶结合,而芹菜素与胰脂肪酶结合的主要驱动力是范德华力和氢键,山柰酚[28]、咖啡酸[29]为疏水作用力;芹菜素对α-淀粉酶、α-葡萄糖苷酶抑制的IC50值分别为21.66、1.43×10-5mmol/L,抑制类型均为非竞争抑制,与α-淀粉酶、α-葡萄糖苷酶之间仅有一个或一类结合位点[31]。以上研究证实,川陈皮素、芹菜素、咖啡酸、山奈酚等均能有效抑制消化相关酶活性,但其在青金桔多酚中对消化相关酶具体抑制率的贡献大小及是否对消化相关酶活性存在协同抑制作用等仍需进一步研究。
3 结论
本研究基于UPLC-Q Exactive Orbitrap-MS 代谢组学研究了自然发酵对青金桔酚类物质变化及其抑制α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶活性的影响。结果表明:自然发酵可促进青金桔中可溶性总酚、总黄酮释放,显著提升以上三种消化相关酶抑制率(P<0.05);青金桔中共检测到酚类物质52 种,自然发酵未改变酚类物质种类,但可使川陈皮素、咖啡酸、牡荆素等9 种酚类物质含量显著增加(P<0.01),其中川陈皮素、芹菜素、咖啡酸、山奈酚等四种酚类差异代谢物对抑制以上三种消化相关酶活性呈显著正相关(P<0.05)。因此,自然发酵可作为青金桔加工的一种有效手段。青金桔中酚类物质种类较多,含量相差较大,下一步将探讨酚类物质在发酵过程中绝对含量的变化情况,及川陈皮素、芹菜素等对α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶的具体抑制率的贡献大小及协同抑制效果。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

