HD2基因调控拟南芥下胚轴发育的功能研究
吴羚阁 陈功春 林娟
为探究组蛋白去乙酰化酶 HD2 基因在拟南芥下胚轴发育中的调控作用,本研究采用野生型(Col-0)、 HD2 突变体以及过表达植株为材料,研究其在1/2MS以及1/2MS+ 100 mmol/L 甘露醇培养中下胚轴的表型特征,并结合转录组测序数据进一步分析. 实验结果显示,四种过表达株系下胚轴长度较Col-0长,伸长百分比为7.1%~19.5%,差异显著;甘露醇处理后,过表达植株下胚轴较Col-0更长,伸长百分比为14.6%~32.8%,差异更加显著,缩短幅度也更小. hd2a/hd2b 和 hd2a/hd2c 双基因突变体植株在有无甘露醇时,下胚轴长度均显著短于Col-0,但干旱胁迫后变短幅度无明显增加. 转录组数据揭示, HD2 基因调控光合系统响应基因影响植株暗形态建成反应,从而影响下胚轴发育. 甘露醇处理后, HD2 基因诱导产生非生物刺激响应因子,帮助下胚轴抵抗不良环境. 综上所述, HD2 基因在拟南芥下胚轴发育中承担重要调控作用.
拟南芥; 下胚轴; 转录组; 干旱胁迫; HD2 去乙酰化酶基因
Q946.5 A 2024.016001
Functional research of HD2 gene on the regulation of hypocotyl development in Arabidopsis thaliana
WU Ling-Ge, CHEN Gong-Chun, LIN Juan
(State Key Laboratory of Genetic Engineering, School of Life Science, Fudan University, Shanghai 200438, China)
To investigate the regulatory role of the HD2 deacetylase gene in Arabidopsis hypocotyls development, this study utilized wild-type plants (Col-0), HD2 mutants and overexpression plants to investigate the phenotypic characteristics of hypocotyl in normal treatment (1/2MS) and drought treatment (1/2MS+100 mmol/L mannitol) and further analyzed them based on transcriptome sequencing data. The experimental results showed that the hypocotyl lengths of the four overexpression plants was longer than that of Col-0 plants, and the elongation percentages ranging from 7.1% to 19.5%, with significant difference. And the hypocotyl lengths of the overexpression plants treated with mannitol were longer than those of Col-0 plants, with an elongation percentages ranging from 14.6% to 32.8%. The difference was more significant, and the shortening amplitude was also smaller. However, the hypocotyls length of double-genes mutants ( hd2a/hd2b and hd2a/hd2c ) were significantly shorter than that of Col-0 under both conditions, and the shortening amplitude was not significantly increased after drought stress. Further transcriptome data analysis revealed that the HD2 gene affected hypocotyls development by regulating multiple photoperiod response genes and influencing plant skotomorphogenesis. Moreover, after mannitol treatment, the HD2 gene induced the production of abiotic stimulus response factors, helping the hypocotyls resist adverse environments. In summary, the HD2 gene plays an important regulatory role in Arabidopsis hypocotyl development.
Arabidopsis thaliana ; Hypocotyl; Transcriptome; Drought stress; HD2 deacetylase gene
1 引 言 植物下胚轴是连接植物茎和根的分界区域,具有结构简单、个体变异性低等特点 [1] . 下胚轴的这些特性使其成为细胞伸长机制的分子遗传学研究模型和信号转导网络研究系统的经典材料 [2,3] . 下胚轴同时承担着重要的养分运输任务,其能否正常伸长决定了植物子叶能否出土,进而参与光合作用 [4] ,因此下胚轴对于植物的生长与发育具有重要意义 [5] . 下胚轴的生长不仅受光照、温度、植物激素等因素的影响,还受到表观遗传调控作用的影响,特别是组蛋白的乙酰化调控 [6, 7] . 组蛋白乙酰化修饰作用受组蛋白乙酰转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylases,HDAC/HDA)的控制,组蛋白乙酰化和去乙酰化之间的平衡作用使染色质的结构不断发生变化,从而调节基因的表达水平 [8] . HDAC 是一个基因超家族,在拟南芥中已经鉴定到18个成员,分属于3个亚家族: RPD3/HDA1 (Dependency 3/Histone Deacetylase), SIR (Silent Information Regulator 2)和 HD2 (Histone Deacetylase 2),在植物生长发育和逆境胁迫反应中均具有十分重要的调控作用 [9] . 已有研究显示 HDAC 家族基因能调控植物下胚轴的发育,如 HDA15 基因属于 RPD3/HDA1 亚家族,在红光和远红光条件下,该基因的突变体株系 hda15-1 的下胚轴较Col-0植株长 [10] ;该基因的过表达株系幼苗是短下胚轴表型,表明 HDA15 基因能抑制下胚轴的生长,并且发现 HDA15 可以负调控下胚轴伸长相关基因的表达 [11] ;在高温处理条件下,也显示相同的表型 [12] . HDA19 基因,也属于 RPD3/HDA1 亚家族,该基因突变体 hda19 在各类光处理条件下,显示出短的下胚轴表型 [13] . 上述结果显示不同的 HDAC 家族基因在调节下胚轴功能时具有不同的作用.
HD2 亚家族是植物特有的一类组蛋白去乙酰化酶,共有四个成员,分别为 HD2A , HD2B , HD2C 和 HD2D [14] . 之前的研究表明,该家族成员参与调控拟南芥根的发育 [15,16] 、种子萌发与休眠 [17, 18] 以及生殖发育 [19-21] 等过程,并且这些表型的变化与各种逆境胁迫有一定的相关性 [22-24] . 然而 HD2 亚家族基因影响下胚轴表型的报道较少. 为了探究 HD2 亚家族各个成员在下胚轴发育中的作用以及干旱胁迫下的响应,本研究以拟南芥野生型(Col-0),T-DNA插入突变体( hd2a , hd2b , hd2c , hd2d , hd2a/hd2b , hd2a/hd2c )和四个过表达株系为材料,通过表型和转录组分析,探究了 HD2 亚家族成员在植物下胚轴发育中的作用,这一研究为揭示 HD2 亚家族基因在植物下胚轴发育中的重要作用提供理论依据.
2 材料与方法
2.1 实验材料
拟南芥野生型种子Col-0(Columbia生态型),T-DNA插入突变体 hd2a (CS348580)、 hd2b (SALK_049380C)、 hd2c (SALK_129799C)和 hd2d (SALK_104071C)均购自Arabidopsis Biological Resource Center at Ohio State University(ABRC, http://abrc.osu.edu ). hd2a/hd2b , hd2a/hd2c 双基因突变体植株经不同的单突变植株杂交获得. 四种过表达转基因纯合植物 HD2A-OE , HD2B-OE , HD2C-OE 和 HD2D-OE ;带有GUS基因的转基因株系 HD2B-GUS 由本实验室构建.
2.2 实验方法
2.2.1 拟南芥种子的消毒与培养 将拟南芥种子置于无菌超净台中,用75%的酒精消毒,上下震荡不少于60次,重复消毒3次,然后使用无菌水洗涤,上下震荡不少于60次,重复洗涤3次. 将不同种子均匀点在1/2MS培养基上,封口膜密封后放入4 ℃冰箱春化3 d,春化结束后,放入22 ℃恒温培养箱在黑暗条件下竖直培养3 d后,将1/2MS培养基上的幼苗一半转移至附加100 mmol/L甘露醇的1/2MS培养基上,一半继续留在1/2MS培养基上,封口膜密封后,用锡箔纸将培养基包裹,放入培养箱在黑暗条件下竖直培养2d,观察其表型、统计下胚轴长度、RNA提取以及后续的转录组测序.
2.2.2 拟南芥下胚轴的GUS染色观察 参考Wu等人的方法 [25] ,将带有 GUS 基因的转基因植株消毒洗涤处理后,均匀点在1/2MS及1/2MS附加100 mmol/L甘露醇培养基上黑暗条件下生长 3 d ,将幼苗转移至新鲜配制的GUS染液中,置于 37 ℃培养箱中过夜后,在显微镜下成像观察并拍照.
2.2.3 转录组数据的获取与分析 将拟南芥Col-0, hd2a/hd2b 和 HD2B-OE 植株的种子,分别黑暗培养在1/2MS和1/2MS附加100 mmol/L甘露醇培养基中,取其5d龄幼苗送至逆耳生物有限公司进行转录组测序,此次实验得到了6个样本的转录组数据,分别对应两种不同处理条件下的3个不同拟南芥植株样本.
2.2.4 差异基因表达水平分析 使用StringTie软件对已知基因的原始序列进行统计,采用FPKM值度量基因的转录水平 [26] . FPKM计算公式为 FPKM=total fragments/mapped read(millions)* exon length(KB) [27] . 利用 DESeq 软件筛选差异表达基因,筛选条件为:|log2Fold Change| >= 1 和 Pvalue <= 0.05,筛选出的基因为差异基因,其中Fold Change为表达量的变化倍数. 使用TopGO软件对差异基因进行基因本体论GO(Gene ontology)注释和功能分类分析 [28] .
2.2.5 基因表达量的验证分析 为验证转录组测序结果,本研究使用荧光定量PCR(qPCR)技术进行实验. 首先,采用CWBIO公司的植物RNA提取试剂盒提取样品中的RNA,随后使用TaKaRa公司的反转录试剂盒将RNA反转录为cDNA. 最后,使用TaKaRa公司的TB GREEN试剂盒进行荧光定量PCR分析,以验证差异表达基因的转录水平.
2.2.6 互作网络分析 在 STRING(Search Tool for the Retrieval of Interacting Genes/Proteins)蛋白质相互作用数据库(http://string-db.org)中下载了拟南芥的蛋白质相互作用网络,并以此为基础构建了差异表达基因蛋白质相互作用网络. 随后,我们使用Cytoscape软件进行网络可视化,以便更好地展示这些相互作用关系 [29] .
3 结果与分析
3.1 拟南芥植株的下胚轴表型分析
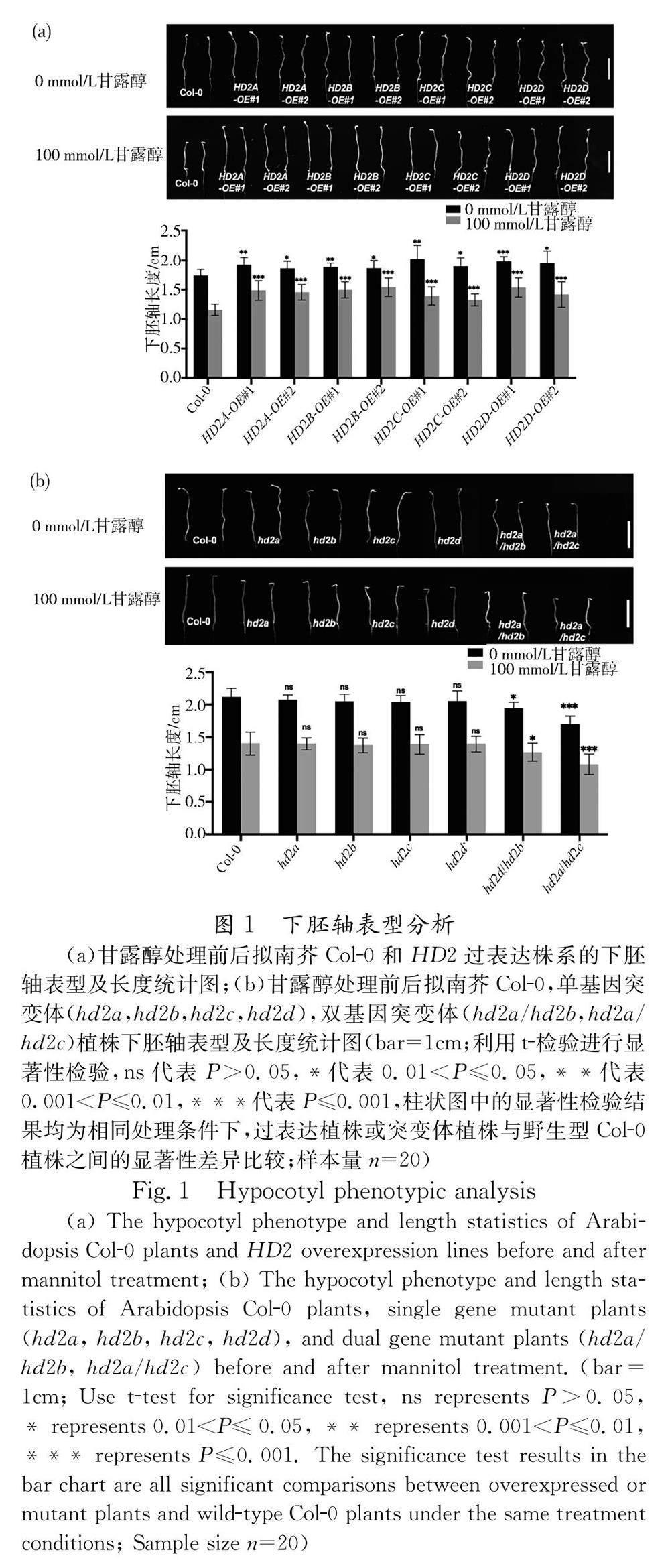
在1/2MS培养基中,四种过表达株系下胚轴长度相较Col-0植株长,伸长的百分比在7.1%~195%之间,差异显著;经甘露醇处理后,过表达植株下胚轴的长度相较Col-0植株长度变化更明显,伸长百分比在14.6%~32.8%之间,差异更加显著(图1a).Col-0植株在甘露醇处理后相对甘露醇处理前下胚轴长度的缩短幅度为33.33%, 而四种过表达植株在甘露醇处理后的缩短幅度在17.2%~ 30.69%之间(表1),说明 HD2 过表达植株下胚轴长度的缩短幅度相比野生型更小;突变体植株中只有 hd2a/hd2b 和 hd2a/hd2c 两种双基因突变体植株的下胚轴长度相比野生型缩短明显,1/2MS培养条件下分别缩短8.0%、20.8%,甘露醇处理条件下分别缩短9.3%、22.9%,差异均显著(图1b).然而对比甘露醇处理前后,Col-0植株和 hd2a/hd2b 、 hd2a/hd2c 两种双基因突变体植株下胚轴长度的缩短幅度分别为33.96%、34.87%、35.71%,突变体植株的缩短幅度与野生型差异性不大(图1b). 由此可见, HD2 亚家族四个基因的转录表达均能够促进拟南芥下胚轴的伸长,并且在植株遭受干旱胁迫时增强下胚轴的耐受性.
3.2 HD2 亚家族基因在拟南芥下胚轴中的表达
HD2 亚家族的四个基因均可在下胚轴处表达,而在甘露醇处理后,这些基因的表达量呈现上升的趋势,其中 HD2A 和 HD2B 基因的表达量可提高2倍以上,且 HD2B 基因表达量的增加倍数最大(图2a). 此外,我们观察了 HD2B-GUS 转基因植株的GUS染色情况,结果显示,在下胚轴区域可见明显的GUS显色;经甘露醇处理后,植株下胚轴区域的GUS染色加深(图2b),表明干旱处 理会诱导 HD2B 基因在下胚轴处的表达,进一步证明 HD2 亚家族基因在拟南芥下胚轴中的重要作用.
3.3 转录组数据分析
3.3.1 转录组测序数据质量评估 数据整体质量评估见表2,所有样本原始reads数均超过3×10 7 ,Q30的碱基比例均大于90%,样本比对到基因组上的reads率均超过90%,数据表明本次测序结果良好,可以进行后续分析.
3.3.2 相同处理条件下不同样本之间差异表达基因的筛选与GO分析 采用DESeq 软件筛选在同种处理条件下,突变体和过表达株系与Col-0植株之间表达量变化在1倍以上且 P 值小于或等于005的差异基因. 在无甘露醇处理的条件下, hd2a/hd2b 和 HD2B-OE 与Col-0之间的差 异基因个数分别是183和103个(图3a);在100 mmol/L 甘露醇处理条件下, hd2a/hd2b 和 HD2B-OE 与Col-0之间的差异基因个数分别是166和76个(图3b). GO富集分析显示,在无甘露醇处理条件下,两组差异基因主要富集通路均包括在光反应、电子传递链、前体代谢产物与能量生成相关的生物学过程;叶绿体、质体等细胞组分;电子传递活性、跨膜转运蛋白活性等分子功能(图3e、3f). 有15个基因共同包含在两组差异基因数据集中(图3c),基因的具体信息见表3,其中有4个基因( PETD 、 NDHI 、 PSAC 、 YCF4 )与光反应相关、1个参与脱落酸响应的基因( DREB1A ),且经TAIR网站查阅, 这5个基因均在下胚轴处表达. 在100 mmol/L 甘露醇处理条件下,两组差异基因主要富集通路仅包括质体膜等光反应相关的细胞组分(图3g、3h). 有12个基因共同 包含在两组差异基因数据集中(图3d),基因的具体信息见表4,其中有2个基因( ERF13 、 CYP19-1 )参与各类激素响应过程、参与植株防御反应,经TAIR网站查阅,这两个基因均在下胚轴处有表达.
3.3.3 相同样本在干旱处理前后差异表达基因的筛选和GO分析 利用DESeq 软件统计了同种植株在1/2MS和1/2MS附加100 mmol/L甘露醇培养条件下的差异基因个数,在两种培养条件下,Col-0, hd2a/hd2b 和 HD2B-OE 中的差异基因分别有250,203和464个(图4a). HD2B-OE 植株在100 mmol/L甘露醇处理前后显示的差异基因最多,这一结果表明 HD2B 基因过表达后会引起更多基因表达量变化,从而影响植物的逆境响应. 对这些差异基因分别进行GO分析,结果显示三种植株中的差异基因的富集通路均包括光的应激反应、细胞分裂素等激素应答过程;叶绿体、类囊体、光复合体等细胞组分中;各类转移酶、水解酶、脱氢酶活性,叶绿素、色素结合等分子功能上(图4c~4e). 其中有14个基因同时包含在这三种植株差异基因的数据集中(图4b),具体基因信息见表5. 其中有8个基因( FLS2 、 PMAT2 、 ASN2 、 IAA19 、 EXLB1 、 LHCA1 、 HYH 、 DEG15 )参与植物体内的防御反应、水分剥夺响应、光刺激响应及对生长素等激素刺激的反应,且经TAIR网站查阅,这8个基因在下胚轴处均有表达,推测这8个基因可以响应植物的干旱胁迫,从而调控干旱环境中下胚轴的生长过程. 除上述共同的富集通路外, hd2a/hd2b 植株胁迫前后的差异基因也富集在植物器官生长调控的生物学过程中(图4e),说明 HD2A和HD2B 两个基因同时突变会影响一些器官发育进程; HD2B-OE 植株在干旱胁迫前后差异基因同时富集在对各类非生物刺激的反应通路中(图4d), 这说明过表达 HD2B 基因会引起下胚轴中逆境响应相关基因表达量的变化,帮助植株抵御不良环境影响.
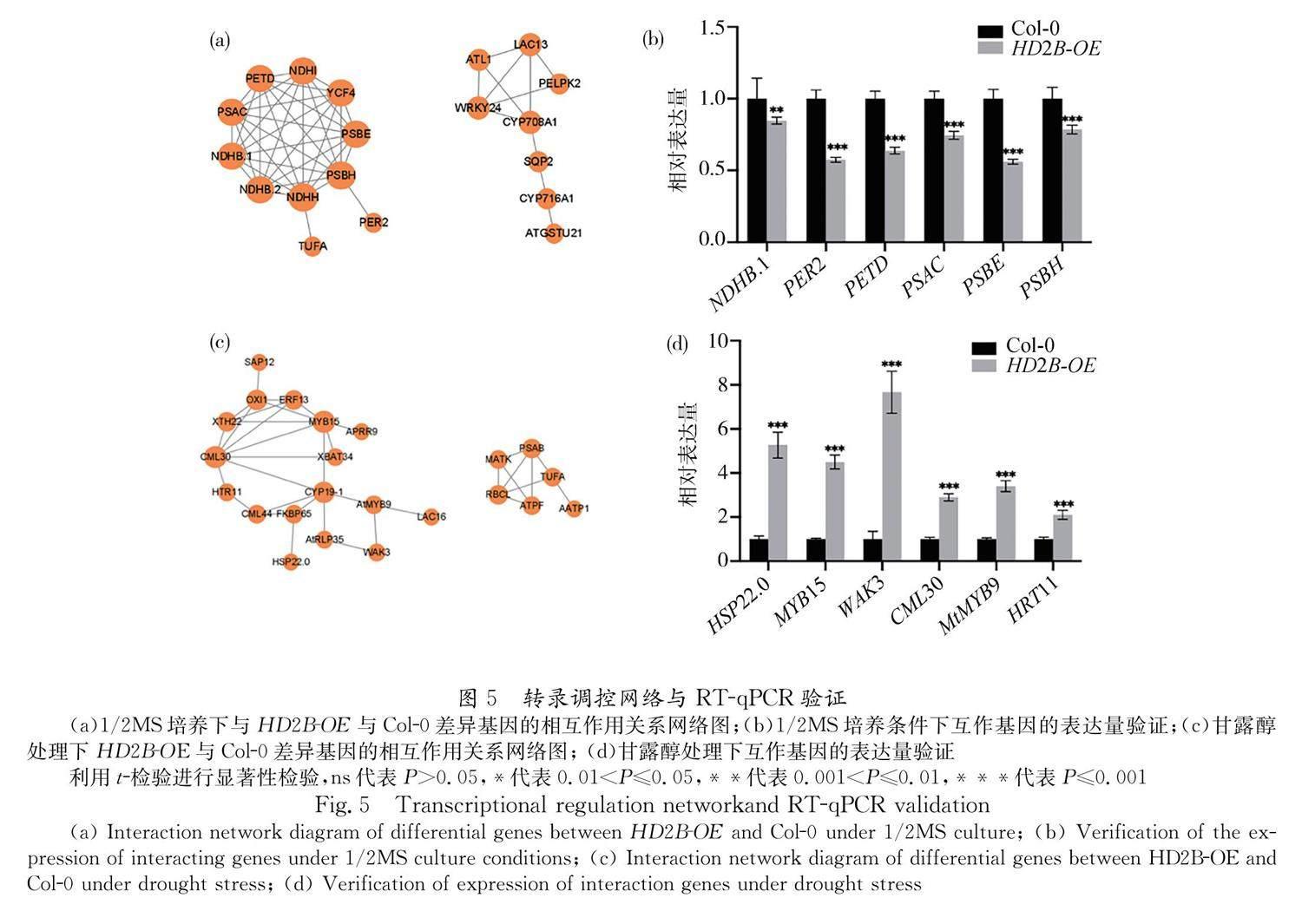
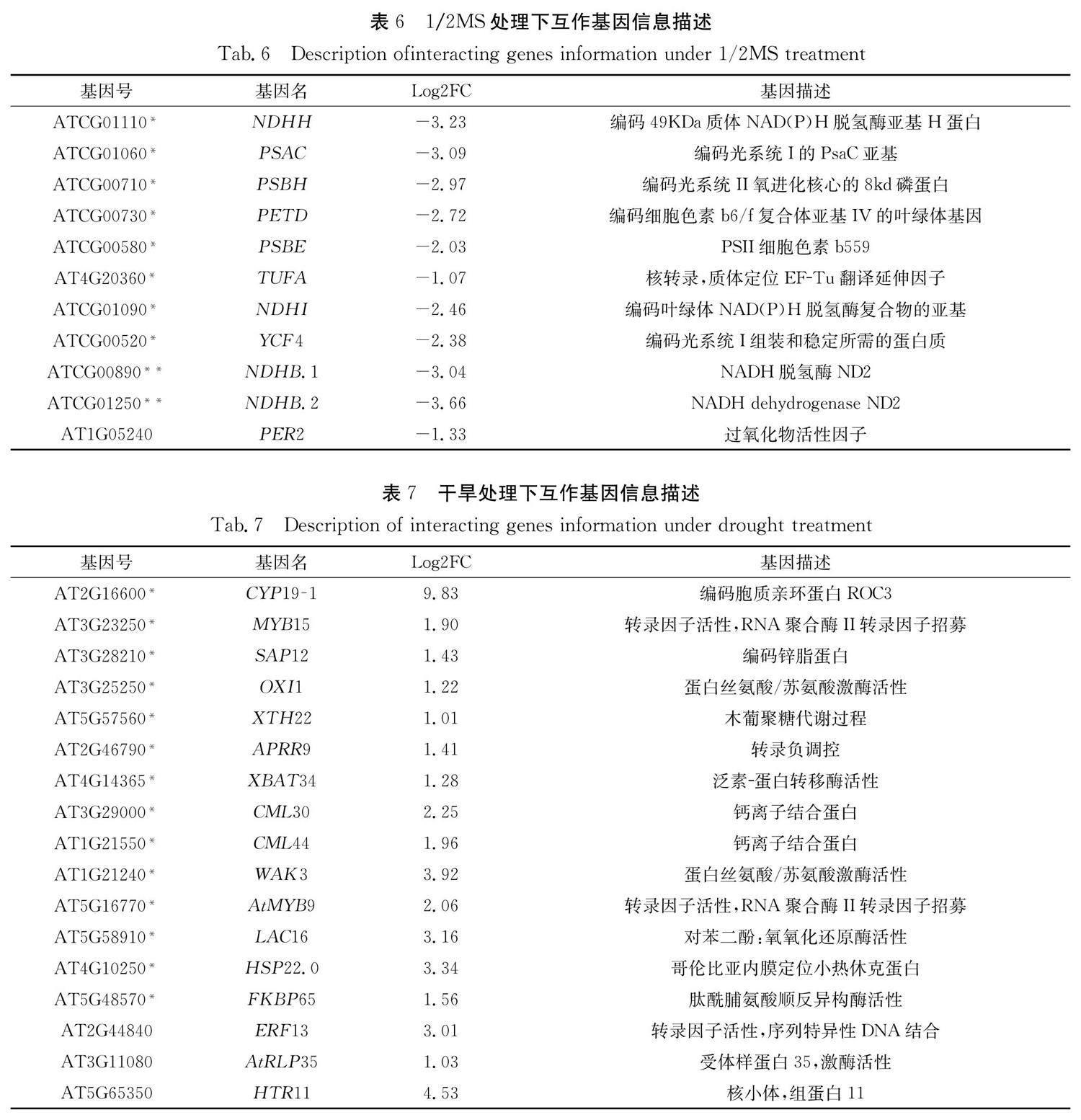
3.3.4 差异基因的相互作用网络的预测 在1/2MS培养条件下 HD2B-OE 植株与Col-0差异基因的相互作用关系网络预测如图5a所示,其中互作关系较强的11个基因的特征见表6,列表中前8个基因(*)与叶绿体和光合系统相关,后2个基因(**)与ATP合成耦合电子传递相关,而 PER2 与过氧化物酶的活性有关,且这11基因中有9个位于拟南芥叶绿体基因组中,转录组数据显示这些基因在 HD2B 过表达植株中表达量均下调. 这表明过表达 HD2B 基因可能使光合系统中叶绿体建成相关基因表达量下降,促进植株的暗形态建成反应,使下胚轴伸长. 图5c显示甘露醇处理下 HD2B-OE 植株与Col-0差异基因的相互作用关系网络预测图,表7所示为17个互作关系最强基因的特征,其中前14个基因(*)均与植物各类应激反应相关,后3个基因与信号传导以及基因表达相关. 这表明在干旱胁迫时, HD2B 基因的过表达会使抗逆相关基因表达量上调,进而增强拟南芥下胚轴的耐受性,帮助植物抵抗不良环境. 在两组差异基因的互作预测网络中分别选取6个基因,通过荧光定量PCR对它们的表达量进行验证,结果表明在1/2MS处理条件下,所选6个基因表达量均下降明显(图5b),在干旱胁迫时,所选6个基因的表达量明显上升(图5d),荧光定量PCR结果与转录组结果一致.
4 讨 论
越来越多的研究表明,组蛋白修饰在动植物基因表达调控中扮演着重要的角色,作为一类特有的植物组蛋白去乙酰化酶, HD2 亚家族基因已被证实参与调控拟南芥多种发育和逆境响应过程. 例如, hd2d 突变体可以影响拟南芥侧根的生长发育,同时在干旱胁迫下, HD2D 通过影响ABA信号通路响应干旱胁迫 [16] ; hd2c 突变体植株对盐的敏感性增加,导致盐处理下植株的萌发率和存活率降低 [23] ; HD2B 基因可被低温和种子休眠诱导表达,同时 HD2B 过表达植株可以提高种子萌发率 [17] ; HD2A 基因也会参与调节植物ABA和盐胁迫的响应,使植株萌发率降低 [18] . 这些研究表明, HD2 亚家族单基因的突变可以影响拟南芥的发育进程. 然而,在本研究中我们发现各个单基因突变体植株的下胚轴相较于Col-0并无明显变化,只有 hd2a / hd2b 或 hd2a / hd2c 两个基因同时突变时,下胚轴会明显缩短. 推测 HD 2家族内部成员之间存在着强烈的冗余作用,这一观点在之前的研究中也被证实. 例如,与 hd2a 和 hd2b 单突变体相比, hd2a/hd2b 双突变体中拟南芥初生根长度显著降低 [30] ; hd2a/hd2b 双突变体也会导致 miRNA165/166 在叶片中的分布异常,导致叶片呈现不同的表型特征 [31] . 这些结果表明 HD2A 和 HD2B 在控制根长和叶片形态方面具有叠加效应. 同时, HD2A 和 HD2C 基因在调控拟南芥种子萌发的过程中具有拮抗作用,使得 hd2a/hd2c 双突变体植株表现出萌发率更为接近野生型植株的表型 [18] ;同时, HD2A 和 HD2C 基因存在物理互作,并且 hd2a/hd2c 双突变体会加速拟南芥植株的水分流失 [32] . 这一系列的结果表明, HD 2亚家族内部存在着复杂的相互作用,2个甚至多个基因的同时敲除,才会对植物发育产生影响.
在下胚轴转录组数据的分析中,我们筛选到了5个与光合反应系统相关的基因 PETD 、 NDHI 、 PSAC 、 YCF4 、 HYH ,它们均被报道会参与影响植物光合系统的运转,与植物光形态建成密切相关 [33-37] ,但是它们对下胚轴生长发育的调控机制仍不十分清楚. 下胚轴的伸长是植物暗形态建成的产物 [38] ,因此我们推测这些与光形态建成相关基因的抑制表达可能正是促成 HD2B 过表达植株长下胚轴表型的关键因素;此外,研究也筛选到9个参与植物体内逆境响应的基因,其中 DREB1A 、 CYP19-1 参与植物体内干旱响应 [39,40] , ERF13 作为乙烯反应因子蛋白,被证实参与多种植物逆境的响应进程 [41,42] . FLS2 、 DEG15 被证实与植物免疫应答中发挥作用 [43,44] . LHCA1 可以应答拟南芥植株的冷热刺激 [45] . ASN2 参与应答盐响应过程 [46] . IAA19 作为主要生长素反应因子,参与生长素的响应过程,影响根的向地性、向光性,同时也参与干旱响应等非生物胁迫过程 [47,48] . EXLB1 可以参与细胞对含氧化合物的响应过程 [49] . 这些基因在转录组中表达量变化显著,足以说明它们参与HD2对下胚轴的发育调控通路,值得我们进一步关注并展开深入研究.
在本实验预测网络中,涉及的基因互作关系尚未被相关实验验证,然而,有研究表明PETD和PSBH是以多顺反子转录本的形式存在的,它们在翻译之前位于同一条链上,共同调控细胞色素复合体的合成 [50] ;NDHH、NDHI和NDHB则被报道共同参与NDH复合物的装配,然后进一步参与到光系统当中调控下游基因的表达 [51] ;CYP19和FKBP65会共同参与病原菌的抗病过程 [52] ;HSP22.0和FKBP65则同为热休克诱导蛋白 [53] .这些基因在HD2调控下胚轴发育中可能发挥着十分重要的作用,并很可能存在物理互作关系,值得进一步验证分析.此外,HD2亚家族基因主要通过改变染色质的组蛋白去乙酰化调控基因表达.甘露醇处理下植物基因乙酰化修饰是否会改变以及表达水平变化基因的乙酰化水平是否有变化,也是值得进一步研究的.
参考文献:
[1] Gendreau E, Traas J, Desnos T, et al . Cellular basis of hypocotyl growth in Arabidopsis thaliana [J]. Plant Physiol, 1997, 114: 295.
[2] Ragni L, Hardtke C S. Small but thick enough the Arabidopsis hypocotyl as a model to study secondary growth [J]. Physiol Plant, 2014, 151: 164.
[3] Yu Y, Huang R. Integration of ethylene and light signaling affects hypocotyl growth in Arabidopsis [J]. Front Plant Sci, 2017, 8: 57.
[4] Wang H F, Shang Q M. Molecular mechanisms of cell elongation in angiosperm hypocotyl[J]. Chin Bull Bot, 2018, 53: 276.[王红飞,尚庆茂. 被子植物下胚轴细胞伸长的分子机理[J]. 植物学报, 2018, 53: 276.]
[5] Lehmann F, Hardtke C S. Secondary growth of the Arabidopsis hypocotyl-vascular. development in dimensions. [J]. Curr Opin Plant Biol, 2016, 29: 9.
[6] Verstraeten I, Schotte S, Geelen D. Hypocotyl adventitious root organogenesis differs from lateral root development [J]. Front Plant Sci, 2014, 5: 495.
[7] Charron J, He H, Elling A A, et al . Dynamic landscapes of four histone modifications during deetiolation in Arabidopsis [J]. Plant Cell, 2009, 21: 3732.
[8] Bourque S, Jeandroz S, Grandperret V, et al . The evolution of HD2 proteins in green plants [J]. Trends Plant Sci, 2016, 21: 1008.
[9] Wu K, Tian L, Zhou C, et al . Repression of gene expression by Arabidopsis HD2 histone deacetylases [J]. Plant J, 2003, 34: 241.
[10] Liu X, Chen C Y, Wang K C, et al . PHYTOCHROME INTERACTING FACTOR3 associates with the histone deacetylase HDA15 in repression of chlorophyll biosynthesis and photosynthesis in etiolated Arabidopsis seedlings [J]. Plant Cell, 2013, 25: 1258.
[11] Zhao L M, Peng T, Chen C Y, et al . HY5 interacts with the histone deacetylase HDA15 to repress hypocotyl cell elongation in photomorphogenesis [J]. Plant Physiol, 2019, 180: 1450.
[12] Shen Y, Lei T, Cui X, et al . Arabidopsis histone deacetylase HDA15 directly represses plant response to elevated ambient temperature [J]. Plant J, 2019, 100: 991.
[13] Benhamed M, Bertrand C, Servet C, et al . Arabidopsis GCN5, HD1, and TAF1/HAF2 interact to regulate histone acetylation required for light-responsive gene expression [J]. Plant Cell, 2006, 18: 2893.
[14] Pandey R, Müller A, Napoli C A, et al . Analysis of histone acetyltransferase and histone deacetylase families. of Arabidopsis thaliana suggests functional diversification of chromatin modification among multicellular eukaryotes [J]. Nucleic Acids Res, 2002, 30: 5036.
[15] Tahir M S, Karagiannis J, Tian L. HD2A and HD2C co-regulate drought stress response by modulating stomatal closure and root growth in Arabidopsis [J]. Front Plant Sci, 2022, 13: 1062722.
[16] Zhang Z, Yang W, Chu Y, et al . AtHD2D , a plant-specific histone deacetylase involved in abscisic acid response and lateral root development[J]. J Exp Bot, 2022, 73: 7380.
[17] Yano R, Takebayashi Y, Nambara E, et al . Combining association mapping and transcriptomics identify HD2B histone deacetylase as a genetic factor associated with seed dormancy in Arabidopsis thaliana [J]. Plant J, 2013, 74: 815.
[18] Colville A, Alhattab R, Hu M, et al . Role of HD2 genes in seed germination and early seedling growth in Arabidopsis [J]. Plant Cell Rep, 2011, 30: 1969.
[19] Luo Y, Shi D Q, Jia P F, et al . Nucleolar histone deacetylases HDT1, HDT2, and HDT3. regulate plant reproductive development[J]. J Genet Genomics, 2022, 49: 30.
[20] Zhou C, Labbe H, Sridha S, et al . Expression and function of HD2-type histone deacetylases in Arabidopsis development [J]. Plant J, 2004, 38: 715.
[21] Farhi J, Tian G, Fang H, et al . Histone deacetylase HD2D is involved in regulating plant development and flowering time in Arabidopsis [J]. Plant Signal Behav, 2017, 12: e1300742.
[22] Han Z, Yu H, Zhao Z, et al . AtHD2D gene plays a role in plant growth, development, and response to abiotic stresses in Arabidopsis thaliana [J]. Front Plant Sci, 2016, 7: 310.
[23] Luo M, Wang Y Y, Liu X, et al . HD2C interacts with HDA6 and is involved in ABA and salt stress response in Arabidopsis [J]. J Exp Bot, 2012, 63: 3297.
[24] Zhao B, Shao Z, Wang L, et al . MYB44-ENAP1/2 restricts HDT4 to regulate drought tolerance in Arabidopsis [J]. PLoS Genet. 2022, 18: e1010473.
[25] Wu L, Zhou M, Shen C, et al . Transgenic tobacco plants over expressing cold regulated protein CbCOR15b from Capsella bursa-pastoris exhibit enhanced cold tolerance [J]. J Plant Physiol, 2012, 169: 1408.
[26] Mortazavi A, Williams B A, Mccue K, et al . Mapping and quantifying mammalian transcriptomes by RNA-Seq [J]. Nat Methods, 2008, 5: 621.
[27] Li A X, Zhou M Q, Wei D H, et al. Transcriptome profiling reveals the negative regulation of multiple plant hormone signaling pathways elicited by over-expression of C-repeat binding factors [J]. Front Plant Sci, 2017, 8: 1647.
[28] Zhao Y, Wang J, Chen J, et al . A literature review of gene function prediction by modeling gene ontology [J]. Front Genet, 2020, 11: 400.
[29] Fan Z, Chen J, Yang Q, et al . Network pharmacology and experimental validation to reveal the. pharmacological mechanisms of chongcaoyishen decoction against chronic kidney disease [J]. Front Mol Biosci, 2022, 9: 847812.
[30] Li H, Torres-Garcia J, Latrasse D, et al . Plant-specific histone deacetylases HDT1/2 regulate gibberellin 2-oxidase2 expression to control Arabidopsis root meristem cell number [J]. Plant Cell, 2017, 29: 2183.
[31] Ueno Y, Ishikawa T, Watanabe K, et al . Histone deacetylases and ASYMMETRIC. LEAVES2 are involved in the establishment of polarity in leaves of Arabidopsis [J]. Plant Cell, 2007, 19: 445.
[32] Tahir M S, Karagiannis J, Tian L. HD2A and HD2C co-regulate drought stress response by modulating stomatal closure and root growth in Arabidopsis [J]. Front Plant Sci, 2022, 13: 1062722.
[33] Xiao J, Li J, Ouyang M, et al . DAC is involved in the accumulation of the cytochrome b6/f complex in Arabidopsis [J]. Plant Physiol, 2012, 160: 1911.
[34] Livingston A K, Cruz J A, Kohzuma K, et al . An Arabidopsis mutant with high cyclic electron flow around photosystem I (hcef) involving the NADPH dehydrogenase complex [J]. Plant Cell, 2010, 22: 221.
[35] Shen J, Williams-Carrier R, Barkan A. PSA3, a protein on the stromal face of the thylakoid membrane, promotes photosystem I accumulation in cooperation with the assembly factor PYG7 [J]. Plant Physiol, 2017, 174: 1850.
[36] Stockel J, Oelmüller R. A novel protein for photosystem I biogenesis [J]. J Biol Chem, 2004, 279: 10243.
[37] Wei X, Wang W, Xu P, et al . Phytochrome B interacts with SWC6 and ARP6 to regulate H2A.Z deposition and photomorphogensis in Arabidopsis [J]. J Integr Plant Biol, 2021, 63: 1133.
[38] Vandenbussche F, Verbelen J P, Straeten D.Of light and length: regulation of hypocotyl growth in Arabidopsis [J]. Bioessays, 2010, 27: 275.
[39] Mishra L S, Mishra S, Caddell D F, et al . The plastid-localized AtFtsHi3 pseudo-protease of Arabidopsis thaliana has an impact on plant growth and drought tolerance [J]. Front Plant Sci, 2021, 12: 694727.
[40] Liu H, Shen J, Yuan C, et al . The cyclophilin ROC3 regulates ABA-induced stomatal closure and the drought stress response of Arabidopsis thaliana [J]. Front Plant Sci, 2021, 12: 668792.
[41] Yang C L, Huang Y T, Schmidt W, et al . Ethylene response factor109 attunes immunity, photosynthesis, and iron homeostasis in Arabidopsis leaves [J]. Front Plant Sci, 2022, 13: 841366.
[42] Zhang L, Qin L N, Zeng Z R, et al . Molecular identification of a root apical cell-specific and stress-responsive enhancer from an Arabidopsis enhancer trap line [J]. Plant Methods, 2019, 15: 8.
[43] Murakami T, Katsuragi Y, Hirai H, et al . Distribution of flagellin CD2-1, flg22, and flgII-28 recognition systems in plant species and regulation of plant immune responses through these recognition systems [J]. Biosci Biotechnol Biochem, 2022, 86: 490.
[44] Champigny M J, Isaacs M, Carella P, et al . Long distance movement of DIR1 and investigation of the role of DIR1-like during systemic acquired resistance in Arabidopsis [J]. Front Plant Sci, 2013, 4: 230.
[45] Jung C G, Hwang S G, Park Y C, et al . Molecular characterization of the cold- and heat-induced Arabidopsis PXL1 gene and its potential role in transduction pathways under temperature fluctuations [J]. J Plant Physiol, 2015, 176: 138.
[46] Maaroufi-Dguimi H, Debouba M, Gaufichon L, et al . An Arabidopsis mutant disrupted in ASN2 encoding asparagine synthetase 2 exhibits low salt stress tolerance [J]. Plant Physiol Biochem, 2011, 49: 623.
[47] Salehin M, Li B, Tang M, et al . Auxin-sensitive Aux/IAA proteins mediate drought tolerance in Arabidopsis by regulating glucosinolate levels [J]. Nat Commun, 2019, 10: 4021.
[48] Nam H, Han S, Lee S, et al . CPR5-mediated nucleo-cytoplasmic localization of IAA12 and IAA19 controls lateral root development during abiotic stress [J]. Proc Natl Acad Sci USA, 2023, 120: e2209781120.
[49] Gechev T S, Ferwerda M A, Mehterov N, et al . Arabidopsis AAL-toxin-resistant mutant atr1 shows enhanced tolerance to programmed cell death induced by reactive oxygen species [J]. Biochem Biophys Res Commun, 2008, 375: 639.
[50] Nakamura T, Meierhoff K, Westhoff P, et al . RNA-binding properties of HCF152, an Arabidopsis PPR protein involved in the processing of chloroplast RNA [J]. Eur J Biochem, 2003, 270: 4070.
[51] Peng L, Fukao Y, Fujiwara M, et al . Efficient operation of NAD(P)H dehydrogenase requires super-complex formation with photosystem I via minor LHCI in Arabidopsis [J]. Plant Cell, 2009, 21: 3623.
[52] Pogorelko G V, Mokryakova M, Fursova O V, et al . Characterization of three Arabidopsis thaliana immunophilin genes involved in the plant defense response against Pseudomonas syringae [J]. Gene, 2014, 538: 12.
[53] Palmblad M, Mills D J, Bindschedler L V. Heat-shock response in Arabidopsis thaliana explored by multiplexed quantitative proteomics using differential metabolic labeling [J]. J Proteome Res, 2008, 7: 780.
收稿日期: 2023-04-12
基金项目: 国家自然科学基金面上项目(31170287)
作者简介: 吴羚阁(1998-), 女, 黑龙江鸡西人, 硕士研究生, 研究方向为植物逆境生理学. E-mail: 20210700026@fudan.edu.cn
通讯作者: 林娟. E-mail: linjuan@fudan.edu.cn

