苦参素通过JAK2/STAT3通路抑制心肌缺血再灌注大鼠炎症反应
苗卫光 杨丽 孙志涛 李伟伟 仝飞


摘要 目的:探讨苦参素对心肌缺血再灌注(MIR)大鼠炎症反应的影响,并以Janus激酶2(JAK2)/信号转导与转录激活子3(STAT3)通路为切入点探讨其可能的作用机制。方法:将144只大鼠按随机数字表法分为6组:假手术组、模型组、维拉帕米(6 mg/kg)组和苦参素低剂量(25 mg/kg)、中剂量(50 mg/kg)、高剂量(100 mg/kg)组,每组24只。造模前7 d开始每日1次腹腔注射给药。末次给药30 min后,通过阻断左冠状动脉前降支30 min构建MIR大鼠模型。再灌注24 h后,观察心电图ST段变化,通过生物机能系统测定左心室收缩压(LVSP)、左心室舒张末期压(LVEDP)、左心室内压最大升高速率(+dp/dtmax)和最大下降速率(-dp/dtmax);分光光度法检测血浆心肌酶[肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)]活性;通过2,3,5-氯化三苯基四氮唑(TTC)染色、苏木素-伊红(HE)染色观察心肌梗死率和心肌组织病变;酶联免疫吸附实验(ELISA)法检测心肌组织炎性因子[肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)]含量;蛋白质印迹法(Western Blot)检测JAK2/STAT3通路蛋白和高迁移率族蛋白B1(HMGB1)表达。结果:苦参素预处理可明显降低MIR大鼠心电图ST段高度、LVEDP、心肌梗死率、血浆CK-MB、LDH活性、心肌组织TNF-α、IL-1β、IL-6含量及磷酸化JAK2(p-JAK2)/JAK2、磷酸化STAT3(p-STAT3)/STAT3表达比值和HMGB1相对表达量,可明显升高LVSP、+dp/dtmax、-dp/dtmax,差异均有统计学意义(P<0.05)。苦参素上述作用具有一定的剂量依赖性,苦参素高剂量组作用最强。除+dp/dtmax、-dp/dtmax外,苦参素高剂量组对其他指标的作用均优于维拉帕米组(P<0.05)。结论:苦参素可能通过抑制JAK2/STAT3通路活化而减轻MIR大鼠炎症反应,对MIR大鼠心脏功能起保护作用。
关键词 心肌缺血再灌注;苦参素;Janus激酶2/信号转导与转录激活子3通路;炎症反应;心脏功能;实验研究
doi:10.12102/j.issn.1672-1349.2024.02.009
Effect of Oxymatrine on Inflammatory Response in Rats with Myocardial Ischemia-reperfusion
MIAO Weiguang, YANG Li, SUN Zhitao, LI Weiwei, TONG Fei
Handan Second Hospital, Handan 056001, Hebei, China, E-mail: fl08858@163.com
Abstract Objective:To investigate the effect of Oxymatrine on the inflammatory response of myocardial ischemia-reperfusion(MIR) rats.Methods:According to the random number table method,144 rats were divided into 6 groups:sham operation group,model group,verapamil(6 mg/kg) group,and Oxymatrine low-dose(25 mg/kg),medium-dose(50 mg/kg),high-dose(100 mg/kg) groups,with 24 rats in each group.The rats were administered by intraperitoneal injection once a day for 7 days before modeling.Thirty minutes after the last administration,the rat left anterior descending coronary artery was blocked for 30 minutes.After reperfusion twenty-four hours,the ST segment changes of the electrocardiogram were observed,the left ventricular systolic pressure(LVSP) and end-diastolic pressure(LVEDP),the maximum rise rate of left ventricular pressure(+dp/dtmax) and the maximum drop rate of left ventricular pressure(-dp/dtmax) were detected by biological function system.The activity of myocardial enzymes[creatine kinase-MB(CK-MB) and lactate dehydrogenase(LDH)] in plasma were detected by spectrophotometry.The myocardial infarction rate and myocardial tissue lesions were observed by 2,3,5-triphenyl tetrazolium chloride(TTC) staining and hematoxylin-eosin(HE) staining.The contents of inflammatory factors[tumor necrosis factor-α(TNF-α),interleukin(IL)-1β,and IL-6] in myocardial tissue were detected by enzyme-linked immunosorbent assay(ELISA),and the expression of Janus kinase 2(JAK2)/signal transducer and activator of transcription 3(STAT3) pathway proteins and high mobility group box 1(HMGB1) were detected by Western Blot.Results:Oxymatrine pretreatment could significantly reduce ST segment height,LVEDP,myocardial infarction rate,CK-MB,and LDH activities in plasma,TNF-α,IL-1β,IL-6 contents in myocardial tissue,the expression ratio of p-JAK2/JAK2,p-STAT3/STAT3 and the relative expression of HMGB1,and it could significantly increase LVSP,+dp/dtmax,-dp/dtmax,all of the difference was significant(P<0.05).Oxymatrine pretreatment could significantly improve myocardial tissue lesions.The above effects of Oxymatrine showed certain dose dependence,and the high-dose Oxymatrine group showed the strongest effect.Except for +dp/dtmax and -dp/dtmax,the effects of Oxymatrine high-dose on other indexes were better than those of the verapamil group(P<0.05). Conclusion:Oxymatrine may reduce the inflammatory response in MIR rats by inhibiting the activation of JAK2/STAT3 pathway,and plays protective role on cardiac function in MIR rats.
Keywords myocardial ischemia-reperfusion; Oxymatrine; Janus kinase 2/signal transducer and activator of transcription 3 pathway; inflammation response; cardiac function; exeperimental study
基金项目 河北省邯郸市科学技术研究与发展计划项目(No.1823208064ZC)
作者单位 邯郸市第二医院(河北邯郸 056001),E-mail:fl08858@163.com
引用信息 苗卫光,杨丽,孙志涛,等.苦参素通过JAK2/STAT3通路抑制心肌缺血再灌注大鼠炎症反应[J].中西医结合心脑血管病杂志,2024,22(2):254-260.
通过经皮冠状动脉介入治疗(PCI)手术或溶栓治
疗使血管再通是临床治疗冠状动脉狭窄或堵塞的首选方案,但血流恢复后往往出现心脏结构和功能损伤进一步加重的现象,即心肌缺血再灌注(myocardial ischemia-reperfusion,MIR)损伤,是引发恶性心律失常、急性心力衰竭、心源性猝死等不良事件的重要因素[1-3]。MIR损伤发生机制与钙超载、氧化应激、炎症反应、线粒体损伤、细胞自噬、凋亡等密切相关[4-6],可作为MIR损伤防治研究的切入点。
苦参(Sophora flavescens Alt.)为豆科槐属草本植物,苦参以根入药,具有补气养阴、清热燥湿、杀虫止痒等功效,临床上常用于热痢便血、黄疸尿闭、湿疹湿疮等症的治疗。苦参素是苦参的主要有效成分之一,是由氧化苦参碱与少量氧化槐果碱组成的混合碱,具有调节钙稳态、抗氧化、抗炎、抗凋亡等药理学作用[7-9]。本课题组既往研究证实苦参素能够通过抑制氧化应激损伤、降低心肌细胞凋亡、保护线粒体对大鼠MIR损伤起到保护作用[10-11],但苦参素能否通过抑制炎症反应减轻大鼠MIR损伤文献报道鲜见。Janus激酶2(Janus kinase 2,JAK2)/信号转导与转录激活子3(signal transducer and activator of transcription 3,STAT3)是细胞炎症反应的重要信号通路,有文献报道苦参素能够通过JAK2/STAT3通路抑制炎症反应对自身免疫性脑脊髓炎小鼠起到保护作用[12-13]。本研究探讨苦参素对MIR大鼠炎症反应的影响,并以JAK2/STAT3通路为切入点探讨其可能的作用机制。
1 材料与方法
1.1 实验动物
144只无特定病原体(SPF)级雄性8周龄SD大鼠,购自河北伊维沃生物科技有限公司[SCXK(冀)2020-002],体质量(240±20)g,在室温(23±1)℃、相对湿度(60±5)%、光暗各半的环境中分笼饲养,饮水进食自由。本实验通过邯郸市中心医院伦理委员会审核批准。
1.2 主要药物与试剂
注射用苦参素(每瓶0.2 g)购自辽宁诺维诺制药股份有限公司;注射用维拉帕米(每瓶10 mg)购自吉林津升制药有限公司;2,3,5-氯化三苯基四氮唑(TTC,纯度≥98%)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒购自北京索莱宝生物科技有限公司;肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)检测试剂盒和苏木素-伊红(HE)染色试剂盒购自武汉博士德生物工程有限公司;JAK2、磷酸化JAK2(p-JAK2)、STAT3、磷酸化STAT3(p-STAT3)、高迁移率族蛋白B1(HMGB1)抗体购自美国Santa Cruz公司;β-actin抗体、增强型化学发光(ECL)试剂盒和二喹啉甲酸(BCA)法蛋白定量试剂盒购自北京博奥森生物技术有限公司。
1.3 主要仪器
动物呼吸机(DH -140型,上海软隆科技发展有限公司);动物心电图机(DB-3型,上海光电医用仪器厂);生物机能系统(BL-420F型,成都泰盟科技有限公司);分光光度计(SMA4000型,北京科誉兴业科技发展有限公司);多功能酶标仪(Multiskan型,美国Thermo公司);石蜡切片机(型号RM2235,德国Leica公司);组织匀浆机(S25型,德国IKA公司);垂直电泳仪(10025025 Rev A型,美国Bio-Rad公司);转膜仪(40D型,北京六一仪器有限公司);光学显微镜(E400型,日本尼康公司)。
1.4 实验方法
1.4.1 动物分组、给药及造模
144只大鼠数字编码后按随机数字表法分为6组:假手术组、模型组、维拉帕米组和苦参素低、中、高剂量组,每组24只。各组分别于造模前7 d开始每日1次给药,维拉帕米组予维拉帕米6 mg/kg腹腔注射[大鼠给药剂量根据人临床剂量换算所得,换算公式:大鼠剂量(mg/kg)=5.61×人临床剂量(mg)/体重(kg),人体重以60 kg计],苦参素低、中、高剂量组分别予苦参素25、50、100 mg/kg腹腔注射(大鼠给药剂量根据人临床剂量换算所得,低、中、高剂量相当于人临床剂量的0.5、1.0、2.0倍),假手术组和模型组腹腔注射0.9%氯化钠溶液,注射量均为5 mL/kg。末次给药30 min后,模型组、维拉帕米组和苦参素低、中、高剂量组均参照胡珍等[14]报道的方法通过阻断左冠状动脉前降支30 min构建MIR大鼠模型,左心室前壁颜色变白、心电图ST段明显抬高说明缺血成功,松开动脉夹后左心室前壁颜色逐渐红润、心电图ST段回落说明再灌注成功;假手术组行手术通路但不结扎左冠状动脉前降支。
1.4.2 心电图观察及心功能指标检测
再灌注24 h后,各组随机取8只大鼠,腹腔注射浓度3%的戊巴比妥钠溶液(40 mg/kg)实施麻醉后,通过心电图机观察心电图ST段变化;通过生物机能系统检测左心室收缩压(LVSP)、左心室舒张末期压(LVEDP)、左心室内压最大升高速率(+dp/dtmax)及最大下降速率(-dp/dtmax)。
1.4.3 血浆心肌酶活性检测
通过抗凝采血管经腹主动脉取血5 mL,4 ℃离心(3 500 r/min、离心半径8 cm)5 min取血浆,遵照相应试剂盒说明书检测血浆心肌酶CK-MB、LDH活性。
1.4.4 心肌梗死率检测
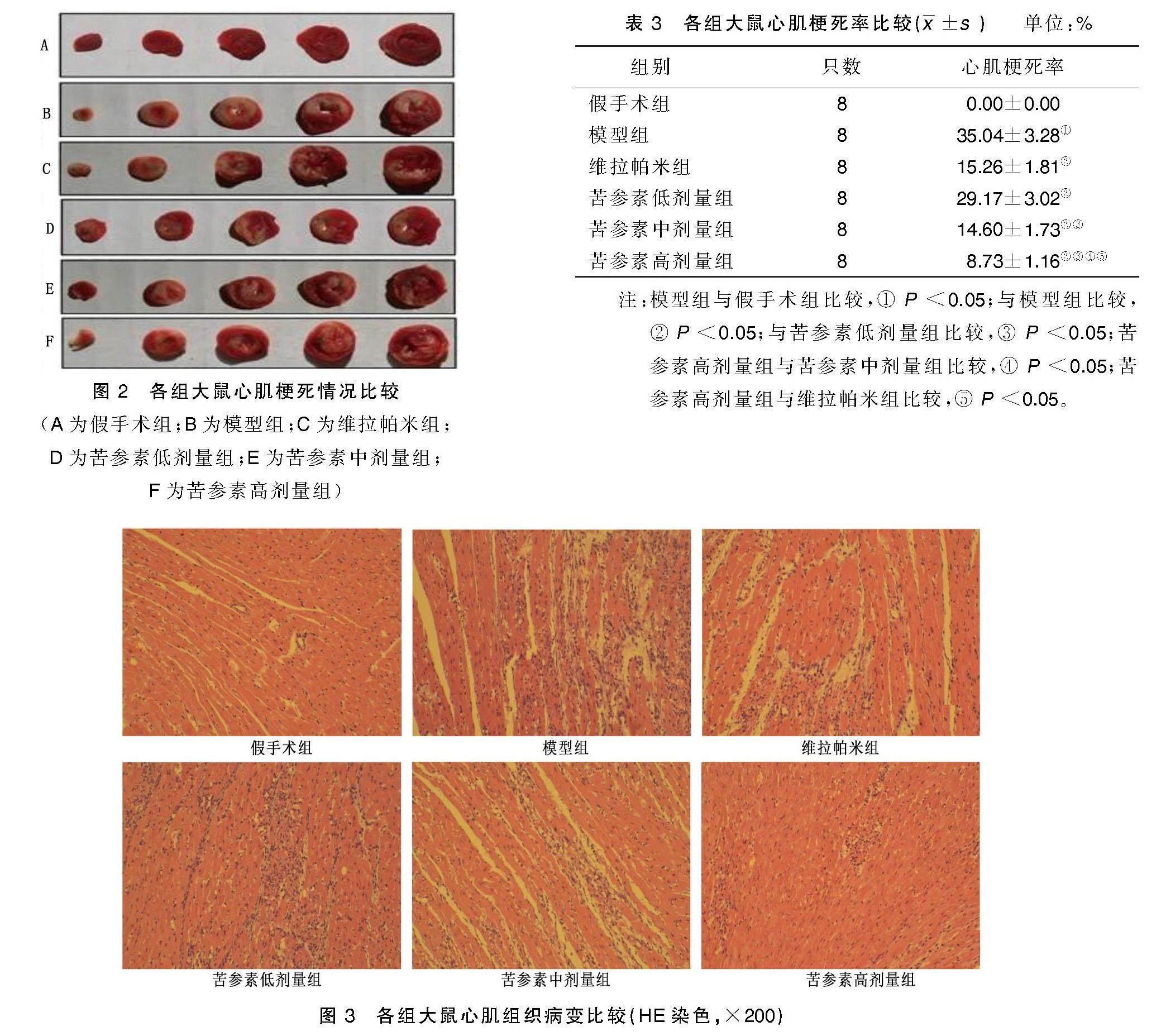
取血完成后取心脏,应用4 ℃预冷0.9%氯化钠溶液冲洗干净后,置于-20 ℃冰箱冷冻30 min,沿房室沟平行方向均匀切成5片,置于1% TTC染色液中37 ℃孵育15 min,然后4%多聚甲醛溶液固定12 h。红色为正常心肌组织,苍白色为梗死区,拍照后通过Image J图像分析软件计算心肌梗死率,心肌梗死率(%)=(梗死面积/全面积)×100%。
1.4.5 心肌组织病变观察
再灌注24 h后,另随机取各组8只大鼠,腹腔注射浓度3%的戊巴比妥钠溶液(40 mg/kg)实施麻醉,取心脏,应用4 ℃预冷0.9%氯化钠溶液冲洗干净后,以4%多聚甲醛溶液固定3 d,经石蜡包埋、4 μm切片、二甲苯脱蜡、梯度乙醇脱水后,按照HE染色试剂盒说明进行染色处理,封片后在显微镜下观察心肌组织病变。
1.4.6 心肌组织炎性因子含量检测
再灌注24 h后,取各组剩余的8只大鼠,腹腔注射浓度3%的戊巴比妥钠溶液(40 mg/kg)实施麻醉,取心脏,应用4 ℃预冷0.9%氯化钠溶液冲洗干净后,在冰上研磨匀浆后,取部分匀浆液4 ℃离心(3 500 r/min、离心半径8 cm)10 min,取上清液,遵照相应试剂盒说明检测心肌组织炎性因子TNF-α、IL-1β、IL-6含量。
1.4.7 心肌组织蛋白表达检测
取部分心肌组织匀浆液,加入蛋白提取液后冰上静置30 min,4 ℃离心(12 000 r/min、离心半径8 cm)25 min,取上清液,通过BCA试剂盒行总蛋白定量和95 ℃水浴变性后,采用蛋白质印迹法(Western Blot)检测蛋白表达:10%SDS-PAGE凝胶电泳分离蛋白、转膜、5%蛋白封闭液室温封闭1 h后,4 ℃孵育JAK2抗体(1∶1 000)、p-JAK2抗体(1∶1 000)、STAT3抗体(1∶800)、p-STAT3抗体(1∶800)、HMGB1抗体(1∶1 000)、内参β-actin抗体(1∶2 000)过夜,洗膜后室温孵育二抗1.5 h,洗膜后ECL显色,通过凝胶成像分析仪拍照及Image J图像分析软件计算蛋白条带灰度值。
1.5 统计学处理
运用软件GraphPad Prism 8.0进行统计分析,定量资料符合正态分布以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠心电图ST段比较
与假手术组相比,模型组大鼠ST段明显升高(P<0.05);与模型组相比,维拉帕米组ST段明显降低,苦参素低、中、高剂量组ST段呈剂量依赖性降低(P<0.05);与维拉帕米组相比,苦参素高剂量组ST段明显降低(P<0.05)。详见图1、表1。2.2 各组大鼠心功能指标比较
与假手术组相比,模型组大鼠LVEDP明显升高,LVSP、+dp/dtmax、-dp/dtmax明显降低(P<0.05);与模型组相比,维拉帕米组LVEDP明显降低,且LVSP、+dp/dtmax、-dp/dtmax明显升高,苦参素低、中、高剂量组LVEDP呈剂量依赖性降低,LVSP、+dp/dtmax、-dp/dtmax呈剂量依赖性升高(P<0.05);与维拉帕米组相比,苦参素高剂量组LVEDP明显降低,LVSP明显升高(P<0.05)。详见表1。
2.3 各组大鼠血浆心肌酶活性比较
与假手术组相比,模型组大鼠血浆心肌酶CK-MB、LDH活性明显升高(P<0.05);与模型组相比,维拉帕米组CK-MB、LDH活性明显降低,苦参素低、中、高剂量组CK-MB、LDH活性呈剂量依赖性降低(P<0.05);与维拉帕米组相比,苦参素高剂量组CK-MB、LDH活性明显降低(P<0.05)。详见表2。
2.4 各组大鼠心肌梗死率比较
与假手术组相比,模型组大鼠心肌梗死率明显升高(P<0.05);与模型组相比,维拉帕米组心肌梗死率明显降低,苦参素低、中、高剂量组心肌梗死率呈剂量依赖性降低(P<0.05);与维拉帕米组相比,苦参素高剂量组心肌梗死率明显降低(P<0.05)。详见图2、表3。2.5 各组大鼠心肌组织病变比较
假手术组心肌纤维条理清晰,细胞结构正常;模型组可见心肌纤维断裂、稀疏紊乱,心肌细胞肿胀,部分胞浆固缩、深染,大量炎性细胞浸润;与模型组相比,维拉帕米组心肌组织病变状况明显改善,苦参素低、中、高剂量组心肌组织病变呈剂量依赖性改善;与维拉帕米组相比,苦参素高剂量组心肌组织病变明显改善。详见图3。
2.6 各组大鼠心肌组织炎性因子含量比较
与假手术组相比,模型组大鼠心肌组织炎性因子TNF-α、IL-1β、IL-6含量明显升高(P<0.05);与模型组相比,维拉帕米组TNF-α、IL-1β、IL-6含量明显降低,苦参素低、中、高剂量组TNF-α、IL-1β、IL-6含量呈剂量依赖性降低(P<0.05);与维拉帕米组相比,苦参素高剂量组TNF-α、IL-1β、IL-6含量明显降低(P<0.05)。详见表4。
2.7 各组大鼠心肌组织JAK2、p-JAK2、STAT3、p-STAT3、HMGB1蛋白表达比较
与假手术组相比,模型组大鼠心肌组织p-JAK2、p-STAT3、HMGB1相对表达量和p-JAK2/JAK2、p-STAT3/STAT3表达比值明显升高(P<0.05);与模型组相比,维拉帕米组p-JAK2、p-STAT3、HMGB1相对表达量和p-JAK2/JAK2、p-STAT3/STAT3表达比值明显降低,苦参素低、中、高剂量组p-JAK2、p-STAT3、HMGB1相对表达量和p-JAK2/JAK2、p-STAT3/STAT3表达比值呈剂量依赖性降低(P<0.05);与维拉帕米组相比,苦参素高剂量组p-JAK2、p-STAT3、HMGB1相对表达量和p-JAK2/JAK2、p-STAT3/STAT3表达比值降低(P<0.05)。详见图4、表5。
3 讨 论
MIR损伤在中医学属于“胸痹”“心痛”等范畴,《素问·痹论篇》记载:“痹之为病,在于血凝而不流”“心痹者,脉不通,烦则心下鼓”。气滞血瘀、痰湿互结、痹阻心脉为其主要病机,宜采取滋阴益气、活血化瘀等方案治疗[15-16]。苦参为《中国药典》收录的中药品种,归心、肝、大肠经,具有补气养阴、清热燥湿等功效。苦参素是中药苦参的主要有效成分之一,具有良好的抗炎活性及其他药理学作用。本研究发现,25~100 mg/kg苦参素预处理能够明显降低MIR大鼠心电图ST段高度,改善心脏功能,降低血浆心肌酶CK-MB、LDH活性及心肌梗死率,抑制MIR大鼠心肌组织病变,并且苦参素上述作用具有剂量依赖性。维拉帕米是一种Ca2+拮抗剂,能够抑制Ca2+内流和过载对MIR大鼠心肌起到保护作用,常用作MIR相关研究的阳性对照药物[17-18]。本研究发现,100 mg/kg苦参素对心电图ST段、心脏功能、心肌梗死率、心肌组织病变的影响均明显优于维拉帕米。提示苦参素对MIR大鼠心肌组织和心脏功能具有剂量依赖性的保护作用。
MIR损伤机制较为复杂,其中炎症反应与其发生发展密切相关,Chen 等[19]研究证实预防炎症反应能够有效减轻MIR损伤。MIR过程将病理性刺激炎性因子TNF-α、IL-1β、IL-6过度表达与释放,诱发心肌组织炎症反应,并且TNF-α能够刺激粒细胞等进一步表达与释放促炎因子,IL-1β则能够诱导细胞间黏附分子上调表达,进而加重炎症反应和炎性浸润[20]。HMGB1是一种染色体结合蛋白,能够诱导TNF-α、IL-1β、IL-6等炎性因子转录表达,Foglio 等[21-22]报道MIR损伤后心肌组织HMGB1明显高表达,并且与TNF-α、IL-6等炎性因子变化特点具有一致性。JAK2属于酪氨酸蛋白激酶,在MIR过程中部分细胞因子、白细胞介素等作用于跨膜受体而诱导p-JAK2活化[23]。p-JAK2则能够识别STAT3中SH2结构域并诱导其磷酸化
活化[24]。Pan等[25]报道p-STAT3核转位后可刺激HMGB1基因表达而加重炎症反应。本研究发现,25~100 mg/kg苦参素预处理能够明显降低MIR大鼠心肌组织炎性因子TNF-α、IL-1β、IL-6含量,下调p-JAK2、p-STAT3、HMGB1相对表达量,并降低p-JAK2/JAK2、p-STAT3/STAT3表达比值,并且苦参素上述作用具有剂量依赖性,100 mg/kg苦参素对炎性因子含量、HMGB1相对表达量及p-JAK2/JAK2、p-STAT3/STAT3表达比值的影响均明显优于维拉帕米。提示苦参素对MIR大鼠炎症反应具有剂量依赖性的抑制作用,其机制可能与抑制JAK2/STAT3通路活化有关。
综上所述,苦参素可能通过抑制JAK2/STAT3通路活化而减轻MIR大鼠炎症反应,对MIR大鼠心功能起到保护作用。本研究结果为苦参素用于防治MIR大鼠心肌损伤、保护心功能提供了理论支持。
参考文献:
[1] 刘功来,杨威,王云霞,等.葛根素对大鼠心肌缺血再灌注诱导心律失常的影响及作用机制[J].基因组学与应用生物学,2020,39(7):3350-3354.
[2] GE X Y,MENG Q S,WEI L,et al.Myocardial ischemia-reperfusion induced cardiac extracellular vesicles harbour proinflammatory features and aggravate heart injury[J].Journal of Extracellular Vesicles,2021,10(4):e12072.
[3] HEIMERL M,SIEVE I,RICKE-HOCH M,et al.Neuraminidase-1 promotes heart failure after ischemia/reperfusion injury by affecting cardiomyocytes and invading monocytes/macrophages[J].Basic Research in Cardiology,2020,115(6):62.
[4] YE J X,WANG R Y,WANG M,et al.Hydroxysafflor yellow A ameliorates myocardial ischemia/reperfusion injury by suppressing calcium overload and apoptosis[J].Oxidative Medicine and Cellular Longevity,2021,2021:6643615.
[5] DING M,LI M,ZHANG E M,et al.FULLEROL alleviates myocardial ischemia-reperfusion injury by reducing inflammation and oxidative stress in cardiomyocytes via activating the Nrf2/HO-1 signaling pathway[J].European Review for Medical and Pharmacological Sciences,2020,24(18):9665-9674.
[6] CHEN W,LV L W,NONG Z H,et al.Hyperbaric oxygen protects against myocardial ischemia reperfusion injury through inhibiting mitochondria dysfunction and autophagy[J].Molecular Medicine Reports,2020,22(5):4254-4264.
[7] WANG H Q,HAN B,WANG N L,et al.Oxymatrine attenuates arsenic-induced endoplasmic reticulum stress and calcium dyshomeostasis in hepatic stellate cells[J].Annals of Translational Medicine,2020,8(18):1171.
[8] HUANG Y P,LI X L,ZHANG X,et al.Oxymatrine ameliorates memory impairment in diabetic rats by regulating oxidative stress and apoptosis:involvement of NOX2/NOX4[J].Oxidative Medicine and Cellular Longevity,2020,2020:3912173.
[9] 韩亚非,余婷.苦参素对脑缺血再灌注模型大鼠氧化应激和炎症反应的影响[J].国际中医中药杂志,2018,40(8):727-732.
[10] 陈树杰.苦参素对心肌缺血再灌注损伤大鼠氧化应激和细胞凋亡的影响[J].现代中西医结合杂志,2016,25(5):476-481;485.
[11] 杨超.苦参素对缺氧/复氧损伤乳鼠心肌细胞线粒体保护作用的研究[J].医学研究杂志,2020,49(12):83-86;93.
[12] YOU X L,JIANG X Y,ZHANG C M,et al.Dihydroartemisinin attenuates pulmonary inflammation and fibrosis in rats by suppressing JAK2/STAT3 signaling[J].Aging,2022,14(3):1110-1127.
[13] 刘楠,李纳,马晓华,等.基于JAK2/STAT3信号通路苦参素对EAE小鼠中枢小胶质细胞向M1型极化的抑制作用及机制研究[J].中国药学杂志,2021,56(11):904-911.
[14] 胡珍,陈景瑞,魏静,等.冠状动脉结扎制备大鼠心肌梗死模型及评价实验研究[J].天津中医药,2016,33(2):90-95.
[15] 宁小康,武向阳,杨志偲.益气滋阴活血方治疗急性心肌梗死PCI术后患者的疗效观察[J].中国中医急症,2019,28(11):2014-2017.
[16] 胡华,黄政德,周德生.活血化瘀法防治心肌缺血再灌注损伤的研究思路[J].中国中西医结合杂志,2010,30(12):1310-1316.
[17] 尹佳,杨若晗,赵晓东,等.蒙药广枣叶总黄酮对心肌缺血再灌注损伤模型大鼠的保护作用研究[J].中国药房,2019,30(16):2253-2257.
[18] 俞飞虎,邓媛,陈振云,等.大蒜素预处理对急性心肌缺血再灌注损伤的保护作用[J].心脑血管病防治,2020,20(5):451-455.
[19] CHEN W,WANG Y,PAN Z G,et al.Protective effects of dexmedetomidine on the ischemic myocardium in patients undergoing rheumatic heart valve replacement surgery[J].Experimental and Therapeutic Medicine,2021,21(5):427.
[20] 李萍,王静,戴成祥,等.移植前输注间充质干细胞对脑死亡供鼠移植肾炎症细胞浸润及TNF-α和IL-1β表达的影响[J].成都医学院学报,2020,15(1):40-45.
[21] FOGLIO E,PELLEGRINI L,RUSSO M A,et al.HMGB1-mediated activation of the inflammatory-reparative response following myocardial infarction[J].Cells,2022,11(2):216.
[22] 吕俊林,吕建瑞,贺进进,等.穿心莲内酯对心肌缺血再灌注损伤大鼠炎症的影响[J].湖北中医药大学学报,2020,22(2):21-25.
[23] 杨柳,陈蓓蕾,于海龙,等.JAK2/STAT3信号通路与脑缺血-再灌注损伤相关性的研究进展[J].东南大学学报(医学版),2018,37(1):169-173.
[24] GUO X W,SHEN X Y,YONG Z J.miR-101 protects against the cerebral I/R injury through regulating JAK2/STAT3 signaling pathway[J].Neuropsychiatric Disease and Treatment,2021,17:2791-2802.
[25] PAN J,ALEXAN B,DENNIS D,et al.microRNA-193-3p attenuates myocardial injury of mice with sepsis via STAT3/HMGB1 axis[J].J Transl Med,2021,19(1):386-397.
(收稿日期:2022-07-27)
(本文编辑王丽)

