二维超声联合三维血管成像对慢性子宫内膜炎的诊断价值
周毛毛,刘 玮,杨 洋,陈宥艺,刘 莉
(1.西安市第四医院,陕西 西安 710038;2.西安医学院,陕西 西安 710038;3.陕西省人民医院,陕西 西安 710038)
慢性子宫内膜炎(chronic endometritis,CE)是以子宫内膜浆细胞浸润为主要特点的一类慢性盆腔炎症,主要由病原微生物感染宫腔引起[1],通常没有明显症状,有时仅出现一些持续存在的轻微症状,例如异常性子宫出血、盆腔疼痛、性交疼痛及白带相对增多等[2-3]。由于CE症状隐匿,在临床诊疗过程中极易被忽视[4]。到目前为止,关于CE的诊断尚没有统一的标准[5],不同的诊断方法各有其优缺点,其诊断效果并不一致,急需找到一种无创且便于推广的早期诊断方法。二维超声具有经济、无创、易操作及可重复检查等优点,能够获得子宫内膜厚度、内膜回声均匀性等客观数据。而三维能量多普勒血管成像(three-dimensional power Doppler angiography,3D-PDA)是近年来兴起的超声成像技术,可观察子宫内膜血管分布及血流情况[6]。本研究探讨了经阴道二维超声联合3D-PDA检查子宫内膜形态及血流参数对CE的诊断价值。
1 资料与方法
1.1 一般资料
选取 2023年1月至2023 年8月西安市第四医院行宫腔镜检查女性,病理结果诊断为慢性子宫内膜炎的119例女性为CE组,病理结果无慢性子宫内膜炎的91例女性为对照组。纳入标准:年龄20~40岁;排除标准:①子宫内膜异位症;②子宫粘膜下肌瘤、子宫内膜癌;③子宫畸形;④合并肝、肾或者心血管及血液疾病,严重心理或精神疾病。参与本次研究的所有女性对研究内容知情,并自愿签署同意书。本研究已取得本院伦理委员会批准(编号:KJLL-Z-K-2023072)。
1.2 研究方法
1.2.1 宫腔镜检查
术前30min给予患者间苯三酚80mg肌注,患者取截石位。常规消毒外阴、阴道,缓慢置入宫腔镜,逐渐进入并对患者宫腔进行观察,取内膜组织送病检,检查完毕后给予抗感染治疗。
1.2.2 超声检查
主要采用美国GE Voluson E10型超声诊断仪,腔内探头频率5~12MHz。患者于宫腔镜检查当日先行经阴道超声检查,检查前准备,嘱患者排空膀胱,取截石位,首先行阴道二维超声测量患者子宫内膜厚度,观察子宫内膜回声均匀性及内膜Applebaum分型。具体方法:①以子宫正中矢状面切面图像为准,在此切面测量前后两侧双层子宫内膜的厚度,测量点落在内膜与肌层的交界处并记录检查结果,观察子宫内膜回声均匀性;②将彩色多普勒血流取样框放置子宫正中矢状面切面观察子宫内膜血流,Applebaum于1995年将子宫内膜血流分为Ⅰ、Ⅱ、Ⅲ三种类型,Ⅰ型:血管穿过内膜外侧低回声带,但未到达内膜高回声外缘;Ⅱ型:血管穿过内膜高回声外缘,但未进入内膜低回声区;Ⅲ型内膜:血管进入内膜低回声区。之后行三维超声模式对子宫内膜血流情况进行观察并记录,应用 VOCAL 软件测量相关内膜血流参数,血管指数(vascular index,VI)、血流指数(blood flow index,FI)以及血管-血流指数(vascular-flow index,VFI)水平,所有数值均测量 3 次,取平均值作为最终结果。
1.3 观察指标
①子宫内膜厚度、回声均匀性及内膜Applebaum 分型;②子宫内膜血流参数 VI、FI、VFI 指标。
1.4 统计学方法
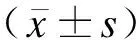
2 结果
2.1 一般资料
两组患者年龄、体重指数、月经周期及超声检查时间比较无统计学差异(P>0.05),见表1。
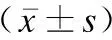
表1 CE组与对照组一般资料比较Table 1 Comparison of general data between CE group and control group
2.2 二维超声子宫内膜情况
与对照组相比,CE组子宫内膜厚度更小,子宫内膜回声不均匀者更多,子宫内膜Applebaum 分型中Ⅰ型血流占比较高,Ⅱ、Ⅲ型血流占比较低,差异均有统计学意义(P<0.05)。见表2。
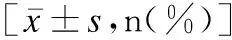
表2 CE组与对照组子宫内膜情况比较Table 2 Comparison of endometrial condition between CE group and control group
2.3 3D-PDA子宫内膜血流参数比较
与对照组相比,CE组子宫内膜血流VI、FI、VFI均较低 ,差异有统计学意义(P<0.05)。见表3。
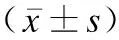
表3 CE组与对照组子宫内膜血流参数比较Table 3 Comparison of endometrial blood flow parameters between CE group and control group
2.4 二维超声联合3D-PDA检查子宫内膜对CE的诊断价值
ROC曲线分析结果显示:子宫内膜厚度、内膜回声均匀性、VI、FI、VFI单项及5项指标联合检测均对CE具有诊断价值,且5项联合检测的价值最高,见表4、图1。
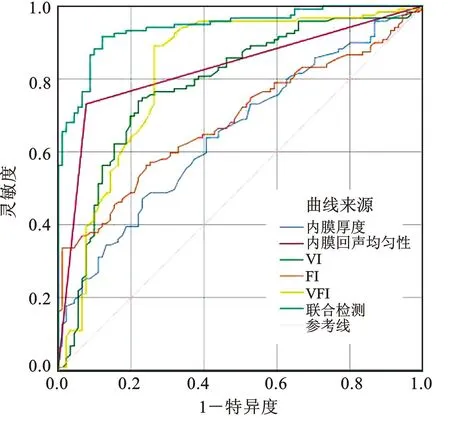
图1 子宫内膜超声参数诊断CE的 ROC 曲线Fig.1 ROC curves of endometrial ultrasound parameters for diagnosing CE

表4 子宫内膜超声参数对CE的诊断价值Table 4 Diagnostic value of endometrial ultrasound parameters for CE
3 讨论
3.1 慢性子宫内膜炎研究现状
CE是一种显著影响妇女生育但临床症状轻微的子宫内膜炎性疾病[8],病因尚不明确,目前认为主要致病因素是病原微生物的感染,比较常见的病原体有大肠埃希菌、粪肠球菌、变形杆菌、链球菌、葡萄球菌、生殖道支原体和衣原体等多种微生物病原体,还可能与异常的免疫反应、外源性的感染、自身免疫性疾病和组织损伤等有关[9-10]。有相关研究资料表明,CE 在人群中的发病率为0.2%~46%,不孕症妇女中CE患病率明显升高,可高达56.8%[11-12]。但由于CE缺乏特异性临床症状,诊断较困难,目前CE诊断主要依赖宫腔镜检查、病原微生物筛查及组织病理学活检等检测手段[13-14]。组织病理学检查能够检测子宫内膜基质中浆细胞的存在,是诊断CE的金标准,但属于有创检查,另外由于浆细胞的定量标准和免疫染色的技术操作未形成规范化共识,可能造成过度诊断、假阳性率增高[15]。
3.2 慢性子宫内膜炎对子宫内膜形态及血流的影响
目前经阴道超声广泛应用于妇科疾病的诊疗中,尤其能够细致观察内膜情况,是检查子宫内膜病变的常用方式,具有无创性、且可重复操作等特点,也是临床上最常用的评估子宫内膜容受性的检查方法[16-17]。既往研究显示,子宫内膜容受性、子宫内膜的厚度情况以及子宫内膜的血流的参数指标等是评估子宫受孕能力至关重要的指标[18]。本研究结果显示CE患者的内膜厚度明显小于对照组,推测原因有:首先,CE长期迁延不愈,炎症由子宫内膜功能层逐渐迁延至子宫内膜基底层,破坏上皮细胞,引起内膜偏薄。其次,CE常伴有异常子宫出血、粘膜下肌瘤、子宫内膜息肉、子宫内膜增生等疾病,可通过非细菌性炎症反应,使得免疫细胞分布异常,从而引起子宫内膜免疫过度,最终造成子宫内膜容受性受损,内膜厚度变薄[19]。最后,有研究表明,CE与宫腔粘连有一定的关联[20]。这可能是由于CE改变宫腔内微生物环境及免疫环境,引起炎细胞因子升高、内膜纤维化稳态失衡,内膜生长受限,造成内膜偏薄。本研究还发现CE组内膜回声不均匀占比高于观察组,与Guo等[21]研究结果一致。CE超声图像显示宫腔线模糊、断续,内膜有时伴单发或多发无回声,且内膜基底层边缘毛糙,与子宫肌层分界欠清晰。经阴道彩色多普勒超声检查通过彩色多普勒血流显像能够显示子宫内膜血流,了解子宫内膜血流分布及灌注情况。本研究中,CE组与对照组子宫内膜Applebaum 分型占比差异存在统计学意义。CE组以Ⅰ型血流占比较对照组更高,为60.51%,而Ⅱ型、Ⅲ型血流占比较对照组低,表明CE患者内膜血流分布不佳,血流灌注较差,与王欣丽等[22]研究结果一致。Li等[23]研究结果显示,CE患者子宫内膜免疫细胞浸润水平升高,子宫内膜免疫细胞的过度浸润影响子宫内膜血液灌注,引起子宫内膜血流减少。
3.3 3D-PDA技术检测子宫内膜血流
二维超声观察病变的形态及边界时容易受限,且对低速血流不敏感,三维超声检查技术的发展弥补了二维超声的不足,三维超声检查技术可获取任何一个切面的图像,清晰显示病变组织的形态及边界等,3D-PDA技术可检查到微小血管及新生血管,能够显示子宫肌壁及子宫内膜的血流信号。经3D-PDA 技术测得的子宫内膜血流参数既能有效评估患者子宫内膜的受损程度,又能获得患者血管内血流的平均速度。有研究表明,子宫内膜基底部良好的血液供应有利于子宫内膜的生长。王玫[24]研究显示,血管阻力越小,局部血流灌注越佳,反之则局部血流灌注越差。3D-PDA技术检查血流参数能够有效反映所测体积中的血流及血管情况,VI是彩色体素数量与所有体素数量的比率,反映了体积内血流灌注情况,FI是彩色体强度总和与彩色体素数量之比,反映了体积内的整体血流量,VFI是彩色体素强度总和与所有体素数量的比率,反映了体积内血流的丰富程度。本研究中CE组VI、FI、VFI均低于对照组,提示CE内膜血流灌注差,推测CE患者由于多种炎性因子、细胞因子释放导致子宫内膜炎症调节异常和免疫微环境改变,使子宫内膜血流紊乱,血流灌注不足,还可能因为炎性因子直接破坏血管壁,造成内膜下血管数量明显减少,血流速下降,宫腔容积减小[25]。胡丽琴等[26]研究表明,CE治疗后血清炎性因子水平降低,FI升高,本研究与其结果近似。
3.4 小结
本研究显示CE患者子宫内膜厚度、内膜回声均匀性及血流灌注情况与对照组相比均存在显著差异。经阴道二维超声联合3D-PDA检查子宫内膜建立 ROC 曲线分析结果显示,子宫内膜厚度、内膜回声均匀性、VI、FI、VFI五项联合检测对CE的诊断价值最高,经阴道二维超声联合3D-PDA检查子宫内膜,具有方便、安全、无创、可反复检查比较疗效等优势,能够为CE提供比较可靠的诊断依据,值得临床推广使用。

