紫苏叶体外抗氧化和降糖活性分析
赵彦巧,王少平,王 月,孙 冰,李建颖
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
紫苏(Perillafrutescent(L.)Britt)主要分布在中国、韩国、印度和其他东南亚国家[1],是中国卫生部首批列入的药用和食用同源植物[2],其紫苏叶、紫苏籽和紫苏茎已写入《中国药典》[3]。紫苏叶营养成分丰富,可为人体提供酚类、氨基酸、花色苷、维生素和矿物质[4]等营养成分,又有抗氧化[5]、抗炎杀菌[6]、抗过敏性[7]和止呕[8]等功效。淀粉是由众多α-葡萄糖残基单元聚合而成的多糖,在分子水平上由两种主要类型的α-葡聚糖组成,即直链淀粉和支链淀粉[9]。大米淀粉在人类饮食中广泛存在,糊化后的淀粉可被人体内α-淀粉酶和α-葡萄糖苷酶等消化酶水解成葡萄糖,从而使餐后血糖升高[10],增加肥胖、II 型糖尿病和心血管疾病等慢性疾病的发病风险。
多酚类物质的结构和抗氧化能力在胃肠道消化期间会发生变化。师聪等[11]和Kashyap 等[12]发现体外模拟消化后水果中多酚类物质增加且抗氧化能力提高。李项辉[13]采用细胞实验证实了紫苏叶提取物可以抑制Caco-2 细胞上的麦芽糖酶和蔗糖酶,同时还阻碍葡萄糖在Caco-2 细胞中的转运,以达到预防和治疗糖尿病的目的。因此,评估紫苏叶提取物在人体消化后的生物活性是非常重要的。此外,大米淀粉的消化吸收也是研究热点,减少葡萄糖在人体内的吸收,抑制餐后血糖指数的升高,对肥胖、糖尿病等代谢类疾病的预防大有裨益。已有多项研究表明花色苷等酚类物质可以影响淀粉的多种特性[14]。阿魏酸和没食子酸可以降低大米淀粉的峰值黏度、热糊黏度和最终黏度,槲皮素可以提高大米淀粉的糊化温度[15]。紫红米糠花色苷提取物可以直接与α-淀粉酶和α-葡萄糖苷酶相互作用,有效抑制淀粉水解,控制血糖水平的升高[16]。然而目前国内外对紫苏叶提取物的研究主要集中在提取方法、纯化方法、稳定性以及抗氧化等方面,忽略了对人体消化后的生物活性研究及其减缓淀粉体外升糖方面的潜力。
体外模拟胃肠道消化是一种操作简单、成本低廉的实用性替代方案,可以高度控制众多变量[17],广泛应用于研究不同水果制品中花色苷和其他多酚的潜在生物利用度[18-19]。因此本实验分别将不同比例的紫苏叶、紫苏叶粗提物、一次纯化物(经大孔树脂)、二次纯化物(经葡聚糖凝胶层析)与大米淀粉混合,研究混合物经模拟胃肠消化前后活性物质含量、抗氧化活性以及还原糖释放量的变化,以期为研究紫苏叶提取物体内消化、抗氧化活性以及降糖活性提供一定的理论支持。
1 材料与方法
1.1 材料与仪器
干紫苏叶(PerillaLeaves,PL)河北祁州中药材种植园;大米淀粉、胰蛋白酶(消化酪蛋白能力1:250)、Trolox 纯度>97.0%,源叶生物科技有限公司;无水乙醇 天津市风船化学试剂科技有限公司;胃蛋白酶(>3000 U/mg)罗恩试剂;淀粉葡萄糖苷酶(来源于黑曲霉液化型)、3,5-二硝基水杨酸 麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH 纯度>97.0%)东京化成工业株式会社;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+纯度>98.0%)上海易恩化学技术有限公司;其他试剂均为分析纯。
AX224ZH 型电子天平、PHS-3C 型pH 计 奥豪斯仪器(常州)有限公司;DZ-2AⅡ型真空干燥箱天津市泰斯特仪器有限公司;RV10DIGITAL 型旋转蒸发仪 德国IKA 仪器有限公司;AMM-6T 磁力搅拌器 天津奥特塞恩斯仪器有限公司;SY-601 型超级恒温水浴 天津市欧诺仪器仪表有限公司;UV-2600 型紫外可见分光光度计 岛津仪器有限公司;RVA-Tec Master 型快速粘度分析仪 Newport Scientific 仪器公司。
1.2 实验方法
1.2.1 样品的制备
1.2.1.1 紫苏叶粗提物(PerillaLeaves Extraction Powder,PLE)的制备 按照王月[20]的方法,称取一定量预处理(将干紫苏叶放入烘箱烘干,取出粉碎,过60 目筛)的紫苏叶,用40%酸化乙醇(pH2.0)超声提取,液料比为16:1(mL/g),超声功率为350 W,温度为50 ℃,超声提取37 min,离心取上清液,经减压蒸馏后,真空干燥得到粗提物。
1.2.1.2 紫苏叶一次纯化物(PerillaLeaves Primary Purified Powder,PLPP)的制备 按照王月[20]的方法,使用AB-8 大孔树脂对超声辅助提取的紫苏叶粗提物进行纯化。吸附条件为上样液pH2.0,上样流速2 mL/min,上样浓度4.0 mg/mL,解吸条件为洗脱乙醇浓度84%、洗脱流速1.5 mL/min、洗脱液pH2.5。将得到的样品经减压蒸馏后,真空干燥得到一次纯化物。
1.2.1.3 紫苏叶二次纯化物(PerillaLeaves Second Purified Powder,PLSP)的制备 按照王月[20]的方法,使用Sephadex LH-20 葡聚糖凝胶对AB-8 大孔树脂初纯化的提取物进一步分离纯化。纯化条件为样品上样浓度为20 mg/mL,洗脱液浓度为50%甲醇(pH2.0),洗脱流速为1.3 mL/min。将得到的样品经减压蒸馏后,真空干燥得到二次纯化物。
1.2.1.4 体外消化样品体系的制备 参考Xiao 等[21]的方法并稍作改动,分别将紫苏叶及其提取物与大米淀粉按5%、10%、15%的比例混合,即将5%紫苏叶(PL)、5%紫苏叶得到的粗提物(PLE)、一次纯化物(PLPP)、二次纯化物(PLSP)与95%大米淀粉(R)混合均匀;将10%紫苏叶(PL)、10%紫苏叶得到的粗提物(PLE)、一次纯化物(PLPP)、二次纯化物(PLSP)与90%大米淀粉(R)混合均匀;将15%紫苏叶(PL)、15%紫苏叶得到的粗提物(PLE)、一次纯化物(PLPP)、二次纯化物(PLSP)与85%大米淀粉(R)混合均匀。
1.2.2 样品糊化特性测定 按照美国谷物化学家协会的标准方法AACC-76-21[22],以3 g 大米淀粉为对照组,取样品3 g,超纯水25 mL,利用快速粘度分析仪(RVA-TecMaster)测定样品的糊化特性,同时获得糊状物样品。测得峰值黏度(Peak)、谷值黏度(Trough)、衰减值(Breakdown)、终值黏度(Final Visc)、回生值(Setback)、峰值时间(Peak Time)、糊化温度(Peak Temp),每组样品平行测定3 次。
1.2.3 体外胃肠道消化模拟 模拟胃消化:称量RVA 得到的糊状物样品2.5 g,加入30 mL 超纯水,开启磁力搅拌加热。加入0.8 mL 1 mol/L 的盐酸,待温度达到37 ℃后,加入1 mL 10%胃蛋白酶溶液,37 ℃消化30 min。模拟肠消化:向模拟胃消化后的样品溶液中加入2 mL 1 mol/L NaHCO3和5 mL 0.1 mol/L pH6 的马来酸钠缓冲液,取样1 mL 作为消化0 min 时的初始值,记为t0。加入0.1 mL 10 万U/mL 淀粉葡萄糖苷酶、5 mL 2.5%胰酶溶液和10 mL 超纯水,37 ℃消化120 min,在20、60 和120 min 时分别取样1 mL,记作t20、t60和t120。向t0、t20、t60和t120样品中分别加入4 mL乙醇,5000 r/min 离心5 min,取上清液,过0.45 μm滤膜,4 ℃冷藏,备用。
1.2.4 体外模拟消化过程中葡萄糖释放量的测定用3,5-二硝基水杨酸(DNS)测定葡萄糖当量(Glycaemic Glucose Equivalent,GGE),以评估体外120 min 胃肠消化过程中释放的还原糖,绘制还原糖释放量与时间的关系曲线,并积分计算曲线下面积(Area under the Curve,AUC)[23-24]。分别取50 µL上述冷藏备用的样品(见1.2.3)、超纯水、5 mg/mL和10 mg/mL 葡萄糖标准溶液于试管中,重复三次;依次向试管中加入0.25 mL 酶溶液A(1%转化酶溶液:1%淀粉葡萄糖苷酶(10 万U/mL):0.1 mol/L 醋酸钠缓冲液=1:1:100),室温下消化20 min;向每一个试管中加入0.75 mL DNS 混合液(0.5 mg/mL 葡萄糖标准溶液:4 mol/L NaOH:DNS=1:1:5),用锡纸盖住试管,沸水加热15 min;加热完成后放入冷水中冷却,向每个试管中加入4 mL 超纯水,于530 nm 测吸光度,以葡萄糖标准曲线作为还原糖定量的依据。
1.2.5 体外模拟消化前后总酚含量的测定
1.2.5.1 标准曲线绘制 分别配制浓度为0、12.5、25、50、75、100 和150 µg/mL 的没食子酸标准溶液,分别在0.5 mL 各浓度标准溶液中加入2.5 mL 0.2 mol/L 的福林酚试剂和2.0 mL 7.5%碳酸钠溶液,振荡混匀,避光静置120 min,于760 nm 下测吸光度。以没食子酸标准溶液浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,作为总酚含量测定的定量依据。
1.2.5.2 样品总酚含量测定 为了测定消化前样品的总酚含量和抗氧化活性,称取糊状物3 g,37 ℃用30 mL 70%甲醇搅拌提取120 min。将所得提取物3000 g 离心20 min,取上清液,过0.45 μm 滤膜,4 ℃冷藏,备用。采用福林酚法测定体外模拟消化前后总酚含量,总酚含量表示为mg GAE/100 g DW。
1.2.6 体外模拟消化前后抗氧化能力的测定
1.2.6.1 DPPH 自由基清除能力的测定 参考石雪萍等[25]的方法并稍作改动。取紫苏叶、粗提物、一次纯化物和二次纯化物经体外胃肠模拟消化前后的样品0.5 mL+1 mL 0.1 mmol/L DPPH 乙醇溶液+1.5 mL 40%乙醇,摇匀,避光静置30 min,在517 nm波长处测定吸光度A1;用无水乙醇代替样品溶液和DPPH 乙醇溶液,基于同样的方法,测定吸光度A0、A2,按式(1)计算DPPH 自由基清除率。
1.2.6.2 ABTS+自由基清除能力的测定 参考章烨雯等[26]的方法配制ABTS 母液并稍作改动。在10 mL 容量瓶中分别加入245 μL(100 mmol/L)过硫酸钾溶液和9.5 mL 7 mmol/L ABTS 溶液,用水补齐至刻度,混合均匀,用锡纸包裹避光静置16 h。将ABTS 母液滴加到pH7.4 PBS 缓冲液中,使其A734nm=0.7±0.02,即得ABTS 工作液。分别取紫苏叶、粗提物、一次纯化物和二次纯化物经体外胃肠模拟消化前后的样品30 μL 与3 mL ABTS 工作液混匀,室温避光反应6 min,在734 nm 波长处测定吸光度A1。以无水乙醇替换样品溶液和ABTS 工作液,以同法操作测定吸光度A0、A2,按式(2)计算ABTS+自由基清除率。
1.3 数据处理
所有实验均重复测定三次,结果用“平均值±标准差”表示,用SPSS 25 软件对实验数据进行统计学分析,采用ANOVA 和Duncan 多重比较方法,P<0.05 表示差异显著。采用Origin 2019b 绘制数据图。
2 结果与分析
2.1 紫苏叶提取物对淀粉糊化特性的影响
不同样品的RVA 指标见表1。添加不同含量的活性物质后RVA 样品的糊化特性发生改变,当活性物质添加量为5%时,样品具有较大的峰值黏度、谷值黏度和终值黏度;当活性物质的添加量增加至10%和15%时,RVA 样品的峰值黏度、谷值黏度和最终黏度均明显降低,而糊化温度升高。其中添加15%一次纯化物的RVA 样品最终黏度最低,为1562.5 cP。这可能是随着活性物质添加量的增大,样品组淀粉的含量逐渐降低,同时纤维素和多酚等对淀粉的水合作用有一定的抑制作用[27],从而降低了峰值黏度、谷值黏度和最终黏度[28]。此外,对照淀粉糊化后的回生值为1369.5 cP,随着活性物质添加量从5%增加到15%,样品的回生值显著降低,添加15%一次纯化物的样品回生值最低,为482.0 cP。对照淀粉糊化后衰减值为964.5 cP,添加活性物质的样品衰减值显著增大,且添加15%一次纯化物的样品衰减值最大,达到了1722.5 cP。以上结果表明添加活性物质对淀粉的糊化性质有显著影响,其峰值黏度、谷值黏度、最终黏度、糊化温度以及回生值等均与活性物质添加量密切相关。
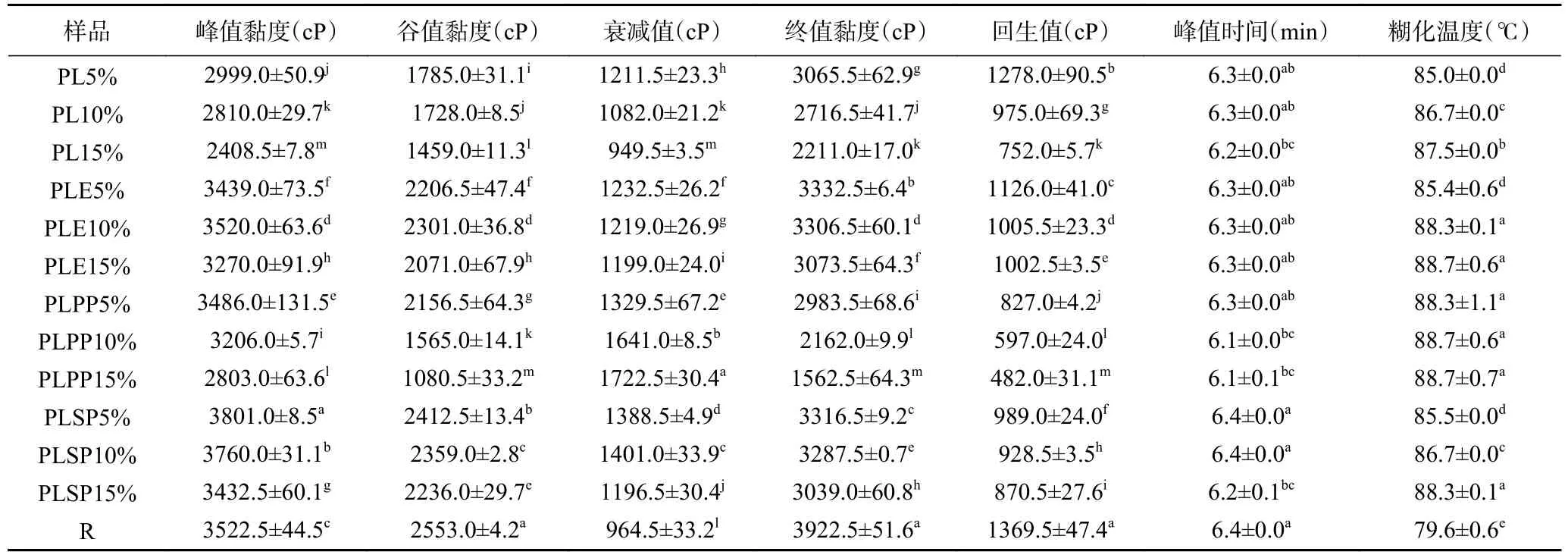
表1 体外消化样品的RVA 指标Table 1 RVA indexes of digestion samples in vitro
2.2 体外模拟消化过程中的葡萄糖释放量
采用DNS 法测定紫苏叶提取物在体外消化过程中的还原糖释放量,以评价其对淀粉体外升糖反应的抑制作用,结果如图1 所示。在0~20 min 内,还原糖释放量与消化时间的延长成正相关关系,在20~120 min 范围内,则会降低甚至趋于平缓。其中添加15%一次纯化物的样品消化后还原糖释放量最低,为43.13 mg/g,约为对照组(134.42 mg/g)的38%。图2 为消化过程中的AUC 值,AUC 值越低,说明其血糖反应越低。与对照组相比,添加了提取物的样品消化后还原糖释放量明显减少,从而降低了体外升糖反应。随着活性物质添加量从5%增加到15%,消化过程中的AUC 值总体呈下降趋势,其中添加15%一次纯化物的样品消化过程中AUC 值最低,为30.86 mg 葡萄糖/g,约为对照组(83.50 mg 葡萄糖/g)的37%。这可能是由于酚类物质和消化酶之间发生相互作用(例如氢键、疏水相互作用和离子相互作用),形成了“抑制剂-酶”或“抑制剂-淀粉-酶”的复合物[29-30],从而抑制消化酶从淀粉中水解还原糖,降低淀粉降解率和还原糖释放率。
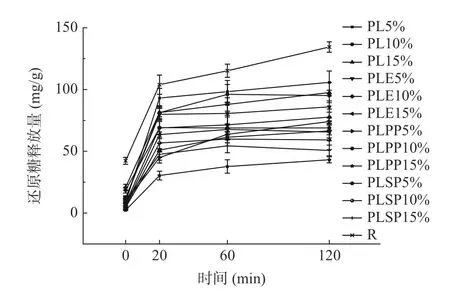
图1 模拟胃肠道消化过程中的还原糖释放量Fig.1 Release of reducing sugar during simulated gastrointestinal digestion
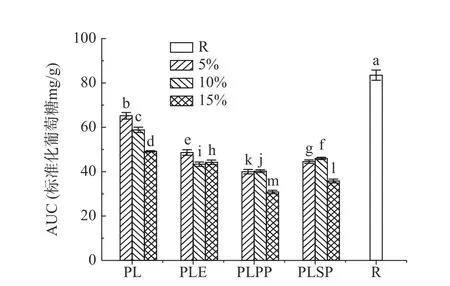
图2 模拟胃肠道消化过程中的AUC 值Fig.2 AUC values during simulated gastrointestinal digestion
2.3 体外模拟消化前后的总酚含量
以A(765 nm)为纵坐标,没食子酸浓度为横坐标,绘制标准曲线,得到线性回归方程为:Y=0.012X+0.0249(R2=0.9993)。根据标准曲线计算样品的总酚含量。模拟胃肠道消化前后总酚含量变化如图3 所示,紫苏叶、粗提物、一次纯化物和二次纯化物经胃肠模拟消化后总酚含量均有显著增加(P<0.05),消化后多酚含量最高的为添加15%一次纯化物的样品,达到了81.04 mg GAE/100 g DW,是消化前(37.05 mg GAE/100g DW)的2.19 倍。此外,多酚含量随着RVA 样品中活性成分的增加而增加,其中添加15%一次纯化物的样品消化后多酚含量为对照组(25.51 mg GAE/100 g DW)的3.18 倍。这可能是因为纯化后的紫苏叶提取物既去除了蛋白、多糖等多种杂质,又保留了大量多酚物质,胃蛋白酶的消化使结合酚类进一步释放出来[31]。
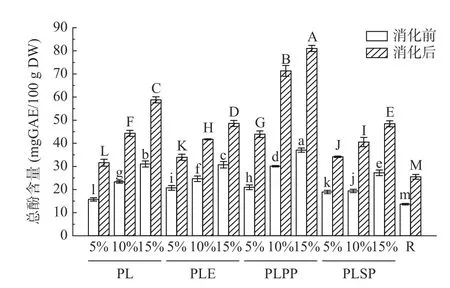
图3 模拟胃肠道消化前后总酚含量变化Fig.3 Changes of total phenol content before and after simulated gastrointestinal digestion
2.4 体外模拟消化前后的抗氧化能力
2.4.1 体外模拟消化前后对DPPH 自由基的清除能力 紫苏叶提取物体外模拟消化前后对DPPH 自由基的清除能力如图4 所示。经体外胃肠模拟消化后清除DPPH 自由基的能力显著提高(P<0.05),均大于对照组,约为对照组的1.20~1.56 倍。将活性物的添加量从5%提高到15%,对DPPH 自由基的清除能力没有明显变化。其中添加10%一次纯化物消化后对DPPH 自由基的清除能力最高,为38.69%,添加5%粗提物的样品消化前后对DPPH 自由基的清除能力差距最大,消化后的清除率约为消化前的1.93 倍。李欣等[32]的研究发现高粱淀粉-多酚复合物在体外模拟消化后的DPPH 自由基清除率显著高于消化前。此外,如图3 和图4 所示,在模拟消化过程中总酚含量与DPPH 自由基清除能力变化规律相似,图5 Pearson 相关性分析结果也表明消化前后总酚含量与抗氧化能力具有相关性。Toshima 等[33]研究比较了覆盆子、黑莓和日本红莓成熟果实中花色苷和多酚的含量及其抗氧化能力,结果也表明这些提取物的总花色苷和总酚含量与抗氧化能力呈极显著的相关,与本文研究结果一致。
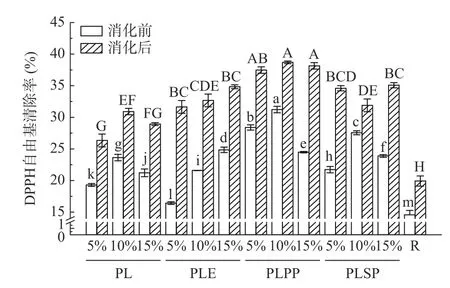
图4 消化前后对DPPH 自由基的清除能力Fig.4 DPPH radical scavenging ability before and after digestion
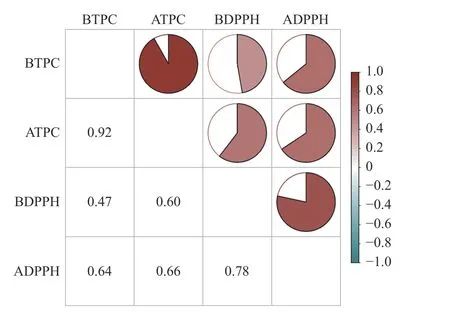
图5 消化前后的总酚含量与对DPPH 自由基的清除能力的相关性Fig.5 Correlation coefficient amongst total phenol content and DPPH radical scavenging ability before and after simulated gastrointestinal digestion
2.4.2 体外模拟消化前后对ABTS+自由基的清除能力 紫苏叶提取物体外模拟消化前后对ABTS+自由基的清除能力如图6 所示。经体外胃肠模拟消化后清除ABTS+自由基的能力显著提高(P<0.05),且均大于对照组。其中大米淀粉(对照)经消化后清除ABTS+自由基的能力是消化前的1.2 倍,添加5%紫苏叶粗提物的样品消化前后对ABTS+自由基的清除能力差距最大,消化后约为消化前的1.5 倍。此外,添加5%紫苏叶粗提物的样品消化后对ABTS+自由基的清除能力最低(44.97%),添加15%一次纯化物消化后对ABTS+自由基的清除能力最高(57.25%)。如图3 和图6 所示,在模拟消化过程中总酚含量与ABTS+自由基清除能力变化规律相似,图7 中Pearson 相关性分析结果也表明消化前后总酚含量与抗氧化能力具有相关性。汪瑞敏等[34]的研究也发现黄秋葵发酵液对ABTS+自由基的清除率会随着消化过程中总酚含量的变化而变化,与本文研究结果一致。
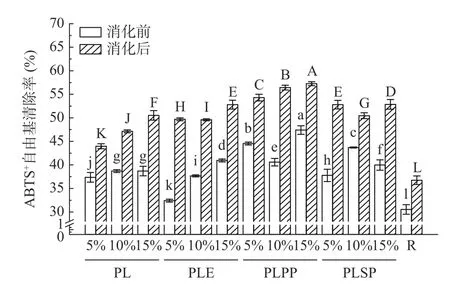
图6 消化前后对ABTS+自由基的清除能力Fig.6 ABTS+ radical scavenging ability before and after digestion
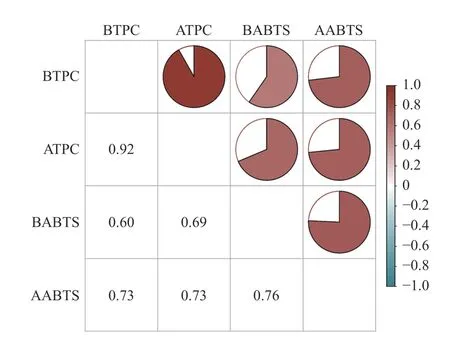
图7 消化前后的总酚含量与对ABTS+自由基的清除能力的相关性Fig.7 Correlation coefficient amongst total phenol content and ABTS+ radical scavenging ability before and after simulated gastrointestinal digestion
3 结论
本实验分别研究了紫苏叶、紫苏叶粗提物、一次纯化物(经大孔树脂)、二次纯化物(经葡聚糖凝胶层析)经过模拟胃肠消化过程的多酚含量变化、抗氧化活性变化以及降糖作用。样品糊化特性表明,添加活性物质对淀粉的糊化性质有显著影响,其峰值黏度、谷值黏度、最终黏度、糊化温度以及回生值等均与活性物质添加量密切相关。体外模拟胃肠道消化过程中,添加了活性物质的样品还原糖释放量明显减少,随着活性物质添加量从5%增加到15%,AUC 值总体呈下降趋势,表明紫苏叶提取物对淀粉体外升糖反应有抑制作用。此外,紫苏叶、紫苏叶粗提物、一次纯化物和二次纯化物消化后样品中总酚含量均显著增加(P<0.05),样品对DPPH 和ABTS+自由基的清除能力提高。研究表明紫苏叶在食品领域具有重要的利用价值,对提高其在功能性食品中的应用意义重大。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

