2-取代苯并恶唑衍生物的合成及其在药物合成中的应用
王芝元,王合珍,王京,张磊
(遵义医科大学药学院,遵义 贵州 563000)
恶唑是一类具有显著生物活性的杂环结构[1-2]。其中,2-取代的苯并恶唑化合物是一种含氮和氧原子的芳香杂环类化合物,其在材料、染料和药物等领域具有广泛的应用[3]。特别在药物化学领域,2-取代苯并恶唑类化合物具有显著的抗癌、抗病毒、抗菌、抗炎和镇痛等药理作用[4-6],例如抗生素卡波霉素(Caboxamycin,图1)、消炎镇痛药苯恶洛芬(Benoxaprofen,图1)、及2019年被批准上市用于治疗家族性淀粉样蛋白多发性神经病变的罕见病药物他法米迪(Tafamidis,图1)。因此,2-取代苯并恶唑的合成引起了广泛的关注。
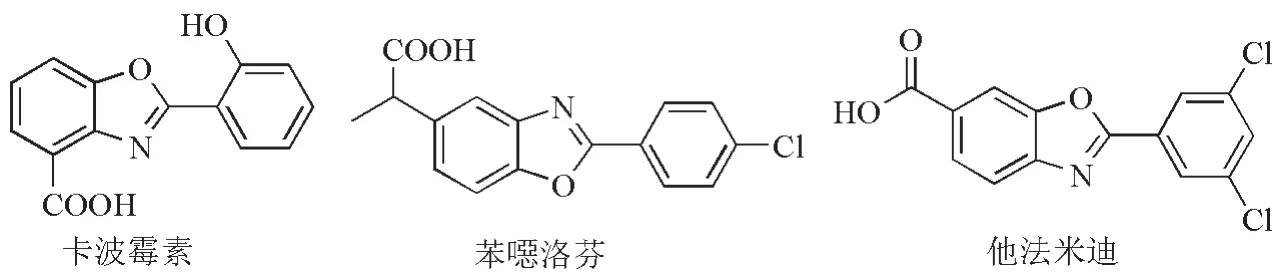
图1 含2-取代苯并恶唑结构的药物分子
近年来,人们将各种有机金属催从化运用于2-取代苯并恶唑的合成[7]。例如,Fan等[8]报道了RuCl3催化2-氨基苯酚和苯甲醛在空气中串联氧化合成2-取代苯并恶唑;Liu等[9]介绍了一种新型铜催化氧化C-H/O-H交叉偶联合成2-取代苯并恶唑;Hu等[10]发现了一种铜铁催化C-H/C-B键,活化苯并恶唑与芳基硼酸芳基化合成2-取代苯并恶唑的新方法。然而金属催化方法仍存在局限性,如反应条件较为苛刻,底物不稳定以及需要使用价格昂贵的金属试剂等。
值得关注的是,Chang等[11]利用一锅两步法,将邻氨基苯酚与苯甲醛缩合形成中间体亚胺后,再加入2,3-二氯-5,6-二氰基苯醌(DDQ)氧化环化亚胺合成2-取代苯并恶唑。可是在该合成方法中,由于两步反应体系溶剂不同,需更换第二步反应溶剂,操作繁琐;底物普适性窄,部分底物合成需加热;分离方法会吸附产物,导致产率降低;未能在药物分子中合成应用。基于上述背景,本文设计了以邻氨基苯酚和芳香醛为原料,利用一锅两步法,在最优条件下,DDQ氧化环化合成结构多样的2-取代苯并恶唑衍生物,并将该法运用于淀粉样变心肌病药物Tafamidis的合成中。
1 实验部分
1.1 主要仪器与试剂
ZF-7A手提紫外检测灯(上海光豪分析仪器有限公司);SGWX-4型熔点仪(上海精密科学仪器有限公司);Agilent-400MHz DDZ型核磁共振仪、Agilent Accurate-Mass-Q-TOF-MS 6520型高分辨质谱仪(美国安捷伦公司),Waters e2695型高效液相色谱仪(沃特世科技有限公司)。
邻氨基苯酚、对氟苯甲醛、氟苯、二氧六环(Dioxane)(上海麦克林生化科技股份有限公司);4-氨基-3-羟基苯甲酸甲酯、3,5-二氯苯甲醛(上海毕得医药科技股份有限公司);2,3-二氯-5,6-二氰基苯醌(安徽泽升科技有限公司);四氢呋喃(THF)、甲醇(MeOH)、乙酸(CH3COOH)(南宁上科试剂仪器有限公司);氢氧化锂(LiOH)(上海阿拉丁生化科技股份有限公司)。
1.2 合成方法
1.2.1 2-取代苯并恶唑衍生物的合成
向10 mL装有磁力搅拌棒的Schlenk管中依次加入邻氨基苯酚1a (39 mg, 0.36 mmoL)和对氟苯甲醛2a(32 µL, 0.3 mmoL)溶解于Dioxane (2 mL),将混合物置于室温空气下,搅拌反应5 h,待薄层色谱法(TLC)监测反应情况,生成中间体2-(4-氟苄亚甲基氨基)苯酚3a。然后向Schlenk管中加入DDQ(122 mg, 0.54 mmoL),在室温空气下,搅拌反应1 h,待TLC监测反应情况。反应结束后,将反应物混合物减压浓缩,残余物经过硅胶柱层析(石油醚/乙酸乙酯 = 40/1)分离纯化,得到2-(4-氟苯基)苯并恶唑4a (56 mg)。其余底物拓展及克级实验参照此操作步骤进行。
2-(4-氟苄亚甲基氨基)苯酚3a[12]:黄色固体,产率91%,熔点(m.p.) 84~85 ℃。1H-NMR (DMSO-d6,400 MHz), δ: 9.01 (s, 1H), 8.70 (s, 1H), 8.10 (dd,J=8.6, 5.9 Hz, 2H), 7.35 (t,J= 8.9 Hz, 2H), 7.20 (dd,J=7.8, 1.6 Hz, 1H), 7.11~7.05 (m, 1H), 6.89 (dd,J= 8.1,1.4 Hz, 1H), 6.83 (td,J= 7.5, 1.4 Hz, 1H);13C-NMR(DMSO-d6, 100 MHz), δ: 165.6, 163.1, 158.3, 151.7,138.1, 133.5 (d,J= 2.8 Hz), 131.6 (d,J= 8.8 Hz), 127.9,119.9, 119.5, 116.4, 116.2 (d,J= 21.9 Hz);19F-NMR(DMSO-d6, 376 MHz), δ: -108.4 (s,1F)。
2-(4-氟苯基)苯并恶唑4a[13]:白色固体,产率88%,m.p. 100~101℃。1H-NMR (DMSO-d6, 400 MHz), δ: 8.21 (dd,J= 8.7, 5.5 Hz, 2H), 7.76 (ddd,J=13.1, 6.9, 3.2 Hz, 2H), 7.45~7.36 (m, 4H);13C-NMR(DMSO-d6, 100 MHz), δ: 165.9, 163.4, 161.8, 150.7,141.9, 130.3 (d,J= 9.2 Hz), 125.9, 125.3, 123.5 (d,J=3.1 Hz), 120.2, 117.0 (d,J= 22.4 Hz), 111.3;19F-NMR(DMSO-d6, 376 MHz), δ: -107.1 (s, 1F); HRMS (ESI)m/z: 计算值C13H9FNO [M + H]+214.0662, 测试值214.0670。
2-(3,5-二氯苯基)苯并恶唑4b[14]:白色固体,产率75%,m.p. 141~142 ℃。1H-NMR (CDCl3, 400 MHz), δ: 8.14 (d,J= 1.9 Hz, 2H), 7.81 ~ 7.76 (m, 1H),7.62~7.57 (m, 1H), 7.51 (t,J= 1.9 Hz, 1H), 7.43 ~ 7.36(m, 2H);13C-NMR (CDCl3, 100 MHz), δ: 160.4, 150.8,141.7, 135.8, 131.2, 129.8, 126.0, 125.8, 125.0, 120.4,110.8; HRMS (ESI)m/z: 计算值C13H8Cl2NO [M + H]+263.9977, 测试值263.9978。
2-(2,4,6-三甲基苯基)苯并恶唑4c[15]:黄色固体,产率84%,m.p. 63~64 ℃。1H-NMR (CDCl3, 400 MHz), δ: 7.86~7.81 (m, 1H), 7.62~7.57(m, 1H), 7.41~7.36 (m, 2H), 6.98 (s, 2H), 2.36 (s, 3H), 2.30 (s, 6H);13C-NMR (CDCl3, 100 MHz), δ: 163.3, 150.6, 141.6,140.3, 138.5, 128.6, 124.9, 124.9, 124.2, 120.1, 110.6,21.3, 20.4; HRMS (ESI)m/z: 计算值C16H16NO [M + H]+238.1226, 测试值238.1236。
2-(4-甲氧基苯基)苯并恶唑4d[14]:白色固体,产率88%,m.p. 99~100 ℃。1H-NMR (CDCl3, 400 MHz),δ: 8.21~8.17 (m, 2H), 7.75~7.72 (m, 1H), 7.56~7.52(m, 1H), 7.35~7.28 (m, 2H), 7.03~6.99 (m, 2H), 3.86(s, 3H);13C-NMR (CDCl3, 100 MHz), δ: 163.1, 162.3,150.6, 142.2, 129.4, 124.6, 124.4, 119.6, 119.6, 114.3,110.4, 55.4; HRMS (ESI)m/z: 计算值C14H12NO2[M +H]+226.0862, 测试值226.0869。
2-(2-甲氧基苯基)苯并恶唑4e[14]:黄色固体,产率79%,m.p. 56~57 ℃。1H-NMR (CDCl3, 400 MHz),δ: 8.15 (dd,J= 7.8, 1.8 Hz, 1H), 7.86~7.81 (m, 1H),7.62~7.57 (m, 1H), 7.54~7.49 (m, 1H), 7.37~7.32 (m,2H), 7.11 (ddd,J= 9.5, 7.9, 1.5 Hz, 2H), 4.03 (s, 3H);13C-NMR (CDCl3, 100 MHz), δ: 161.5, 158.6, 150.2,142.0, 132.8, 131.3, 125.0, 124.3, 120.7, 120.2, 116.0,12.0, 110.4, 56.2; HRMS (ESI)m/z: 计算值C14H12NO2[M + H]+226.0862, 测试值226.0886。
2-(4-联苯基)苯并恶唑4f[14]:白色固体,产率76%,m.p. 136~138 ℃。1H-NMR (CDCl3, 400 MHz),δ: 8.33 (d,J= 8.4 Hz, 2H), 7.83~7.74 (m, 3H), 7.69~7.65 (m, 2H), 7.62~7.58 (m, 1H), 7.49 (t,J= 7.5 Hz,2H), 7.43~7.34 (m, 3H);13C-NMR (CDCl3, 100 MHz),δ: 162.9, 150.8, 44.2, 142.2, 140.0, 129.0, 128.1, 127.6,127.2, 125.9, 125.1, 124.6, 120.0, 110.6; HRMS (ESI)m/z: 计算值C19H14NO [M + H]+272.1069, 测试值272.1073。
2-(1-萘基)苯并恶唑4g[14]:白色固体,产率70%,m.p. 102~103 ℃。1H-NMR (CDCl3, 400 MHz),δ: 9.48 (d,J= 10.0 Hz, 1H), 8.45 (d,J= 7.2 Hz, 1H),8.04 (d,J= 8.6 Hz, 1H), 7.97~7.88 (m, 2H), 7.75~7.69(m, 1H), 7.68~7.57 (m, 3H), 7.41 (dd,J= 5.9, 3.3 Hz,2H);13C-NMR (CDCl3, 100 MHz), δ: 162.8, 150.1,142.2, 133.9, 132.4, 130.7, 129.4, 128.7, 128.0, 126.5,126.2, 125.3, 125.0, 124.5, 123.5, 120.3, 110.5; HRMS(ESI)m/z: 计算值C17H12NO [M + H]+246.0913, 测试值246.0919。
2-苯乙烯基苯并恶唑4h[15]:淡黄色固体,产率74%,m.p. 78~79 ℃。1H-NMR (CDCl3, 400 MHz), δ:7.80 (d,J= 16.3 Hz, 1H), 7.75~7.70 (m, 1H), 7.62~7.58(m, 2H), 7.55~7.51 (m, 1H), 7.45~7.37 (m, 3H), 7.37~7.32 (m, 2H), 7.09 (d,J= 16.3 Hz, 1H);13C-NMR(CDCl3, 100 MHz), δ: 162.8, 150.4, 142.1, 139.5, 135.1,129.8, 129.0, 127.6, 125.2, 124.5, 119.9, 113.9, 110.3;HRMS (ESI)m/z: 计算值C15H12NO [M + H]+222.0913,测试值222.0917。
2-(4-氟苯基)-6-甲基苯并恶唑4i[13]:白色固体,产率90%,m.p. 115~116 ℃。1H-NMR (CDCl3,400 MHz), δ: 8.26~8.20 (m, 2H), 7.63 (d,J= 8.1 Hz,1H), 7.37 (s, 1H), 7.19 (q,J= 7.8, 7.0 Hz, 3H), 2.50(s, 3H);13C-NMR (CDCl3, 100 MHz), δ: 165.9, 163.4,161.7, 151.0, 139.7, 135.6, 129.6 (d,J= 8.8 Hz), 125.9,123.6 (d,J= 3.2 Hz), 119.2, 116.1 (d,J= 22.3 Hz),110.7, 21.8;19F-NMR (CDCl3, 376 MHz), δ: -107.8 (s,1F); HRMS (ESI)m/z: 计算值C14H11FNO [M + H]+228.0819, 测试值228.0823。
2-(4-氯苯基)-6-甲基苯并恶唑4j[16]:白色固体,产率72%,m.p. 154~156 ℃。1H-NMR (CDCl3, 400 MHz), δ: 8.13 (d,J= 8.6 Hz, 2H), 7.61 (d,J= 8.1 Hz,1H), 7.46 (d,J= 8.6 Hz, 2H), 7.34 (s, 1H), 7.15 (d,J=8.1 Hz, 1H), 2.49 (s, 3H);13C-NMR (CDCl3, 100 MHz),δ: 161.5, 151.0, 139.7, 137.4, 135.8, 129.2, 128.6, 126.0,125.8, 119.4, 110.8, 21.8; HRMS (ESI)m/z: 计算值C14H11ClNO [M + H]+244.0523, 测试值244.0527。
2-(3-氯苯基)-6-甲基苯并恶唑4k:白色固体,产率80%,m.p. 95~96 ℃。1H-NMR (CDCl3, 400 MHz),δ: 8.20 (t,J= 1.8 Hz, 1H), 8.08 (dt,J= 7.4, 1.5 Hz, 1H),7.62 (d,J= 8.1 Hz, 1H), 7.48~7.39 (m, 2H), 7.35 (s,1H), 7.16 (d,J= 8.5 Hz, 1H), 2.49 (s, 3H);13C-NMR(CDCl3, 100 MHz), δ: 161.1,151.0, 139.7, 136.1, 135.0,131.2, 130.1, 129.0, 127.4, 126.0, 125.4, 119.5, 110.8,21.8; HRMS (ESI)m/z: 计算值C14H11ClNO [M + H]+244.0523, 测试值244.0528。
2-(3-硝基苯基)-6-甲基苯并恶唑4l[16]:淡黄色固体,产率76%,m.p. 151~152 ℃。1H-NMR (CDCl3,400 MHz), δ: 8.94 (t,J= 1.9 Hz, 1H), 8.46 (dt,J= 7.8,1.3 Hz, 1H), 8.28 (ddd,J= 8.2, 2.3, 1.1 Hz, 1H), 7.67 ~7.58 (m, 2H), 7.34 (s, 1H), 7.16 (d,J= 8.2 Hz, 1H), 2.48(s, 3H);13C-NMR (CDCl3, 100 MHz), δ: 159.9, 151.0,148.5, 139.4, 136.7, 132.7, 130.0, 128.9, 126.4, 125.4,122.1, 119.7, 110.9, 21.9; HRMS (ESI)m/z: 计算值C14H11N2O3[M + H]+255.0764, 测试值255.0767。
2-(4-硝基苯基)-6-甲基苯并恶唑4m[17]:淡黄色固体,产率90%,m.p. 202~203 ℃。1H-NMR (CDCl3,400 MHz), δ: 8.37~8.28 (m, 4H), 7.65 (d,J= 8.2 Hz,1H), 7.38 (s, 1H), 7.20 (d,J= 8.2 Hz, 1H), 2.51 (s, 3H);13C-NMR (CDCl3, 100 MHz), δ: 160.0, 151.2, 149.1,139.7, 137.1, 132.8, 128.1, 126.5, 124.1, 119.9, 111.0,21.9; HRMS (ESI)m/z: 计算值C14H11N2O3[M + H]+255.0764, 测试值255.0766。
2-(4-甲基苯基)-6-甲基苯并恶唑4n[17]:白色固体,产率74%,m.p. 109~110 ℃。1H-NMR (CDCl3,400 MHz), δ: 8.12 (d,J= 8.3 Hz, 2H), 7.62 (d,J= 8.1 Hz, 1H), 7.36 (s, 1H), 7.31 (d,J= 8.0 Hz, 2H), 7.15 (d,J= 8.2 Hz, 1H), 2.49 (s, 3H), 2.42 (s, 3H);13C-NMR(CDCl3, 100 MHz), δ: 162.8, 150.9, 141.8, 139.9, 135.3,129.6, 127.4, 125.7, 124.5, 119.1, 110.7, 21.8, 21.6;HRMS (ESI)m/z: 计算值C15H14NO [M + H]+224.1069,测试值224.1076。
2-(3-甲基苯基)-6-甲基苯并恶唑4o[17]:白色固体,产率70%,m.p. 77~78 ℃。1H-NMR (CDCl3, 400 MHz), δ: 8.07 (s, 1H), 8.03 (d,J= 7.8 Hz, 1H), 7.64(d,J= 8.1 Hz, 1H), 7.43~7.30 (m, 3H), 7.16 (d,J= 8.1 Hz, 1H), 2.50 (s,3H), 2.45 (s, 3H);13C-NMR (CDCl3,100 MHz), δ: 162.7, 151.0, 139.9, 138.7, 135.5, 132.1,128.8, 128.0, 127.1, 125.8, 124.6, 119.2, 110.7, 21.8,21.4; HRMS (ESI)m/z: 计算值C15H14NO [M + H]+224.1069, 测试值224.1080。
2-(2,4,6-三甲基苯基)-6-甲基苯并恶唑4p:黄色固体,产率81%,m.p. 76~77 ℃。1H-NMR (CDCl3,400 MHz), δ: 7.69 (d,J= 8.1 Hz, 1H), 7.41~7.39 (m,1H), 7.20 (dd,J= 8.1, 0.8 Hz, 1H), 6.97 (s, 2H), 2.52(s, 3H), 2.35 (s, 3H), 2.28 (s, 6H);13C-NMR (CDCl3,100 MHz), δ: 162.7, 150.9, 140.2, 139.3, 138.4, 135.3,128.6, 125.4, 125.0, 119.4, 110.8, 21.8, 21.3, 20.3;HRMS (ESI)m/z: 计算值C17H18NO [M + H]+252.1382,测试值252.1385。
2-(4-甲氧基苯基)-6-甲基苯并恶唑4q[16]:淡黄色固体,产率71%,m.p. 86~87 ℃。1H-NMR (CDCl3,400 MHz), δ: 8.16 (d,J= 8.9 Hz, 2H), 7.60 (d,J= 8.1 Hz, 1H), 7.34 (s, 1H), 7.13 (d,J= 8.0 Hz, 1H), 7.00(d,J= 8.9 Hz, 2H), 3.86 (s, H), 2.48 (s, 3H);13C-NMR(CDCl3, 100 MHz), δ: 162.7, 162.1, 150.9, 139.9, 135.0,129.2, 125.6, 119.8, 118.9, 114.3, 110.6, 55.4, 21.8;HRMS (ESI)m/z: 计算值C15H14NO2[M + H]+240.1019,测试值240.1025。
2-(3,4,5-三甲氧基苯基)-6-甲基-苯并恶唑4r[18]:淡黄色固体,产率90%,m.p. 133~134 ℃。1H-NMR(CDCl3, 400 MHz), δ: 7.61 (d,J= 8.1 Hz, 1H), 7.45 (s,2H), 7.35 (s, 1H), 7.15 (d,J= 8.1 Hz, 1H), 3.97 (s, 6H),3.92 (s, 3H), 2.49 (s, 3H);13C-NMR (CDCl3, 100 MHz),δ: 162.35, 153.47, 150.94, 140.70, 139.75, 135.52,125.85, 122.40, 119.09, 110.67, 104.39, 61.01, 56.28,21.82; HRMS (ESI)m/z: 计算值C17H18NO4[M + H]+300.1230, 测试值300.1231。
2-(4-联苯基)-6-甲基苯并恶唑4s:白色固体,产率76%,m.p. 165~166 ℃。1H-NMR (CDCl3, 400 MHz), δ: 8.30 (d,J= 8.4 Hz, 2H), 7.74 (d,J= 8.4 Hz,2H), 7.69~7.63 (m, 3H), 7.48 (t,J= 7.5 Hz, 2H), 7.43~7.36 (m, 2H), 7.18 (d,J= 8.9 Hz, 1H), 2.51 (s, 3H);13C-NMR (CDCl3, 100 MHz), δ: 162.4, 151.0, 143.9, 140.0,135.6, 128.9, 128.0, 127.9, 127.5, 127.1, 126.1, 125.8,119.3, 110.8, 21.9; HRMS (ESI)m/z: 计算值C20H16NO[M + H]+286.1226, 测试值286.1228。
2-(1-萘基)-6-甲基苯并恶唑4t:白色固体,产率71%,m.p. 118~119 ℃。1H-NMR (CDCl3, 400 MHz),δ: 9.49 (d,J= 8.7 Hz, 1H), 8.41 (dd,J= 7.3, 1.2 Hz,1H), 8.02 (d,J= 8.0 Hz, 1H), 7.94 (d,J= 8.1 Hz, 1H),7.78~7.69 (m, 2H), 7.63~7.57 (m, 2H), 7.44 (s, 1H),7.22 (d,J= 8.1 Hz, 1H), 2.54 (s, 3H);13C-NMR (CDCl3,100 MHz), δ: 162.3, 150.4, 140.1, 135.8, 133.9, 132.1,130.6, 129.1, 128.7, 127.9, 126.4, 126.3, 125.8, 125.0,123.7, 119.6, 110.7, 21.9; HRMS (ESI)m/z: 计算值C18H14NO [M + H]+260.1069, 测试值260.1074。
2-苯乙烯基-6-甲基苯并恶唑4u[16]:淡黄色固体,产率80%,m.p. 64~65 ℃。1H-NMR (CDCl3, 400 MHz), δ: 7.74 (d,J= 16.4 Hz, 1H), 7.58 (dd,J= 7.4, 2.4 Hz, 3H), 7.44 ~ 7.33 (m, 3H), 7.31 (s, 1H), 7.14 (d,J=8.1 Hz, 1H), 7.05 (d,J= 16.3 Hz, 1H), 2.48 (s, 3H);13C-NMR (CDCl3, 100 MHz), δ: 162.3, 150.7, 140.0, 138.8,135.7, 135.2, 129.6, 128.9, 127.5, 125.7, 119.2, 114.0,110.5, 21.8; HRMS (ESI)m/z: 计算值C16H14NO [M +H]+236.1069, 测试值236.1073。
2-(2-呋喃基)-6-甲基苯并恶唑4v[16]:淡黄色固体,产率70%,m.p. 51~52 ℃。1H-NMR (CDCl3, 400 MHz), δ: 7.63 (dd,J= 1.8, 0.8 Hz, 1H), 7.60 (d,J= 8.1 Hz, 1H), 7.32 (s, 1H), 7.21 (dd,J= 3.5, 0.8 Hz, 1H),7.14(d,J= 8.1 Hz, 1H), 6.58 (dd,J= 3.5, 1.8 Hz, 1H),2.46 (s, 3H);13C-NMR (CDCl3, 100 MHz), δ: 154.8,150.4, 145.5, 142.7, 139.3, 135.8, 126.1, 119.4, 113.8,112.2, 110.7, 21.8; HRMS (ESI)m/z: 计算值C12H10NO2[M + H]+200.0706, 测试值200.0715。
2-(4-吡啶基)-6-甲基苯并恶唑4w:淡黄色固体,产率84%,m.p. 125~126 ℃。1H-NMR (CDCl3, 400 MHz), δ: 8.79~8.75 (m, 2H), 8.03~8.00 (m, 2H), 7.65 (d,J= 8.2 Hz, 1H), 7.37 (s, 1H), 7.18 (d,J= 8.2 Hz, 1H),2.49 (s, 3H);13C-NMR (CDCl3, 100 MHz), δ: 160.0,151.1, 150.6, 139.5, 137.0, 134.4, 126.4, 120.8, 119.9,111.0, 21.9; HRMS (ESI)m/z: 计算值C13H11N2O [M +H]+211.0865, 测试值211.0876。
1.2.2 Tafamidais的合成
向10 mL装有磁力搅拌棒的Schlenk管中依次加入4-氨基-3-羟基苯甲酸甲酯5 (60 mg, 0.36 mmoL),3,5-二氯苯甲醛6 (52 mg, 0.3 mmoL)溶解于Dioxane (2 mL)和CH3COOH (0.8 mL),将混合物置于室温空气下,搅拌反应5 h后,待TLC监测。然后向Schlenk管中加入DDQ (122 mg, 0.54 mmoL),室温空气搅拌反应1 h后,待TLC监测。反应结束后,将反应液用饱和碳酸氢钠水溶液(10 mL×3)洗涤,乙酸乙酯(10 mL×3)萃取水相。无水硫酸钠干燥有机相,过滤,减压浓缩,残余物经过硅胶柱层析(石油醚/乙酸乙酯 = 40/1)分离纯化,得到2-(3,5-二氯苯基)苯并恶唑-6-甲酸甲酯7(79 mg)。克级实验按照此操作步骤进行。
2-(3,5-二氯苯基)苯并恶唑-6-羧酸甲酯7[19]:白色固体,产率82%,m.p. 174~175 ℃。1H-NMR (CDCl3,400 MHz), δ: 8.23 (s, 1H), 8.09 (dd,J= 10.3, 1.7 Hz,3H), 7.76 (d,J= 8.4 Hz, 1H), 7.51 (t,J= 1.9 Hz, 1H),3.96 (s, 3H);13C-NMR (CDCl3, 100 MHz), δ: 166.3,162.7, 150.4, 145.4, 135.9, 131.8, 129.2, 127.9, 126.7,126.1, 120.0, 112.4, 52.5; HRMS (ESI)m/z: 计算值C15H10Cl2NO3[M + H]+322.0032, 测试值322.0030。
向10 mL装有磁力搅拌棒的Schlenk管中依次加入2-(3,5-二氯苯基)苯并恶唑-6-甲酸甲酯7 (32 mg, 0.1 mmoL),LiOH (7 mg, 0.3 mmoL),THF (1.5 mL),MeOH (0.5 mL)和H2O (0.5 mL),室温下搅拌反应1 h后,待TLC监测。反应结束后,将反应混合物减压浓缩,用1 mol/L稀盐酸调节pH = 2,析出白色固体,再用布氏漏斗抽滤,用少量纯水洗涤滤饼,真空干燥滤饼,得到Tafamidis (28 mg)。纯度97.79%[HPLC归一化法:色谱柱Agilent Eclipse Plus C18柱(5 µm,4.6×150 mm);流动相A:0.05%磷酸二氢钾溶液,B:乙腈,梯度洗脱(0→20 min;流动相B:10%→40%);检测波长250 nm;流速1 mL/min;柱温30 ℃;进样量10 µL]。克级实验按照此操作步骤进行。
2-(3,5-二氯苯基)苯并恶唑-6-羧酸Tafamidais[20]:白色固体,产率92%,m.p. 193~194 ℃。1H-NMR(DMSO-d6, 400 MHz), δ: 13.25 (s, 1H), 8.19 (s, 1H),8.00 (d,J= 24.5 Hz, 3H), 7.84 (d,J= 8.5 Hz, 2H);13C-NMR (DMSO-d6, 100 MHz), δ: 167.1, 162.3, 150.4,145.0, 135.6, 132.1, 129.4, 129.1, 126.9, 126.2, 120.3,112.6; HRMS (ESI)m/z: 计算值C14H8Cl2NO3[M + H]+307.9875, 测试值307.9876。
2 结果与讨论
2.1 条件优化
以邻氨基苯酚1a和对氟苯甲醛2a为底物,选择乙腈作为溶剂,在室温下反应6 h后,获得3a氟谱产率为87%(表1,序号1)。而后对第一步反应常用的溶剂进行考察,研究结果发现二氧六环作为溶剂时,效果最佳,3a氟谱产率达到91%(表1,序号5)。
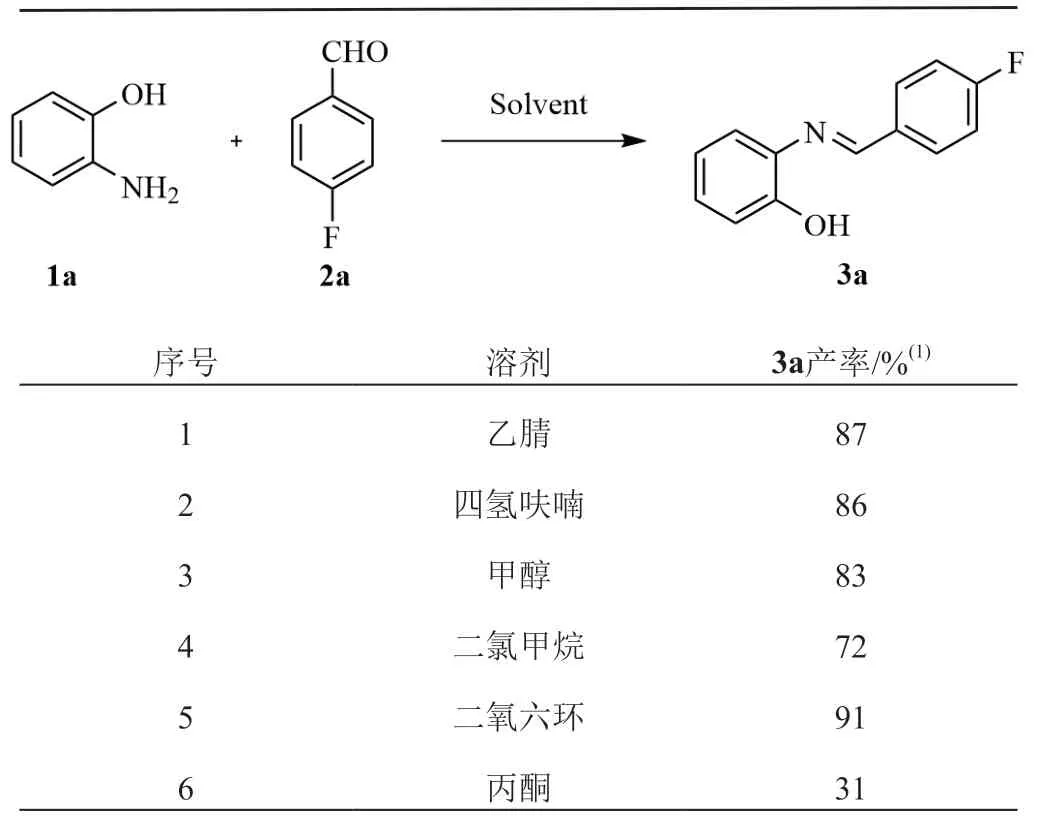
表1 考察溶剂对3a产率的影响
确定最优溶剂后,对第一步反应时间进行优化,结果表明当反应时间5 h时,3a氟谱产率可到达95%,分离产率88%(表2,序号4)。为了提高3a的产率,将1a的当量增加到1.2时,发现氟谱产率≥99%,分离产率91%(表2,序号6)。紧接着验证了第一步当中空气是否会对反应产率有影响,在氩气条件下,3a氟谱产率≥99%,分离产率91%,表明空气对第一步反应产率无影响(表2,序号6、7)。
筛选出第一步最优条件后,对第二步反应所需的氧化剂进行考察。筛选常见的非金属氧化剂,研究结果表明DDQ氧化环化效果较好,目标产物4a氟谱产率为79% (表3,序号1),而2,2,6,6-四甲基哌啶氧化物和戴斯马丁试剂有少量目标产物生成(表3,序号2、3),其他氧化剂无目标产物4a生成(表3,序号4~7)。
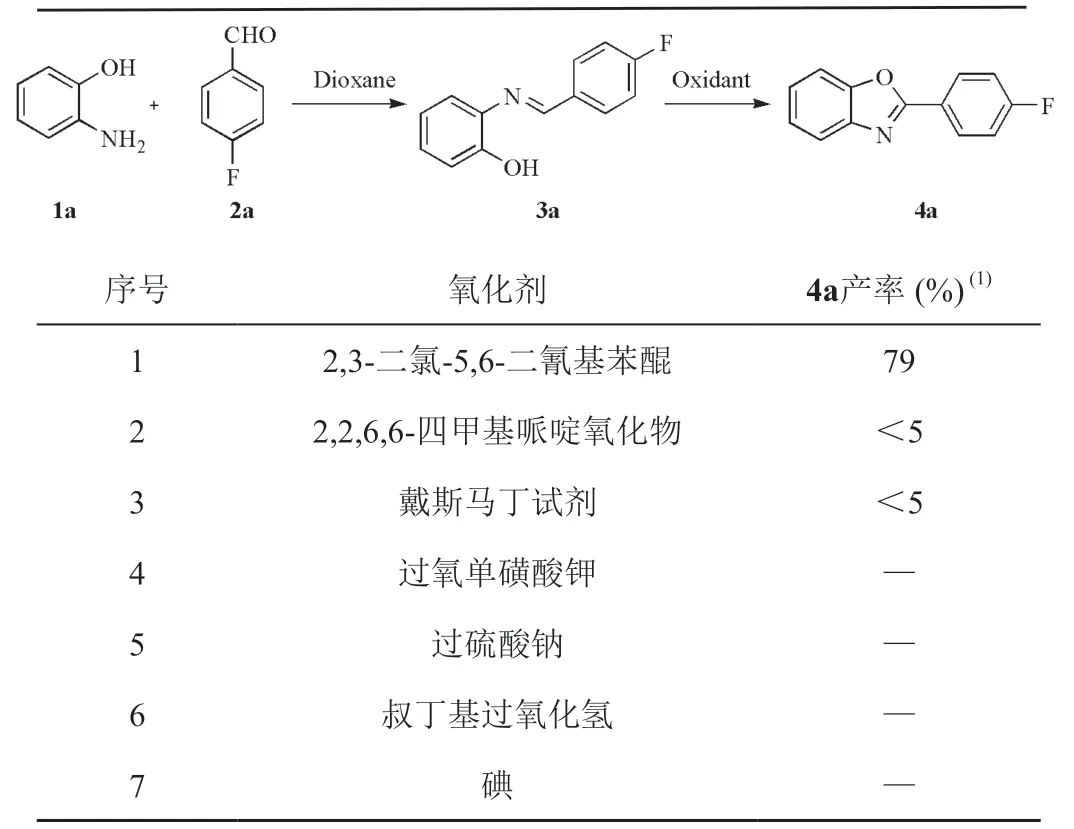
表3 考察氧化剂对4a产率的影响
随后对氧化剂DDQ反应所需的当量进行考察。结果表明,当DDQ的当量提高到1.8时,4a氟谱产率可到达92%,分离产率88%(表4,序号5);当DDQ的当量提高至2.0时,4a的产率保持不变(表4,序号6)。为了进一步提高4a的产率,考察了氧化剂氧化时间对第二步反应的产率影响,结果发现随着反应时间延长,目标产物4a的产率无明显提高(表4,序号5与序号7、8),确认反应1 h为最优氧化反应时间。同时还考察第二步反应是否受空气的影响,结果在氩气条件下,4a氟谱产率为79%(表4,序号9),与在空气条件下相比(表4,序号5),4a产率降低,因此选择第二步在空气条件下反应。
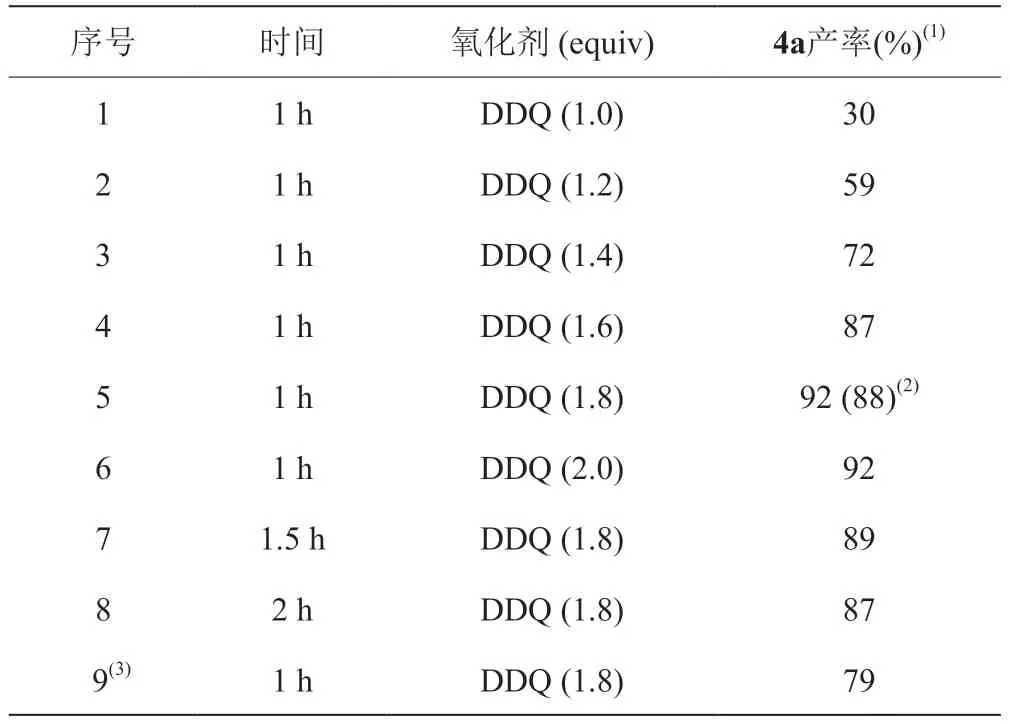
表4 考察氧化剂当量、氧化时间和空气对4a产率的影响
确定第一步反应最优条件为:1a (0.36 mmol),2a (0.3 mmol),Dioxane (2 mL),室温空气下反应5 h; 第二步反应最优条件为:DDQ (0.54 mmol),室温空气下反应1 h。进一步考察了控制实验对反应的影响。结果表明,当在最优条件下,第二步不加入氧化剂DDQ,3a氟谱产率≥99%,分离产率90%,无目标产物4a生成(表5,序号1);当在最优条件下,第二步加入氧化剂DDQ,3a在氧化剂的作用下被氧化环化,生成4a氟谱产率为92%,分离产率88%(表5,序号2);然而在最优条件下,采用一锅法将所有试剂同时加入到反应体系中,无中间体3a生成,有少量的目标产物4a生成。因此,控制实验表明,该方法需采用一锅两步法进行反应,只有第一步充分生成中间体3a后,第二步反应加入DDQ氧化环化,才能顺利生成目标产物4a。
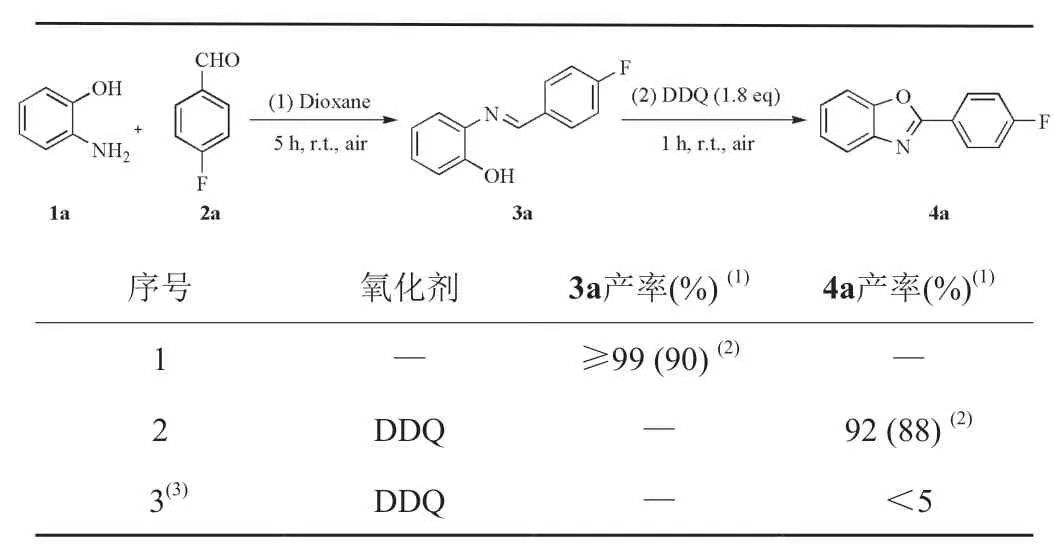
表5 考察控制实验对反应的影响
2.2 底物拓展
在最优条件下,对2-取代苯并恶唑衍生物进行底物普适性考察。首先选择邻氨基苯酚与不同芳香醛进行反应,结果发现目标产物4a~4h可获得70%~88%良好的分离收率(表6)。值得关注的是,当选择4a进行克级(1.5 g)放大实验时,仍可以获得77%的分离收率,说明该方法具有一定的可靠性和实用性。
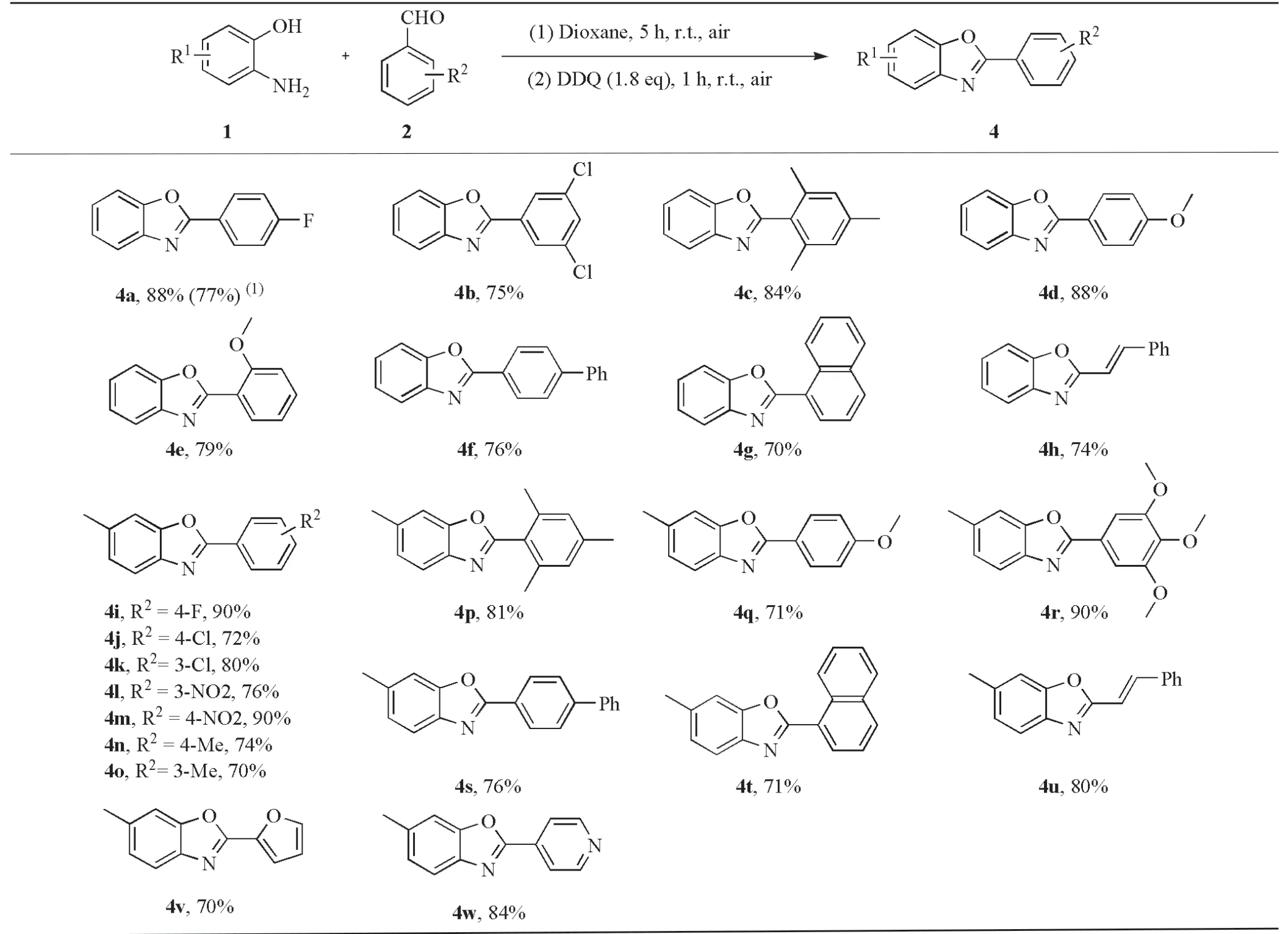
表6 2-取代苯并恶唑衍生物底物普适性考察
为了考察2-取代苯并恶唑底物的多样性,在邻氨基苯酚的5位引入甲基,结果发现目标产物4i~4w都能获得70%~90%优良的收率(表6)。因此,研究结果发现该反应对芳香醛上吸电子基团氟、氯、硝基(表6,4a、4b、4i~4m),给电子基团甲基、甲氧基和共轭体系(表6,4c~4h和4n~4u),以及杂原子芳香醛呋喃与吡啶(表6,4v、4w)都具有良好的官能团耐受性和兼容性。
2.3 反应机理
根据以上研究与相关文献的报道[20-22],提出反应可能的机理(图2)。首先,第一步邻氨基苯酚1上氨基氮原子带有孤对电子进攻芳香醛2上带有正电荷的羰基碳原子,发生亲核加成,再消除一分子水,生成席夫碱中间体3,由于中间体3不稳定互变为环化的中间体3';第二步加入DDQ后,中间体3'上一个氢负离子转移到DDQ 上,形成中间体3",同时中间体4'氮上的氢质子迅速转移到氢醌负离子上,最后芳构化脱氢生成目标产物4。
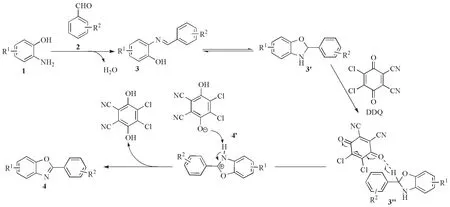
图2 反应可能的机理
2.4 Tafamidis药物合成运用
目前,Shi等[19]、Yamamoto等[23]、Wu等[24]、Liu等[25]、Zhang等[26]、Ferlin等[27]和Wu等[28]利用新的方法合成了Tafamidis。但这些合成路线中仍存在一定局限性:(1)过渡金属钯、铜、铱、镍和钴作为催化剂,价格昂贵且会产生金属残留;(2)需要使用的试剂、原料和催化剂不易得,有些试剂具有一定毒性和危险性;(3)部分合成路线条件较苛刻,操作流程复杂,副产物较多,产率较低,不利于实现工业化运用。
因此,为了进一步验证本文一锅两步法氧化环化合成2-取代苯并恶唑方法的实用性,以廉价易得的4-氨基-3-羟基苯甲酸甲酯5与3,5-二氯苯甲醛6为原料,利用一锅两步法氧化环化合成药物前体7,最后水解得到Tafamidis药物(图3)。实验结果发现,毫克级合成前体7的分离产率达到82%,水解7的甲酯获得Tafamidis,产率为92%(图3,①Milligram level experiment);随后对该合成路线进行克级放大实验,结果发现克级合成前体7的分离产率可达到75%,水解甲酯获得Tafamidis的产率为93%(图3,②Gram scale experiment)。与已报道的方法相比,该策略为Tafamidis的合成提供了一种经济、绿色、高效、简便的新合成方法。
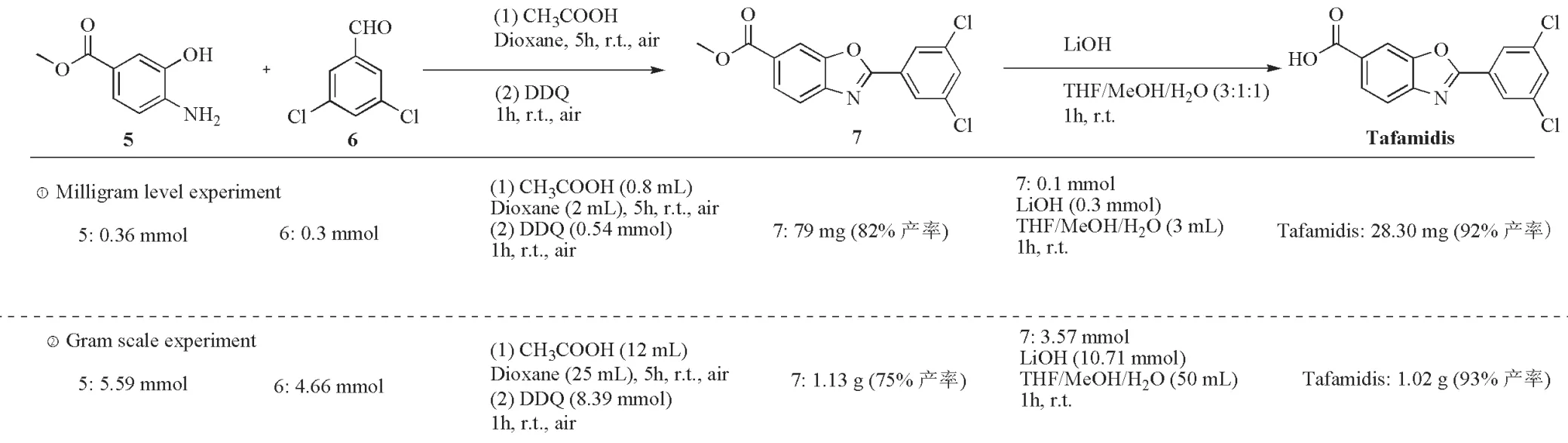
图3 他法米迪毫克级与克级合成路线
3 结论
总之,本文发展了一种实用、经济、高效的方法合成2-取代苯并恶唑衍生物。通过一锅两步法,利用DDQ氧化环化合成一系列产率良好的2-取代苯并恶唑类化合物。此外,还将该方法成功运用于罕见病药物Tafamidis的合成中,实现了该药物的克级合成。该法具有反应条件温和、操作简便、底物普适性广和官能团兼容性良好等优点,为2-取代苯并恶唑类药物及重要中间体的合成提供了一种新途径。

