合肥地区献血者血液筛查非重复反应性标本与OBI 标本间HBV 血清学特征分析
李明睿 王婷 陈志超 王婷婷 何晴
(安徽省血液中心,安徽 合肥 230031)
在现有的血液筛查策略中,隐匿性乙型肝炎病毒感染(occult hepatitis B virus infection,OBI)的诊断依赖于在HBsAg 检测呈阴性的个体的血液中检测到HBV DNA[1]。 目前本科室使用的血液筛查核酸检测(NAT)设备为Grifols 公司的Panther 检测系统(使用Procleix Ultrio Elite 试剂)和Roche 公司的Cobas s201 检测系统(使用Cobas TaqScreen MPX v2.0 试剂)。 在实际工作中,区别于Cobas s201 系统检测出的核酸反应性标本可以得到明确的反应性项目,Panther 系统检测出联检反应性的标本,鉴别检测的结果可能为阴性。 血液筛查检测中HBsAg 阴性且联检反应性鉴别阴性的标本并不符合OBI 的定义,可归类于核酸重复检测非反应性(non-reproducible reactivity,NRR)标本,已被广泛报道[2]。 此类NRR 标本在高灵敏度的NAT 设备上只能得到病毒联合检测反应性的结果,无法重复鉴别检测出具体感染病原体的项目,故也无法确认献血者实际被哪种病毒感染或是否可能因核酸联检结果假阳性导致鉴别结果为阴性,对血液安全状态的评估和献血者的结果告知工作产生影响。 同时根据本站现行献血者归队的策略,此类NAT 阳性标本的献血者将被屏蔽,当献血者再次献血时被告知因NAT 阳性无法继续献血,导致献血者对血液检测结果产生疑问。 因此需要对NRR 标本的病毒感染状态进行评估。 本站单核酸联检反应性标本鉴别检测反应性结果主要以HBV DNA 为主[3],据此,我们对NRR 标本中可能存在的HBV 感染展开补充检测分析,通过对联检反应性鉴别阴性的标本补充单人份NAT(PCR 法)和乙肝血清学标志物的检测,并与已检出HBV DNA 的OBI 标本中HBV血清学检测结果相比较,了解NRR 标本与OBI 标本在HBV 血清学特征和血清学模式组合的相关性,为评估NRR 标本中存在HBV 感染状态和NAT反应性标本对应献血者的归队方案提供实践依据。
1 材料与方法
1.1 标本来源
2021 年1 月—2023 年1 月合肥市中心血站采集的经HBsAg 金标试纸条、ALT 和Hb 初筛检测且均符合《献血者健康检查要求》(GB18467-2011)的献血者血液标本。 按照《血站技术操作规程(2019版)》要求排除溶血、脂血、不足量等不合格标本。
1.2 试剂与仪器
HBsAg 检测试剂盒(北京万泰公司,批号:B20201139;瑞 士Roche 公 司, 批 号: 55923601、57759001、60851501),抗-HBs 检测试剂盒(北京万泰公司,批号:R20210101B;瑞士Roche 公司,批号:54179801、56377402、58558702);HBeAg 检测试剂盒(北京万泰公司,批号:X20201108B;瑞士Roche 公司,批号:52898801、59736001);抗-HBe 检测试剂盒(北京万泰公司,批号:Z20201219B;瑞士Roche 公司,批号:50665002、58450402);抗-HBc 检测试剂盒(北京万泰,批号:K20201211B;瑞士Roche 公司,批号:55043901、55043902、60033301);NAT 试剂盒Procleix Ultrio®Elite(西班牙Grifols 公司,批号:702597,703037,703460,704273,704700,705173);NAT 试剂盒Cobas®TaqScreen MPX v2.0(瑞士Roche 公司,批号: G16011, G29865, H06828, H18062)。 Microlab STAR 液体处理工作站、FAME 24/30 全自动酶免分析仪(瑞士Hamilton 公司);Multiskan FC 酶标仪(美国Thermo 公司);Procleix Panther®System(西班牙Grifols 公司);E411 电化学发光仪、Cobas®s201 核酸检测系统(瑞士Roche 公司);1300 SERIES A2 生物安全柜(美国Thermo 公司)。
1.3 方法
1.3.1无偿献血者的血液筛查
对所有无偿献血者的血液标本完成ALT 检测、ELISA 检测和NAT。 ALT 检测采用速率法。 ELISA的检测模式为双试剂检测,酶免初检反应性标本用相同试剂对原血样做双孔复试。 NAT 采用6 份标本混样检测的混检模式(MP6-NAT)或单标本的联检(combined ID-NAT)模式。 混样模式筛查出HBV DNA 反应性的标本完成拆分/单检(ID-NAT)以确定HBV DNA 反应性标本;联检模式筛查出联检反应性标本。 NAT 中所有标本随机选择1 种NAT 模式完成筛查试验,NAT 各系统内每批次试验均设立阴阳对照和室内质控,并通过仪器比对验证。 随机选择部分ALT≤50 IU/mL、ELISA 无反应性、NAT HBV DNA 反应性或联检反应性、标本量可满足补充检测的NAT 单反应性标本纳入研究范围。
1.3.2NAT 单反应性标本的补充检测和入组
纳入研究范围的NAT 单反应性标本中,TMA法联检反应性标本分别完成TMA 法鉴别检测和PCR 法单检。 2 种补充检测的结果均无反应性的标本判定为NAT NRR 标本,纳入NAT NRR 标本组;2 种补充检测的结果中任1 种方法检测出HBV DNA 反应性即确证为NAT 重复检测反应性(NAT reproducible reactivity,NAT RR),与PCR 法检测出HBV DNA 反应性标本一同纳入OBI 标本组。
1.3.3HBV 血清标志物检测
入组的全部标本采用ELISA 法或电化学发光法完成HBV 相关项目的血清学检测,包括HBsAg、抗-HBs、HBeAg、抗-HBe 和抗-HBc。
1.3.4OBI 标本的判定
HBsAg 阴性,鉴别检测或单人份NAT(PCR法)中任1 种方法检出HBV DNA 反应性标本即判定为OBI 标本。
1.3.5NAT 反应性标本入组检测流程
见图1。
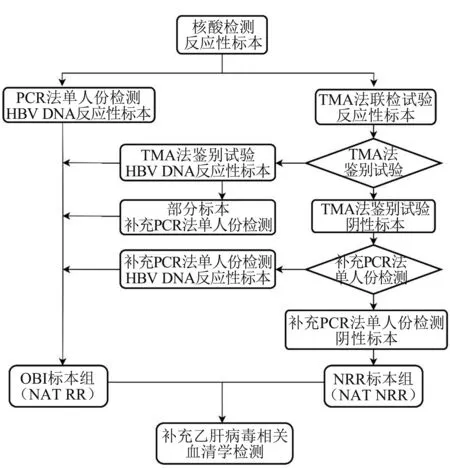
图1 NAT 反应性标本入组检测流程示意图Figure 1 Schematic diagram of detection and grouping process for NAT reactive samples
1.4 统计学分析
使用SPSS26.0 软件进行数据统计分析,计数资料组间比较采用χ2检验,P≤0.05 为差异有统计学意义。
2 结果
2.1 单NAT 反应性标本检测结果和待研究标本的选择
2021 年1 月—2023 年1 月本站共检测献血者标本262 150 份,共检测出单NAT 反应性标本234(0.89‰)份,其中Cobas s201 检测系统检出HBV DNA 反应性标本100 份,检出率0.05%;Panther 检测系统检出联检反应性标本134 份,检出率0.20%。134 份联检反应性标本中鉴别出HBV DNA 反应性33 份,鉴别阳性率24.63%。 从Cobas s201 检测系统检出的100 份HBV DNA 反应性标本中随机选取52 份标本,从Panther 检测系统检出的134 份联检反应性标本中随机选取92 份标本,共144 份标本纳入研究范围。
2.2 联检反应性标本后续检测的结果
92 份联检反应性标本完成TMA 法鉴别试验,其中87 份标本补充PCR 法单人份检测,结果见表1。 将不同鉴别结果的标本分组,补充PCR 法单人份检测,结果见表2。
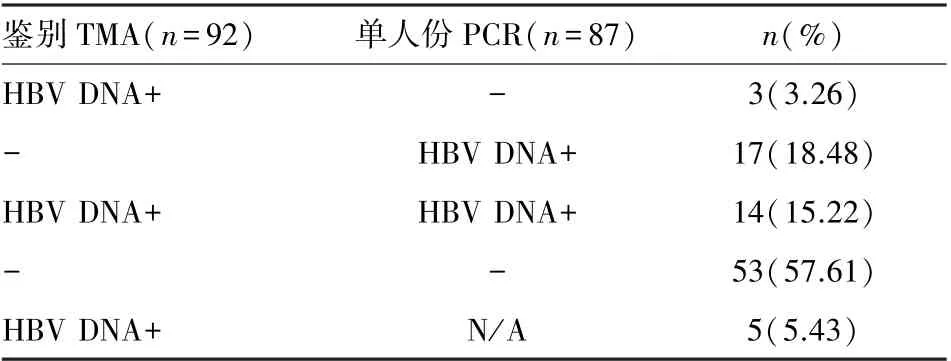
表1 联检反应性标本后续检测结果Table 1 Results of follow-up testing of reactive samples of ID-NAT

表2 不同鉴别结果标本补充PCR 法单人份检测的结果(n,%)Table 2 Results of supplemental PCR assays for samples with different discriminatory results(n,%)
2.3 NAT 单反应性标本的乙肝血清学检测结果
根据补充检测结果将纳入研究范围的144 份标本分为2 组,NRR 标本组53 份,OBI 标本组91份,全部完成HBV 相关血清学检测,结果见表3。在NRR 标本组与OBI 标本组的血清学模式比较见表4。 NRR 标本组在模式1 和模式2 中的标本共7份,主要以联检低值的标本为主,S/CO 值为1 ~3的标本共有5 份,占比71.43%;OBI 标本组中,12号标本的Ct 值偏高,鉴别结果的值偏低,提示可能是1 个HBV 低浓度标本,见表5。

表3 NRR 标本组与OBI 标本组血清学检测结果比较(n,%)Table 3 Comparison of serological results between NRR group and OBI group (n,%)
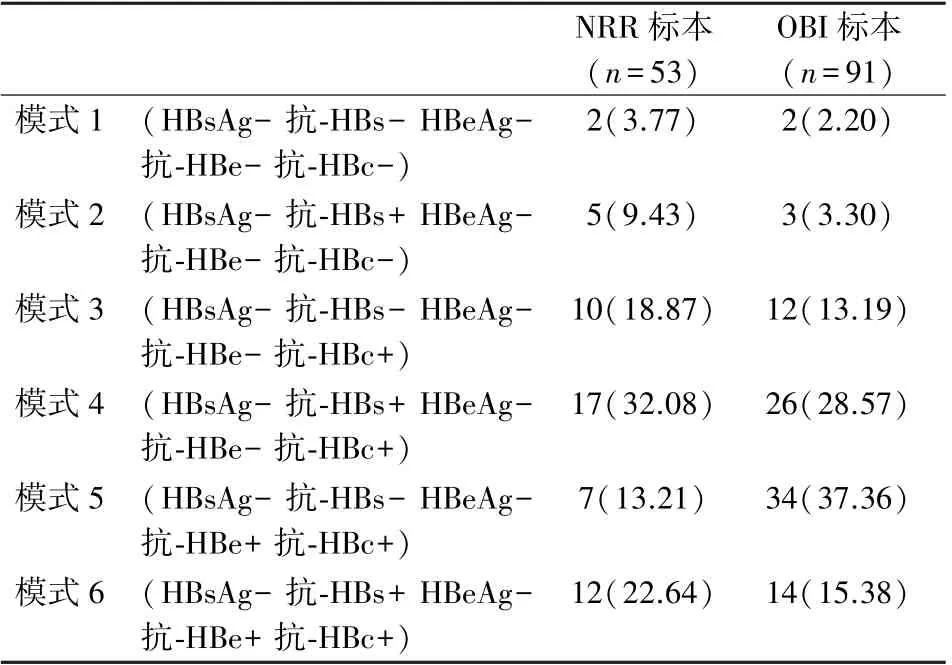
表4 NRR 标本组与OBI 标本组的血清学模式比较(n,%)Table 4 Comparison of serological patterns between the NRR group and OBI group(n,%)
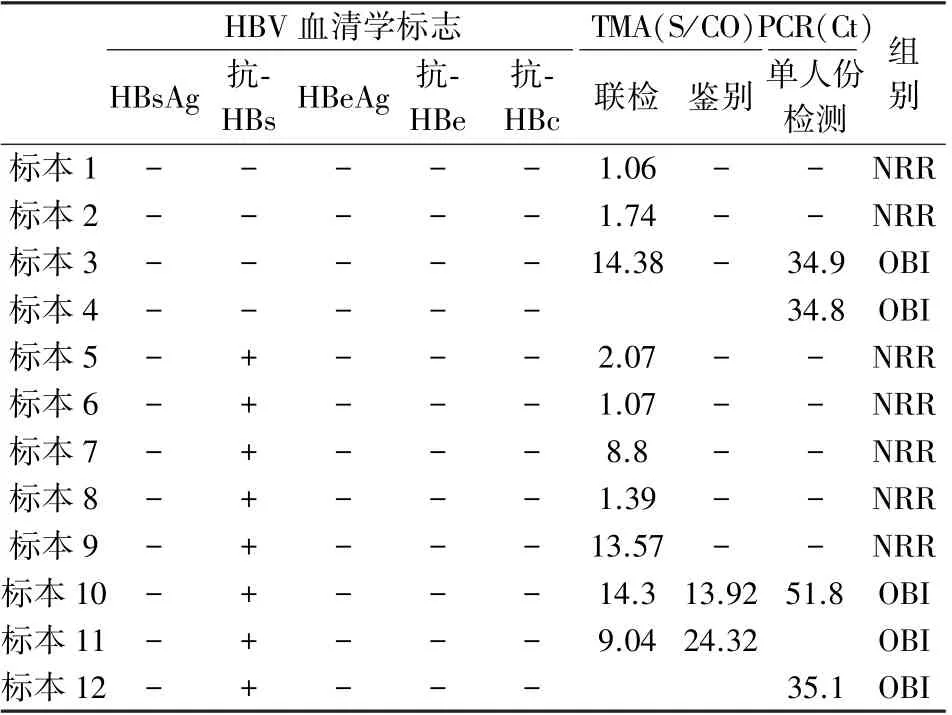
表5 HBV 血清学标志物检测结果全阴和仅抗-HBs 阳性标本的HBV DNA 定性结果Table 5 HBV DNA results for HBV serological markers with all negative results and anti-HBs positive samples only
3 讨论
OBI 患者血清中的HBV DNA 经常以极低的浓度存在,并可能存在机会性检出的现象[1]。 提高NAT 灵敏度被认为是降低机会性检出、提高检出率的最佳选择[4]。 本站目前使用的2 套NAT 系统的最低检出限分别为2.3 IU/mL 和3.4 IU/mL,能够筛选出低浓度的HBV DNA,NAT 反应性标本检出率0.89‰,与倪修文等[5]报道的嘉兴地区OBI 流行率0.89‰相近。 在NAT 反应性标本中,TMA 法联检反应性标本占所有联检标本的0.20%,与吴亚玲等[6]报道的0.22%相近。 TMA 法联检反应性的阳性率(0.20%)高于PCR 法的阳性率(0.05%),但联检反应性标本鉴别试验时,鉴别阳性率仅有24.63%,因此大量鉴别阴性的标本其病毒感染状态需要确认。 为了尽可能降低复检时病毒漏检概率,我们对ELISA 阴性、联检反应性标本完成了TMA法鉴别检测和PCR 法单人份检测,同时检测HBV DNA/HCV RNA/HIV RNA,筛选出2 种方法复检均为阴性的NRR 标本。 通过对NRR 标本和检出HBV DNA 的OBI 标本进一步补充HBV 血清学检测,了解NRR 标本与OBI 标本在HBV 感染状态上的相关性,并根据检测数据讨论血液筛查反应性献血者归队的策略。
本研究中共87 份联检反应性标本完成1 次TMA 法鉴别检测和1 次PCR 法单人份检测,其中53 份标本在2 种方法的检测中均表现为无反应性,占比60.92%。 与吴亚玲等[6]报道的69.06%相近。 根据鉴别结果将87 份标本分为鉴别HBV DNA 反应性的OBI 标本组和鉴别阴性标本组,2 组标本在PCR 法单人份检测的检出率并不一致,鉴别HBV DNA 反应性组中82.35%的重复检出率远高于鉴别阴性组的24.29%(表2)。 鉴别HBV DNA阳性组的标本使用PCR 法检测共有3 份标本未重复检出,可能与HBV DNA 持续低水平复制,血清中HBV DNA 水平很低有关[7]。 而鉴别阴性组中用PCR 法共检出17 份标本HBV DNA 反应性,证实了部分鉴别阴性标本中存在HBV 感染。 综合检测结果,增加PCR 法复检有利于降低鉴别检测时HBV DNA 的漏检概率,但TMA 鉴别法和PCR 法都存在一定的局限性,仅使用1 种方法检测时存在漏检的可能。 同时在实际检测过程中,仍有较多联检反应性双试剂复检均为阴性的NRR 标本的病毒感染状态需要被确认。
比较NRR 标本组和OBI 标本组的乙肝血清学检测结果,2 组在抗-HBc 项目的阳性率上均无差异(表3、表4),NRR 标本组86.79%的阳性率与OBI标本组94.51%的阳性率相接近,均远高于国家疾控中心调查发布全国平均34.1%的阳性流行率[8]。抗-HBc 阳性提示HBV 现症感染或既往感染,并且因半衰期较长,血液中存在持续时间也较长。 抗-HBc 经常作为补充性的血清学标志物,辅助判断献血者的感染状态[1]。 本研究中NRR 标本组中抗-HBc 的阳性率为86.79%。 与任亚娜等[9]报道的89.5%和邓雪莲等[10]报道的87.0%基本相符。 提示相当部分的NRR 标本仍存在HBV 感染的风险。在抗-HBs 项目的对比中,NRR 标本组的阳性率为64.15%,OBI 阳性标本组的阳性率为47.25%,抗-HBs 和抗-HBc 同时阳性的比例也要高于OBI 标本组,与叶贤林等[11]报道的2 组抗-HBs 阳性率60%和53.8%相近。 在抗-HBe 项目的对比中,NRR 标本组中抗-HBe 的阳性率相比OBI 阳性标本组低,而抗-HBe 阳性的标本其抗-HBc 结果均为阳性。抗-HBe 的出现多见于急性肝炎恢复期,也可见于慢性肝炎、肝硬化患者,常在HBsAg 接近消失或已经消失时检出,因此抗-HBe 阳性的献血者也有较大可能存在HBV 暴露的风险。 2 组标本在抗-HBs和抗-HBe 项目的阳性检出率存在差异(P<0.05),也在血清学模式的表现上有所区别。 在NRR 标本组中,表现最多的血清学模式为模式4(抗-HBs+/抗-HBc+),其次为模式6(抗-HBs+/抗-HBe +/抗-HBc+),而OBI 标本组中,表现最多的血清学模式为模式5(抗-HBe+/抗-HBc+),其次为模式4(抗-HBs+/抗-HBc+)。 血清学模式的区别提示NRR 标本与OBI 标本在HBV 感染状态上可能存在一定区别。 值得注意的是,2 组标本的血清学模式里均有2 份HBV 血清学标志物检测全阴的标本。 邓雪莲等[12]发现HBV 血清学阴性献血者中仍有46.8%可确认HBV DNA,本研究也验证了血清学全阴的标本检出HBV DNA 反应性(表5)。 因此对于NRR标本组和OBI 标本组出现的血清学全阴结果的标本无法简单断定为NAT 检测假阳性,需要通过随访问询和追加检测进行HBV 感染的确认,同时也需要关注是否存在HCV 或HIV 早期感染的可能性。 2 组标本的HBV 血清学表现中,仅抗-HBs 阳性的标本例数也较接近,分别为NRR 标本组的5例和OBI 标本组的3 例。 抗-HBs 是1 种保护型抗体,常存在于HBV 感染后。 在抗-HBs 含量大于HBsAg 时发生血清学转换,此时血液中能检出抗-HBs 而无法检出HBsAg,此时抗-HBs 的保护作用仍存在争议,有研究指出病毒载量的波动可能会暂时突破血液中低水平的抗-HBs 导致HBV 的感染[13]。 此外随着乙肝疫苗(HepB)接种率的提升,乙肝5 项组合中仅有抗-HBs 阳性也可能为接种疫苗所致,故无法直接确定抗-HBs 的来源,仍需要进一步随访问询和补充试验进行确认。 综合HBV 血清学检测的结果,本研究的NRR 标本组中约有13.20%的标本HBV 感染状态需要进一步的确认,86.80%的标本存在抗-HBc 阳性和/或抗-HBe 阳性,提示可能已经存在HBV 感染。 在李凤园等[14]研究中“对NRR 标本完成HBV DNA 和HBV pgRNA 定量检测,阳性检出率26.67%”,从侧面印证了NRR 标本中确实存在HBV 感染。 受条件限制本研究未完成NRR 标本对HBV DNA 定量检测,也未完成NRR 标本对应献血者的后续追踪和随访工作,是本研究的不足之处。
综上所述,血液筛查中NAT NRR 标本仍有可能存在HBV 感染风险。 对于联检反应性,复检使用2 种核酸试剂检测均为无反应性的标本,其HBV血清学检测各项结果和模式特征与OBI 标本仍有较高的相似度,高比例的抗-HBc 阳性率仍提示NRR 标本中有相当比例存在HBV 感染。 分析其原因我们认为可能是该类标本的病毒浓度相对于检出HBV DNA 的OBI 标本更低。 病毒颗粒在标本中呈Poisson 分布,病毒浓度越低,漏检的概率越大[15],在实际检测中,无论TMA 法还是PCR 法的取样过程均存在随机性,检测位点也存在一些差异,在面对低病毒浓度标本时2 种方法都存在一定的局限性。 因此联合多种NAT 方法对NRR 标本进行检测,有助于提升NRR 标本的病毒核酸检出率。 从血液筛查反应性献血者归队策略上考虑,我们认为通过PCR 法混样+拆分(单检)或TMA 法联检+鉴别检测出HBV DNA 反应性标本,其献血者暂不适合进入归队程序。 NAT 结果为联检反应性鉴别阴性标本对应的献血者进入归队程序时,建议使用至少2 种方法不同的核酸试剂重复检测归队标本,尽可能减少病毒漏检的可能性。 同时建议补充HBV 血清学检测,HBsAg 项目和抗-HBc 项目均能较好的提示献血者可能存在的HBV 感染风险。抗-HBe 阳性多与抗-HBc 阳性同时存在,若在血清学检测中检测出HBsAg、抗-HBe 或抗-HBc 中任意1 项或多项阳性,我们认为该献血者仍具有HBV感染风险。 在本次研究中我们发现,NRR 标本中HBV 血清学全阴或仅有抗-HBs 阳性的标本多见于联检S/CO 值较低的标本,对于此类标本是否可能为NAT 假阳性,或是否存在HCV 或HIV 早期感染状态,此类献血者的体内真实感染状态值得进一步评估。 有研究认为不同年龄段或不同职业的人群在HBV 感染率和HepB 的接种率上存在差异[16],因此在随访中应关注献血者的基本信息和是否接种过HepB 等关键信息的问询,辅助评估血清学检测抗-HBs 阳性的来源。 本研究发现大多数NRR标本在补充检测中筛查出与HBV 感染相关的指标阳性,因此建议要慎重考虑核酸项目的归队策略,即使面对可能是NAT 假阳性结果的献血者,也要通过细致的问询调查和完善的补充检测结果来谨慎地评估能否归队。 血液筛查反应性献血者归队策略应在尽可能保障临床用血安全的前提下给予符合条件的献血者重新评估的路线,并做好献血者的检测后结果解释和追踪服务工作。 若能通过追踪或随访的方式找出可能因NAT 假阳性导致被屏蔽的献血者并探寻出合理的归队方案帮助其返回无偿献血者队伍,将有利于维护献血者的个人权益和保持无偿献血者队伍的稳定,保护珍贵的血液资源。

