TLR-7 对阿尔茨海默病细胞模型β 淀粉样蛋白表达及炎症反应的调控作用及机制
李 娟 蔡 萃 聂 晶 吴宇婧 张东阳
阿尔茨海默病(Alzheimer's disease,AD)是一种起病隐匿的进行性发展的中枢神经系统退行性疾病,临床表现为认知、记忆、语言、活动能力等障碍,可改变患者人格及行为等[1]。研究[2]发现,AD 的发病具有明显的家庭聚集性,其中β-淀粉样前体蛋白(β-amyloid precursor protein,APP)基因多个位点的突变与AD 的发病密切相关。APP 是在多种细胞和组织中表达的内在膜蛋白,在β 淀粉样前体蛋白裂解酶1(beta-site amyloid precursor protein cleaving enzyme 1,BACE1)等蛋白酶的作用下水解成为β 淀粉样蛋白(β-amyloid,Aβ),并在神经细胞中沉积产生神经毒性,导致神经细胞功能损伤,引起AD 的发生[3]。Toll 样受体(Toll-like receptor,TLRs)同源分子是典型的跨膜模式识别受体,可以响应多种细胞内外信号的刺激,调控细胞炎症因子的表达和分泌,引发炎症反应及促进抗原提呈细胞的成熟,诱导机体的获得性免疫反应[4]。其中,Toll 样受体7(Toll-like receptor 7,TLR-7)可以识别微小RNA(microRNA,miRNA),并通过与miRNA 的结合参与多种细胞生理活动的调节[5]。研究发现,TLR-7 可能在神经炎症反应中发挥了重要作用[6],但其在AD 中的功能仍不清楚。本研究显示,在AD 模型人神经母细胞瘤细胞(SH-SY5Y)中,沉默TLR-7 通过靶向微小RNA-15b(miR-15b)介导核因子κB(NF-κB)信号传导及与BACE1 的表达,抑制神经细胞Aβ 的异常积累和炎症因子分泌,缓解了APP 突变引起的神经细胞损伤。
1 材料与方法
1.1 试 剂 DMEM 高糖培养基(货号11965095)、胎牛血清(货号10091148)、胰酶消化液(货号25200072)、Lipofectamine 2000 转染试剂(货号11668019)购自美国赛默飞世尔科技公司;总RNA提取试剂盒(货号DP451)、逆转录试剂盒(货号KR116)、实时荧光定量PCR 试剂(货号FP201)购自北京天根生物科技公司;双荧光素酶报告基因检测试剂盒(货号E1910)购自美国普洛麦格公司;Aβ、白介素-1β(IL-1β)、白介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)酶联免疫吸附试剂盒(货号DAB142、MLB00C、D6050、DTA00D)购自美国R&D 公司;兔抗APP 抗体、β-肌动蛋白、山羊抗兔二抗(货号ab32136、ab8653、ab6721)购自美国Abcam 公司。
1.2 仪 器 CO2培养箱(3111-GP,Thermo 公司);酶标仪(800Ts,Bio-Rad 公司);流式细胞仪(Novo-Cyte,Aceabio 公司);荧光PCR 仪(QuantStudioTM5,Thermo 公司)。
1.3 AD 细胞模型的建立 人胚肾细胞系HEK293T(货号ZQ0033,中乔新舟)和人神经母细胞瘤细胞系SH-SY5Y(货号YS3685C,上海雅吉生物)在含10%胎牛血清的DMEM 培养基中传代培养。APP 瑞典家系突变(APP695 KM670/671NL,APPswe)慢病毒包装质粒pLenti-APPswe 由本研究室构建,pLenti-APPswe 质粒与慢病毒包装辅助质粒共同转染HEK293T 细胞,转染48 h 后,收集培养基上清液,用0.45 μm 一次性滤器过滤后,加入SH-SY5Y 细胞培养基中,孵育24 h 后,加入含1.5 μg/mL 嘌呤霉素的完全培养基继续培养48 h,最终得到APP 瑞典家系突变人神经母细胞瘤细胞系(SH-SY5Y/APPswe)。
1.4 细胞转染和分组 以上述获得的SH-SY5Y/APPswe 和SH-SY5Y 细胞为研究对象,按照1.3 中的转染方法,将TLR-7 敲低质粒(sh-TLR-7)、对照质粒(sh-NC)、miR-15b 抑制质粒(miR-15b inhibitor)和对照质粒(inhibitor NC)分别转染至SH-SY5Y/APPswe 细胞中。将细胞分为SH-SY5Y 组、SHSY5Y/APPswe 组、TLR-7 敲 低SH-SY5Y/APPswe(SH-SY5Y/APPswe+sh-TLR-7)组、敲低对照SHSY5Y/APPswe(SH-SY5Y/APPswe+sh-NC)组、TLR-7敲低+miR-15b 抑制SH-SY5Y/APPswe(SH-SY5Y/APPswe+sh-TLR-7+miR-15b inhibitor)组和TLR-7敲低+miR-15b 抑制对照SH-SY5Y/APPswe(SHSY5Y/APPswe+sh-TLR-7+inhibitor NC)组。各组转染细胞系培养24 h 后收集细胞进行检测。
1.5 实时荧光定量PCR 离心收集各组细胞,加入1 mL 预冷的Trizol 裂解液室温放置5 min;加入200 μL 氯仿,充分混匀后经12000 g 4 ℃离心10 min,取上层水相500 μL,加入等体积异丙醇,12000 g 4 ℃离心10 min,弃去上清;加入1 mL 75%乙醇漂洗2次,加入无RNA 酶的焦磷酸二乙酯(DEPC)水30 μL使沉淀充分溶解总RNA。取1 μg 总RNA,用逆转录试剂盒合成cDNA,再行PCR 扩增目标基因。将所得cDNA 加至PCR 反应体系中扩增目标片段,PCR 反应体系为20 μL。PCR 反应条件为:95 ℃预变性15 min 后,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,40 个循环。最后一次循环后做溶解曲线,并采用β肌动蛋白(β-actin)做标准曲线作为参考值,所需引物序列见表1。

表1 实时荧光定量PCR 引物序列
1.6 酶联免疫吸附实验 用无菌管收集各组细胞培养基,1000 r/min 离心10 min,加入预先包被抗体的酶标板中,并设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL,样本孔中加入待测样本50 μL。4 ℃孵育2 h,再加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,4 ℃孵育2 h,随后用漂洗液充分漂洗5 次。最后在每孔加入显色底物50 μL,室温避光孵育15 min 后,加入终止液50 μL,立即酶标仪读取450 nm 波长处测定各孔的OD 值。根据标准品孔实验数据绘制Aβ、IL-1β、IL-6 和TNF-α 标准曲线,并计算各样本孔待测样品浓度。
1.7 蛋白质印迹实验 离心收集SH-SY5Y 细胞和SY-SY5Y/APPswe 细胞,加入200 μL 4 ℃预冷的放射免疫沉淀法裂解缓冲(RIPA)细胞裂解液,冰上裂解20 min,离心后取其上清液;采取BCA 法测定蛋白浓度,并调整蛋白提取液的浓度,加入5×SDS 上样缓冲液,煮沸加热5 min。在100 V 恒压条件下进行SDS-PAGE 凝胶电泳90 min,结束后,继续在100 V恒压条件下转膜2 h,后将带有蛋白样品的PVDF 膜于5%脱脂奶粉中封闭1 h,随后分别用兔抗APP 抗体(1∶3000 稀释)、β-肌动蛋白(1∶4000 稀释)和HRP山羊抗兔二抗(1∶8000 稀释),室温各孵育2 h。充分漂洗后,在膜上滴加化学发光底物,用凝胶成像仪获取蛋白印迹图片。
1.8 荧光素酶报告基因实验 用Lipofectamine 2000 转染试剂转染,将NF-κB 荧光素酶报告基因质粒pNF-κB-Luc 和对照质粒pRL-TK 转染各组细胞24 h,弃掉上清,在细胞培养板中加入500 μL 细胞裂解液,室温静置5 min,随后取20 μL 细胞裂解液加入白色不透光96 孔板,每组设置3 个复孔。先后在孔中加入萤火虫荧光素酶底物和海参荧光素底物,用酶标仪读取300~700 nm 波长自发光信号。
1.9 统计学方法 应用SPSS 18.0 软件进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间两两比较采用独立样本t 检验,以P<0.05 表示差异具有统计学意义。
2 结 果
2.1 SH-SY5Y 细胞AD 模型的建立 蛋白质印迹实验结果表明,与正常SH-SY5Y 细胞相比,慢病毒稳定转染的SH-SY5Y/APPswe 细胞APP 695 亚型表达水平上调,表明稳定细胞系构建成功,见图1。
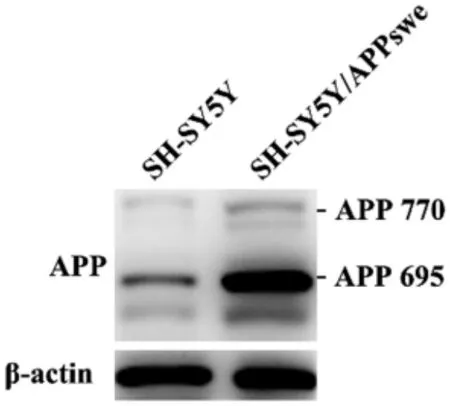
图1 蛋白质印迹实验检测APP 的表达
2.2 敲低TLR-7 对miR-15b 和BACE1 mRNA 表达及Aβ42 分泌的影响 实时荧光定量PCR 实验检测各组细胞中TLR-7、BACE1 mRNA 和miR-15b 的表达水平。酶联免疫吸附实验检测Aβ 分泌水平。与SH-SY5Y 组细胞比较,AD 模型SH-SY5Y/APPswe组细胞TLR-7、BACE1 mRNA 和miR-15b 表达水平差异无统计学意义(P>0.05),而分泌到培养基中的Aβ42 水平则显著升高(P<0.01)。与SH-SY5Y/APPswe+sh-NC 组比较,SH-SY5Y/APPswe+sh-TLR-7 组细胞TLR-7、BACE1 mRNA 表达水平显著下降(P<0.01),miR-15b 表达水平显著升高(P<0.01),Aβ42分泌水平明显降低(P<0.01),见表2。
表2 敲低TLR-7 对BACE1 mRNA、miR-15b 表达和Aβ42 分泌的影响(±s)
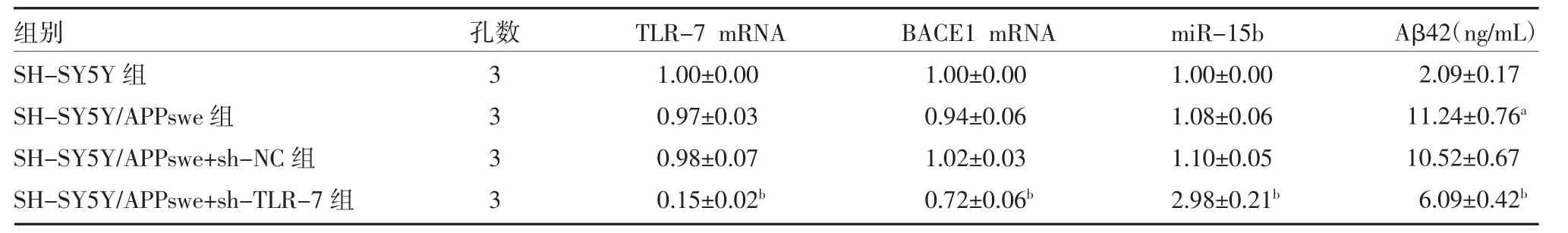
表2 敲低TLR-7 对BACE1 mRNA、miR-15b 表达和Aβ42 分泌的影响(±s)
注:SH-SY5Y 为人神经母细胞瘤细胞;SH-SY5Y/APPswe 为APP 瑞典家系突变转染SH-SY5Y;TLR-7 为Toll 样受体7;BACE1 为β 淀粉样前体蛋白裂解酶1;miR-15b 为微小RNA-15b;Aβ42 为β 淀粉样蛋白42;与SH-SY5Y 组比较,aP<0.01;与SH-SY5Y/APPswe+sh-NC 组比较,bP<0.01
组别SH-SY5Y 组SH-SY5Y/APPswe 组SH-SY5Y/APPswe+sh-NC 组SH-SY5Y/APPswe+sh-TLR-7 组孔数3333 TLR-7 mRNA 1.00±0.00 0.97±0.03 0.98±0.07 0.15±0.02b BACE1 mRNA 1.00±0.00 0.94±0.06 1.02±0.03 0.72±0.06b miR-15b 1.00±0.00 1.08±0.06 1.10±0.05 2.98±0.21b Aβ42(ng/mL)2.09±0.17 11.24±0.76a 10.52±0.67 6.09±0.42b
2.3 TLR-7 通过miR-15b 调控BACE1 的表达及Aβ42 分泌 实时荧光定量PCR 和酶联免疫吸附实验显示,与SY-SY5Y/APPswe+sh-NC 组比较,SHSY5Y/APPswe+sh-TLR-7 组BACE1 mRNA 表达和Aβ42 分泌显著降低(P<0.01,P<0.05),miR-15b 表达明显升高(P<0.01);与SH-SY5Y/APPswe+sh-TLR-7+inhibitor NC 组比较,同时敲低TLR-7 和miR-15b的SH-SY5Y/APPswe+sh-TLR-7+miR-15b inhibitor组BACE1 mRNA 表达水平显著升高(P<0.05),Aβ42 分泌水平明显升高(P<0.01),miR-15b 表达水平下降(P<0.01),见表3。
表3 敲低TLR-7 与抑制miR-15b 对BACE1 mRNA、miR-15b 表达和Aβ42 分泌的影响(±s)

表3 敲低TLR-7 与抑制miR-15b 对BACE1 mRNA、miR-15b 表达和Aβ42 分泌的影响(±s)
注:SH-SY5Y 为人神经母细胞瘤细胞;SH-SY5Y/APPswe 为APP 瑞典家系突变转染SH-SY5Y;BACE1 为β 淀粉样前体蛋白裂解酶1;miR-15b为微小RNA-15b;Aβ42 为β 淀粉样蛋白42;与SH-SY5Y/APPswe+sh-NC 组比较,aP<0.05,bP<0.01;与SH-SY5Y/APPswe+shTLR-7+inhibitor NC 组比较,cP<0.05,dP<0.01
组别SH-SY5Y 组SH-SY5Y/APPswe 组SH-SY5Y/APPswe+sh-NC 组SH-SY5Y/APPswe+sh-TLR-7 组SH-SY5Y/APPswe+sh-TLR-7+inhibitor NC 组SH-SY5Y/APPswe+sh-TLR-7+miR-15b inhibitor 组孔数333333 BACE1 mRNA 1.00±0.00 1.02±0.04 1.10±0.06 0.69±0.07b 0.71±0.05 1.39±0.42c miR-15b 1.00±0.00 0.95±0.11 1.03±0.07 3.32±0.19b 2.96±0.35 0.67±0.13d Aβ42(ng/mL)2.32±0.68 13.65±1.98 14.77±2.74 6.99±1.85a 7.47±1.58 19.54±3.01d
2.4 TLR-7 通过miR-15b 调控炎症因子IL-1β、IL-6 和TNF-α mRNA 的表达和分泌 实时荧光定量PCR 实验结果表明,与SH-SY5Y 组细胞比较,AD 模型SH-SY5Y/APPswe 组细胞IL-1β、IL-6 和TNF-α mRNA 表达水平显著升高(P<0.01)。与SH-SY5Y/APPswe+sh-NC 组比较,SH-SY5Y/APPswe+sh-TLR-7 组细胞IL-1β、IL-6 和TNF-α mRNA 表达水平显著下降(P<0.01)。与SH-SY5Y/APPswe+sh-TLR-7+inhibitor NC 组细胞比较,SH-SY5Y/APPswe+sh-TLR-7+miR-15b inhibitor 组 细 胞IL-1β、IL-6 和TNF-α mRNA 表达水平显著升高(P<0.01),见表4。
表4 各组细胞IL-1β、IL-6 和TNF-α mRNA 表达比较(±s)
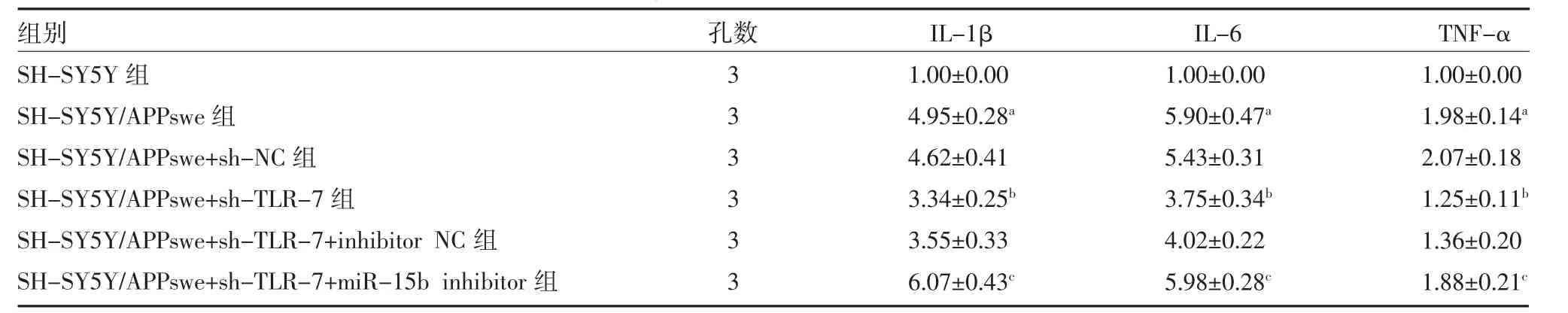
表4 各组细胞IL-1β、IL-6 和TNF-α mRNA 表达比较(±s)
注:SH-SY5Y 为人神经母细胞瘤细胞;SH-SY5Y/APPswe 为APP 瑞典家系突变转染SH-SY5Y;IL-1β 为白介素-1β;IL-6 为白介素-6;TNF-α为肿瘤坏死因子-α;与SH-SY5Y 组比较,aP<0.01;与SH-SY5Y/APPswe+sh-NC 组比较,bP<0.01;与SH-SY5Y/APPswe+sh-TLR-7+inhibitor NC组比较,cP<0.01
组别SH-SY5Y 组SH-SY5Y/APPswe 组SH-SY5Y/APPswe+sh-NC 组SH-SY5Y/APPswe+sh-TLR-7 组SH-SY5Y/APPswe+sh-TLR-7+inhibitor NC 组SH-SY5Y/APPswe+sh-TLR-7+miR-15b inhibitor 组孔数333333 IL-1β 1.00±0.00 4.95±0.28a 4.62±0.41 3.34±0.25b 3.55±0.33 6.07±0.43c IL-6 1.00±0.00 5.90±0.47a 5.43±0.31 3.75±0.34b 4.02±0.22 5.98±0.28c TNF-α 1.00±0.00 1.98±0.14a 2.07±0.18 1.25±0.11b 1.36±0.20 1.88±0.21c
酶联免疫吸附实验结果表明,与SH-SY5Y 组比较,AD 模型SH-SY5Y/APPswe 组IL-1β、IL-6 和TNF-α 分泌水平显著升高(P<0.01)。与SH-SY5Y/APPswe+sh-NC 组比较,SH-SY5Y/APPswe+sh-TLR-7 组IL-1β、IL-6 和TNF-α 分泌水平显著下降(P<0.01)。与SH-SY5Y/APPswe+sh-TLR-7+inhibitor NC组比较,SH-SY5Y/APPswe+sh-TLR-7+miR-15b inhibitor 组IL-1β、IL-6 和TNF-α 分泌水平显著升高(P<0.05),见表5。
表5 各组细胞IL-1β、IL-6 和TNF-α 分泌水平比较(pg/mL,±s)
注:SH-SY5Y 为人神经母细胞瘤细胞;SH-SY5Y/APPswe 为APP 瑞典家系突变转染SH-SY5Y;IL-1β 为白介素-1β;IL-6 为白介素-6;TNF-α为肿瘤坏死因子-α;与SH-SY5Y 组比较,aP<0.01;与SH-SY5Y/APPswe+sh-NC 组比较,bP<0.01;与SH-SY5Y/APPswe+sh-TLR-7+inhibitor NC组比较,cP<0.05
组别SH-SY5Y 组SH-SY5Y/APPswe 组SH-SY5Y/APPswe+sh-NC 组SH-SY5Y/APPswe+sh-TLR-7 组SH-SY5Y/APPswe+sh-TLR-7+inhibitor NC 组SH-SY5Y/APPswe+sh-TLR-7+miR-15b inhibitor 组孔数333333 IL-1β 57.20±4.95 112.43±10.89a 101.76±7.95 61.40±7.76b 68.62±5.41 155.32±13.67c IL-6 117.62±19.57 982.42±78.84a 893.35±101.43 547.29±39.11b 439.73±60.01 1255.49±119.79c TNF-α 137.89±21.37 356.17±29.08a 375.28±33.99 256.17±24.32b 227.82±26.53 423.66±34.32c
2.5 TLR-7 通过miR-15b 调控NF-κB 信号通路的激活 荧光素酶报告基因实验结果显示,与SHSY5Y 组比较,AD 模型SH-SY5Y/APPswe 组NF-κB荧光素酶活性显著升高(P<0.01)。与SH-SY5Y/APPswe+sh-NC 组比较,SH-SY5Y/APPswe+sh-TLR-7 组NF-κB 荧光素酶活性显著下降(P<0.01)。与SHSY5Y/APPswe+sh-TLR-7+inhibitor NC 组比较,SH-SY5Y/APPswe+sh-TLR-7+miR-15b inhibitor 组NFκB 荧光素酶活性显著升高(P<0.01),见表6。
表6 各组细胞NF-κB 相对荧光素酶活性(±s)

表6 各组细胞NF-κB 相对荧光素酶活性(±s)
注:SH-SY5Y 为人神经母细胞瘤细胞;SH-SY5Y/APPswe 为APP 瑞典家系突变转染SH-SY5Y;NF-κB 为核因子κB;与SH-SY5Y 组比较,aP<0.01;与SH-SY5Y/APPswe+sh-NC 组比较,bP<0.01;与SH-SY5Y/APPswe+sh-TLR-7+inhibitor NC 组比较,cP<0.01
组别SH-SY5Y 组SH-SY5Y/APPswe 组SH-SY5Y/APPswe+sh-NC 组SH-SY5Y/APPswe+sh-TLR-7 组SH-SY5Y/APPswe+sh-TLR-7+inhibitor NC 组SH-SY5Y/APPswe+sh-TLR-7+miR-15b inhibitor 组孔数333333相对荧光素酶活性1.00±0.00 5.27±0.44a 5.01±0.52 3.25±0.31b 3.58±0.27 5.91±0.66c
3 讨 论
尽管AD 是一类多因素疾病,但Aβ 的异常积累被认为是诱发AD 的最主要因素,APP 蛋白在以BACE1 为主的水解酶作用下分解产生Aβ,并伴随自由基释放,引发细胞氧化损伤,诱发慢性炎症,进而影响神经细胞膜结构与功能[7]。研究[8]发现,BACE1 在AD 患者大脑中的表达和活性水平均呈现明显的增强,因而BACE1 一直被作为AD 治疗和药物开发的重要靶点。此外,研究BACE1 在AD 疾病进展中的调控机制,也是该领域的热点问题。神经系统慢性炎症反应伴随了AD 的整个发病过程,在正常的生理状态下,神经炎症有助于神经系统损伤的修复,而当炎症反应过度时则会造成细胞损伤,加速AD 恶化,因此,炎症反应在AD 中极其重要,适度调控炎症反应将对AD 的治疗大有裨益[9]。TLR-7 受体及其下游信号通路在炎症反应的调控中发挥了重要作用。Mottas 等[10]研究发现,TLR-7 可以诱导Aβ 摄取及炎症反应,从而在AD 发病过程中发挥作用,而Ren 等[11]研究发现,TLR-7 的激活可以下调B 淋巴细胞miR-15b 的表达。本研究发现,在过表达APPswe 的AD 模型SH-SY5Y 细胞中,敲低TLR-7 可导致miR-15b表达水平的上调和BCAE1 表达水平下调,并抑制了Aβ42 的分泌(P<0.01)。为了进一步研究TLR-7 是否通过miR-15b 调控BACE1 的表达,本研究通过miR-15b inhibitor 在TLR-7 敲低的细胞中进一步抑制miR-15b 的表达,结果证实了抑制miR-15b 可以恢复SH-SY5Y/APPswe 细胞BCAE1 mRNA 的表达和Aβ42 的分泌(P<0.05,P<0.01)。
有研究[12]发现,NF-κB 的激活在包括AD 在内的神经炎症性疾病中扮演着重要的角色,在AD 发病过程中,Aβ 诱导的NF-κB 激活上调了促炎细胞如IL-1β、IL-6 等的表达,也有研究[13]表明,NF-κB 活化可刺激BACE1 和APP 的表达。本研究也发现,在SH-SY5Y/APPswe 细胞中,TLR-7 可以通过miR-15b 调控NF-κB 的转录活性及IL-1β、TNF-α 和IL-6 等炎症因子的分泌,这提示TLR-7/miR-15b 对BACE1 和Aβ 分泌的影响可能是通过对NF-κB 信号调节实现的。
综上所述,本研究揭示了TLR-7/miR-15b 对AD 模型SH-SY5Y/APPswe 细胞的Aβ 分泌和炎症因子表达的重要调控作用和分子机制,提示TLR-7/miR-15b 在抑制Aβ 积累和神经炎症反应中潜在的靶点作用,为AD 的致病机制和干预策略的研究提供了新思路。

