99mTc-MDP SPECT/CT 联合血清碱性磷酸酶和钙离子诊断单发骨转移瘤的价值研究
朱碧莲 郑 勇 董 科
骨骼是恶性肿瘤最常见的转移部位之一,随着恶性肿瘤的发病率逐年升高,骨转移瘤在恶性肿瘤中的检出率越来越高。目前,临床广泛用于骨转移瘤诊断和监测随访的检查方法主要有X 线片、多层螺旋CT(multi-slice spiral computed tomography,MSCT)、MRI 等,检查范围局限、敏感性较低,只有当骨转移瘤出现明显的形态学改变时才能显示病灶,无法反映骨转移瘤的早期代谢改变[1]。单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT)骨显像是一种筛查骨病变的重要方法,但是对良性骨病变与肿瘤骨转移的区分仍较为困难,尤其是对有恶性肿瘤病史的患者[2]。SPECT/CT 同机融合显像将组织代谢与结构相结合,为提高全身骨显像诊断的准确性提供了重要依据[3]。此外,血清碱性磷酸酶(alkaline phosphatase,ALP)和钙离子(calciumion,Ca2+)是反映成骨和溶骨活动的重要标志物[4]。文献[5]认为,血清ALP 和Ca2+有助于判断肺癌骨转移,特异度可能高于SPECT。本研究探讨99mTc-亚甲基二膦酸盐(methylene dipho-sphonate,MDP)SPECT/CT 骨显像联合血清ALP 和Ca2+诊断单发骨转移瘤的应用价值。
1 资料与方法
1.1 一般资料 回顾性纳入2021 年1 月至2022 年12 月浙江大学医学院附属金华医院(金华市中心医院)确诊恶性肿瘤伴单发骨质病变患者106 例,其中男62 例,女44 例,年龄48~79(65.6±12.3)岁;原发恶性肿瘤类型:肺癌59 例,乳腺癌22 例,前列腺癌25 例。本研究经浙江大学医学院附属金华医院(金华市中心医院)医学伦理委员会审查通过[批准文号:(研)2021-伦理审查-285]。
1.2 纳入及排除标准 (1)年龄>18 岁;(2)有明确的原发恶性肿瘤病灶;(3)继发单灶骨质病变,常规影像学(X 线、CT 或者MRI)无法准确判断良恶性质;(4)顺利完成99mTc-MDP SPECT/CT 全身和局部骨显像,并根据骨显像结果判断单发骨质病变的良恶性质,图像清晰可保存;(5)有最终骨质病变的良恶性质诊断结果。排除标准:(1)既往骨肿瘤手术、放化疗史;(2)原发骨肿瘤病变、多发骨肿瘤;(3)对骨显像对比剂过敏。
1.3 研究方法 入院后1 周内完成99mTc-MDP SPECT/CT 全身和局部骨显像,24 h 内检测血清ALP和Ca2+水平(采用贝克曼AU5831 生化分析仪及配套试剂进行检测)。常规随访6 个月,根据单发骨质病变病理或者综合影像(CT 和MRI)表现确诊骨质病变的良恶性。
SPECT/CT 骨显像:采用荷兰PHILIPS 公司Brightview XCT SPECT/CT(140 层平板CT)。扫描范围包括病灶全部,图像用Autospect 程序处理,获得断层图像;采用Fusion viewer 软件进行SPECT/CT图像融合。显影剂为99mTc-MDP,放射化学纯度>95%,购自原子高科股份有限公司。静脉注射99mTc-MDP(740 MBq)后3~6 h,排空尿液,采用低能高分辨率准直器,按照常规方法先行全身平面骨显像,然后以病灶部位为中心,分别采集CT 和SPECT 图像。CT采集条件:120 kV,20 mA,图像重建层厚 1 mm。SPECT 采集条件:双探头平行采集,分别旋转180°,15 s/帧,矩阵64×64。骨转移瘤阳性判断标准[6]:SPECT 表现为单发异常放射性浓聚或缺损,CT 表现为融骨或成骨性破坏,可伴软组织影,或病灶短期内进展、活检及手术病理证实;否则判断为阴性。由2 名经验丰富的核医学专家分别在不知情的情况下进行判断。
1.4 统计学方法 应用SPSS 22.0 统计软件分析数据,符合正态分布的计量资料用均数±标准差(±s)表示,采用t 检验;计数资料以率表示,用χ2检验。以病理或者综合诊断结果为金标准,判断骨显像诊断骨转移瘤的准确率、灵敏度、特异度、阳性预测值和阴性预测值。受试者工作曲线(receiver operating curve,ROC)计算曲线下面积(area under the curve,AUC)、敏感度和特异度。P<0.05 为差异有统计学意义。
2 结 果
2.1 两组恶性肿瘤患者一般资料比较 根据骨质病变的病理或者综合影像表现最终确诊骨转移瘤阳性44 例(骨转移瘤组)和阴性62 例(阴性组),两组患者性别、年龄、原发肿瘤类型和骨肿瘤分布比较,具有可比性(P>0.05)。见表1。

表1 两组恶性肿瘤患者一般资料比较
2.2 骨显像诊断骨转移瘤的价值 骨显像诊断骨转移瘤阳性53 例和阴性53 例(典型病例见图1~2),骨显像诊断骨转移瘤的准确率为78.3%(83/106),灵敏度为84.1%(37/44),特异度为74.2%(46/62),阳性预测值为69.8%(37/53),阴性预测值为86.8%(46/53)。见表2。

表2 恶性肿瘤患者骨显像诊断骨转移瘤的价值(例)
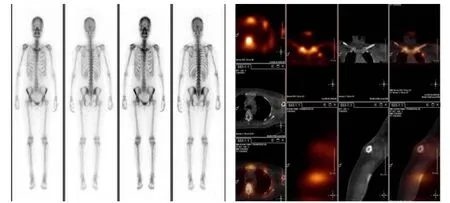
图1 典型病例1(SPECT/CT 显示良性骨质病变)
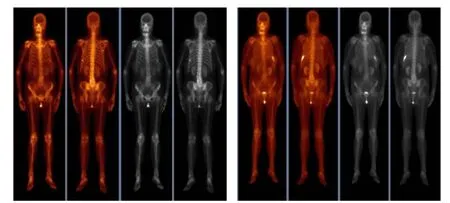
图2 典型病例2(SPECT/CT 显示骨转移瘤阳性的两次对比图像)
2.3 两组恶性肿瘤患者血清ALP 和Ca2+水平比较骨转移瘤组血清ALP 和Ca2+水平显著高于阴性组,差异有统计学意义(P<0.01)。见表3。
表3 两组恶性肿瘤患者血清ALP 和Ca2+水平比较(±s)
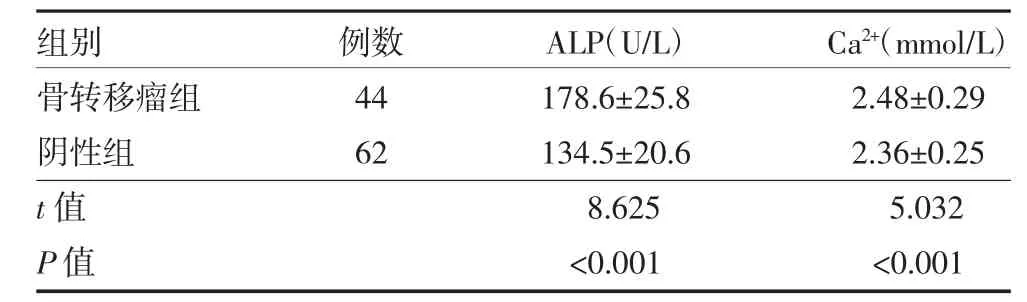
表3 两组恶性肿瘤患者血清ALP 和Ca2+水平比较(±s)
注:ALP 为碱性磷酸酶;Ca2+为钙离子
组别骨转移瘤组阴性组t 值P 值例数44 62 ALP(U/L)178.6±25.8 134.5±20.6 8.625<0.001 Ca2+(mmol/L)2.48±0.29 2.36±0.25 5.032<0.001
2.4 骨显像+ALP+Ca2+联合诊断骨转移瘤的ROC ROC 显示,骨显像+ALP+Ca2+联合诊断骨转移瘤的AUC 为0.876(95%CI=0.823~0.924,P<0.01),敏感度为88.6%,特异度为90.5%。见图3。
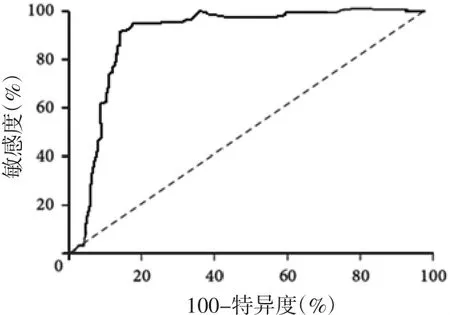
图3 骨显像+ALP+Ca2+联合诊断骨转移瘤的ROC 曲线
3 讨 论
SPECT 对于恶性肿瘤出现全身骨转移诊断并不难,但是对于一些单发骨质病变的早期诊断也经常出现困难,需要联合骨代谢标志物才能早期做出良恶性质判断[7],制定更恰当的干预方案。SPECT/CT 根据显影剂99mTc-MDP 与骨组织离子交换和吸附结合的原理,有别于解剖影像,是目前唯一一种基于自身功能的组织代谢学显像;其成像取决于骨组织的血流、细胞功能和数量以及代谢活跃程度等因素[8];通常可以比X 线片提前3~6 个月甚至更早时间发现转移性骨肿瘤[9]。骨转移对肿瘤分期及治疗方案的选择非常重要,早期诊断可以缩短住院时间,减少医疗费用,改善生存预后[10]。《肺癌骨转移诊疗专家共识》已将SPECT 列入筛查骨转移的首选方法[11]。
本研究显示,原发恶性肿瘤单发骨转移瘤阳性的发生率为41.5%(44/106)。CT 虽然对于骨转移瘤的敏感度较高,能够评价骨质破坏的程度,但是对于骨皮质早期转移的准确性较差[12]。本研究显示,单纯依赖骨显像诊断骨转移瘤的准确率为78.3%,灵敏度为84.1%,特异度为74.2%,阳性预测值为69.8%、阴性预测值为86.8%。苏应瑞等[13]研究显示,99mTc-MDP SPECT/CT 断层融合显像鉴别脊柱良、恶性病变的准确率、灵敏度及特异度可能高于全身平面骨显像。也有研究[14]将SPECT、ALP、Ca2+随机组合,发现三者组合时诊断效能最优,其敏感度、特异度、准确度、阳性预测值和阴性预测值分别是为94.74%、71.43%、90.78%、94.14%和73.53%,提示组合模型的诊断效能高于单一技术。本研究也发现,骨转移瘤组血清ALP 和Ca2+水平显著高于阴性组(P<0.01)。鲍彩丽等[15]研究表明,99mTc-MDP SPECT/CT 融合显像联合ALP 诊断肺癌骨转移的性能较好。本研究显示,骨显像+ALP+Ca2+联合诊断骨转移瘤的AUC 为0.876,敏感度为88.6%、特异度为90.5%。同样提示骨显像联合骨代谢标志物能够进一步提高单发骨转移瘤的诊断价值。由于SPECT 的假阳性和骨质破坏的延后性,暂无骨质破坏而SPECT 阳性的早期病灶,存在一定的鉴别困难[16]。
SPECT 还可以定量检测肿瘤的骨代谢相关参数,贾明胜等[17]研究显示,标准化摄取值(standardized uptake value,SUV)max 与SUVmean 对判断脊柱骨转移瘤有一定的应用价值。倪明等[18]比较了18F-NaF PET/CT 与99mTc-MDP 骨显像诊断乳腺癌伴骨转移瘤的价值,显示99mTc-MDP 骨显像的总体性能可能不如18F-NaF PET/CT,但是99mTc-MDP 骨显像的应用技术更成熟,费用更低。Zhou 等[19]研究显示,SPECT/CT 骨显像结合血清ALP 和骨ALP 有助于恶性肿瘤伴骨转移的早期诊断。ALP 属于磷酸单酯水解酶,是一种特异性磷酸酶,主要存在于身体组织和体液中;骨ALP 是由ALP 不同修饰和加工形成的,主要由成骨细胞释放。Vaz 等[20]提示骨靶向示踪剂包括99mTc-MDP 和18F-NaF 对检测成骨细胞活性非常敏感,但同时需要考虑以下几个方面以提高结果的特异性,如示踪剂的特征和作用机制、患者的临床病史、常见的转移模式、治疗后的变化、技术的局限性等。
综上所述,99mTc-MDP SPECT/CT 骨显像能够提供单发骨质病变的结构变化和功能代谢特征,有较好的灵敏度,但特异度和准确率有限,联合血清ALP和Ca2+能够进一步提高诊断性能。

