CUL4B、TRPM2在胰腺癌组织中的表达和临床意义
马竹芳,庞林元,陈保银,徐菁
胰腺癌是极具侵袭性的恶性肿瘤,全球每年新发44.1万例[1]。胰腺癌早期阶段临床表现不典型,诊断和治疗往往延误,预后较差[2]。E3泛素连接酶Cullin 4B (CUL4B)作为支架蛋白构成Cullin-Ring复合物,参与细胞周期、信号传导及DNA损伤修复等过程[3]。研究表明,膀胱癌、乳腺癌中CUL4B表达上调,能激活磷脂酰肌醇3激酶,促进肿瘤增殖、侵袭和干细胞特性形成[4-5]。人瞬时受体电位M2(transient receptor potential cation channel subfamily M member 2,TRPM2)是一种瞬时受体电位通道,参与调控钙离子的跨膜转运、多聚ADP核糖的降解过程,与炎性反应、自身免疫疾病、动脉粥样硬化等疾病关系密切[6]。研究表明,TRPM2在乳腺癌、前列腺癌中表达上调,磷酸化富脯氨酸蛋白酪氨酸激酶,促进癌细胞的增殖[7]。目前胰腺癌中CUL4B、TRPM2表达及临床意义尚不清楚。本研究通过检测胰腺癌中CUL4B、TRPM2的表达,分析两者与临床病理特征及预后的关系,报道如下。
1 资料与方法
1.1 临床资料 收集2019年3月—2020年3月西安交通大学医学院附属3201医院接受手术治疗胰腺癌患者86例的癌组织和癌旁组织。其中男46例,女40例;年龄37~68(55.29±6.26)岁;肿瘤最大径:<4 cm 52例,≥4 cm 34例;肿瘤TNM分期:Ⅰ~ⅡA 期45例,ⅡB~Ⅲ 期41例;肿瘤分化程度:高中分化50例,低分化36例;肿瘤位置:胰头部56例,胰体尾部30例;有淋巴结转移53例。本研究已经获得医院伦理委员会批准(伦审〔2019〕022号),患者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①经组织病理检查明确为胰腺导管腺癌,符合《胰腺癌综合诊治指南(2018版)》胰腺癌诊断标准[8];②入院前无放化疗治疗;③临床资料齐全。(2)排除标准:①合并严重心肺功能障碍;②合并胰腺外原发恶性肿瘤或术后证实肿瘤非胰腺来源,如十二指肠、胆管下段及壶腹下段;③围手术期死亡或术后30 d内死亡;④不能配合随访者。
1.3 观测指标与方法
1.3.1 组织CUL4B、TRPM2蛋白检测:将术中获取的胰腺癌组织和癌旁组织浸泡于10%组织固定液中12 h,石蜡包埋切片。免疫组化染色的具体实验步骤按照免疫组化试剂盒(购自北京中杉金桥生物科技公司,货号PV6000)说明进行操作。简要步骤:烘箱中60℃ 1 h,二甲苯脱蜡后一次放入100%至75%的梯度乙醇中水化,3%过氧化氢浸泡10 min,枸橼酸盐抗原修复液中煮沸,冷却后10%羊血清37℃封闭30 min,滴加一抗4℃ 16 h,兔抗人CUL4B、TRPM2单克隆抗体购自英国abcam公司,货号ab247477,ab11168。二抗37℃ 30 min,DAB显色5 min,苏木素染色2 min,分化液分化后清水清洗,返蓝液中静置5 min,依次脱水、透明和封片。利用日本Olympus公司的DX31显微镜观察染色情况,染色深度评分(无染色0分,浅黄色1分,棕黄色2分,棕褐色3分)与面积评分(<25% 1分,25%~<50% 2分,50%~<75% 3分,≥75% 4分)的乘积≥2分为阳性,<2分为阴性。
1.3.2 组织CUL4B、TRPM2 mRNA基因表达检测:取胰腺癌和癌旁组织约50 mg,剪碎后加入Trizol后研磨,离心留取上清采用RNA提取试剂盒(RNA提取试剂盒购自北京索莱宝公司,货号R1200)提取组织总RNA,将RNA反转录为cDNA,进行荧光定量PCR反应(SYBR Green试剂盒购自北京索莱宝公司,货号SY1020)。引物由上海生工公司设计合成。CUL4B上游:5’-TTCGTGGATTCCTGAAAACATCA-3’,下游:5’-CCAGCATCAGACAGTTTGGAAC-3’;TRPM2上游:5’-GAGATGCCAACCGATGCCTTT-3’,下游:5’-GGAGACTCGGACGTACTTTTTCA-3’;内参GAPDH上游:5’-TCCCCGCCGAGTACATACTG-3’,下游:5’-GTCTGCTCCGATATGAACTTCTC-3’。反应条件:94℃ 5 min、94℃ 30 s、60℃ 30 s、72℃ 40 s,共35个循环。体系:SYBR Green 5 μl,正反向引物各0.5 μl,cDNA 1 μl和双蒸水3 μl。结果采用2-△△Ct法表示CUL4B、TRPM2 mRNA基因的相对表达量。
1.3.3 随访及预后:胰腺癌患者自出院后开始随访,随访间隔为3~6个月1次,随访时限为3年,随访以门诊方式进行;随访内容为常规体格检查、腹盆腔CT或MR等,了解随访中肿瘤复发进展及患者生存情况。随访终止时间为2023年4月。随访终点为患者发生肿瘤相关死亡或到达随访终止时间。

2 结 果
2.1 组织中CUL4B、TRPM2蛋白表达比较 癌组织中CUL4B、TRPM2蛋白阳性染色均位于细胞膜和细胞浆,其阳性率分别为72.09%(62/86)、69.77%(60/86),高于癌旁组织的9.30%(8/86)、11.63%(10/86),差异均有统计学意义(χ2=70.245、60.224,P均<0.001),见图1。
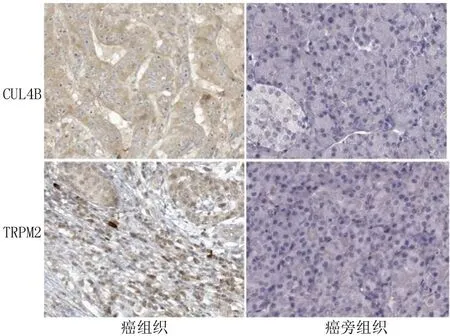
图1 胰腺癌及癌旁组织中CUL4B、TRPM2蛋白表达比较(免疫组化染色,×200)Fig.1 Comparison of CUL4B and TRPM2 protein expression in pancreatic cancer and paracancer tissues (immunohistochemical staining, ×200)
2.2 胰腺癌组织CUL4B与TRPM2蛋白表达的相关性 Spearman秩相关分析结果显示,胰腺癌组织中CUL4B与TRPM2蛋白表达呈显著正相关(r=0.720,P<0.001)。
2.3 组织CUL4B、TRPM2 mRNA基因表达比较 癌组织CUL4B、TRPM2 mRNA基因表达为(4.82±0.66)、(3.65±0.69),高于癌旁组织(3.51±0.40)、(2.56±0.61),差异均有统计学意义(t=15.741、10.976,P均<0.001)。
2.4 不同临床病理特征胰腺癌组织CUL4B、TRPM2蛋白表达比较 TNM分期ⅡB~Ⅲ期、伴有淋巴结转移胰腺癌中CUL4B、TRPM2蛋白阳性率高于Ⅰ~ⅡA期、无淋巴结转移癌组织,差异具有统计学意义(P均<0.01),见表1。
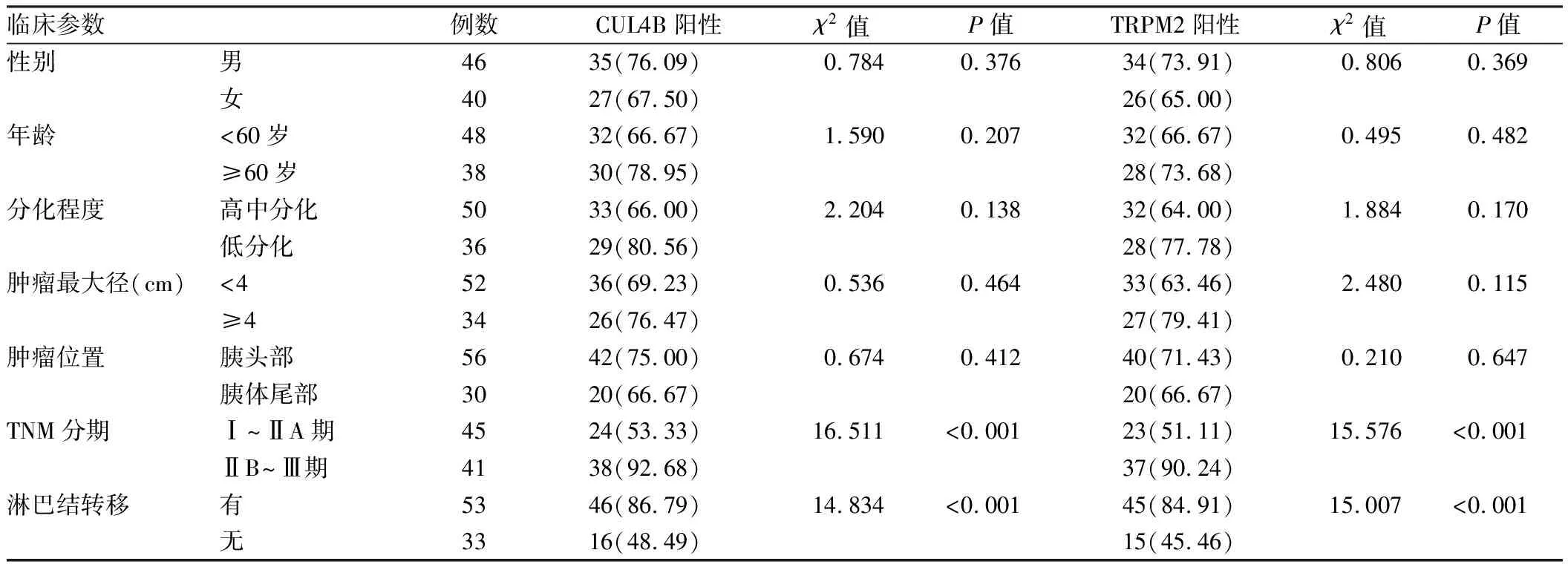
表1 不同临床病理特征胰腺癌组织中CUL4B、TRPM2蛋白表达比较 [例(%)]
2.5 CUL4B、TRPM2表达与胰腺癌患者生存预后的关系 胰腺癌患者随访结束时,共死亡70例(81.40%),无失访病例;3年总生存率18.60%(16/86)。CUL4B阳性组和阴性组3年总生存率分别为9.68%(6/62)、41.67%(10/24),TRPM2阳性组和阴性组3年总生存率分别为8.33%(5/60)、42.31%(11/26)。
CUL4B阳性组、TRPM2阳性组患者3年累积生存率低于CUL4B阴性组、TRPM2阴性组患者,差异均有统计学意义(Log-Rankχ2/P=9.933/0.002、11.102/0.001),见图2。
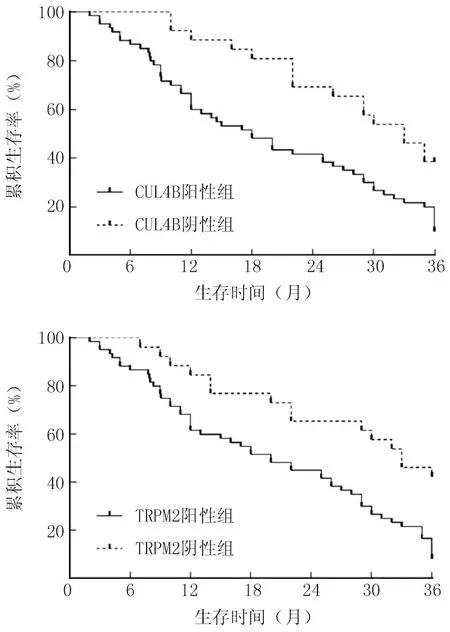
图2 CUL4B、TRPM2表达对胰腺癌患者生存预后的影响
2.6 影响胰腺癌患者预后的多因素Cox回归分析 以胰腺癌患者生存预后为因变量(1=死亡,0=存活),以上述结果中P<0.05项目为自变量进行多因素Cox回归分析,结果显示:TNM分期ⅡB~Ⅲ期、淋巴结转移、CUL4B阳性、TRPM2阳性是影响胰腺癌不良预后的独立危险因素(P均<0.01),见表2。
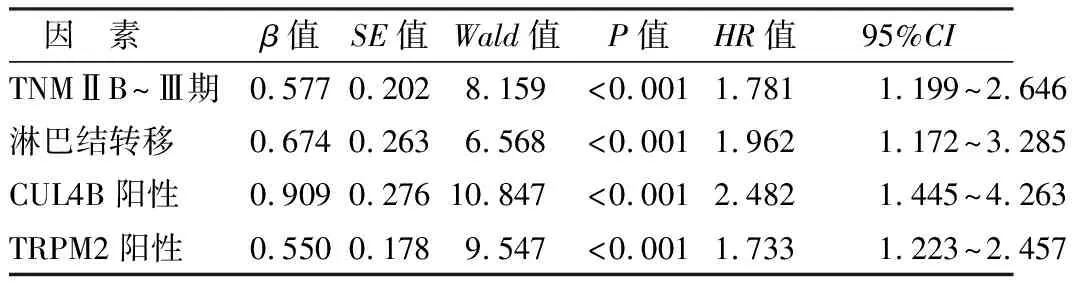
表2 影响胰腺癌患者预后的多因素Cox回归分析
3 讨 论
胰腺癌是严重的消化道恶性肿瘤,起病隐匿,预后极差。我国居民胰腺癌标化发病率为5.78/10万,病死率为5.99/10万[9]。虽然手术、化疗等综合治疗是胰腺癌的主要临床治疗方案,但胰腺癌预后整体较差,5年总体生存率仅9%[9]。目前主要根据肿瘤TNM分期、病理分级等临床病理特征评估胰腺癌患者的预后,但不同患者存在较大的肿瘤异质性,相同分期及相同治疗方案的胰腺癌患者疾病复发转移的风险存在较大差异。因此,有必要对影响胰腺癌预后的因素进行深入研究,并寻找有效评估患者临床预后的标志物。
CUL4B是Cullin 4B-Ring E3泛素连接酶复合物的支架蛋白,通过多泛素化或单泛素化作用催化底物蛋白,参与肥胖、胰岛素抵抗及病毒感染等病理生理学过程[10]。研究发现,CUL4B在肺癌、胶质瘤等多种类型癌症中过表达,其通过表观遗传学修饰在转录水平调控靶基因表达,促进肿瘤细胞的增殖及侵袭行为[11-12]。本研究中,胰腺癌组织中CUL4B mRNA和蛋白表达明显升高,这与既往在胰腺癌细胞及组织中研究结果一致[13],但该研究仅对人类癌症基因组数据库中CUL4B在mRNA基因表达的水平进行验证,而不同mRNA的转录本的基因表达存在一定差异,本研究在蛋白水平对CUL4B进行验证,结果更为准确。胰腺癌中CUL4B表达受微小RNA-300表达的调节。研究表明,胰腺癌中微小RNA-300表达下调,导致CUL4B mRNA稳定性增加,CUL4B激活Wnt/β-连环蛋白通路,β-连环蛋白入核后上调波形蛋白及N钙黏素的表达,肿瘤细胞的侵袭能力增强[14]。本研究中,CUL4B表达与患者不良临床病理特征有关,提示CUL4B促进胰腺癌的恶性进展。研究表明,CUL4B与组蛋白去乙酰化酶1结合形成CRL4B复合物,该复合物促进组蛋白H2AK119位点的单泛素化,上调果蝇头状因子3和叉头转录因子O亚型3的表达,促进肿瘤细胞的增殖、自噬、侵袭及干细胞样特性形成[13]。另外,CUL4B能够与DNA损伤结合蛋白1及组成型光形态发生蛋白1结合形成复合物,介导H3K27me2/3组蛋白去甲基化酶UTX的泛素化降解,促进了结直肠癌的恶性进展[15]。本研究中,CUL4B阳性胰腺癌患者预后较差,表明CUL4B有助于评估胰腺癌患者预后。研究发现,胰腺内分泌瘤中CUL4B与CUL4相关因子7结合,催化肿瘤抑制基因MEN1的泛素化降解,促进肿瘤细胞恶性增殖及对依维莫司治疗耐药性的形成,导致患者不良预后[16]。
TRPM2属于瞬时受体电位超家族成员,是可通过钙离子的非选择性阳离子通道,能够感受活性氧簇,参与机体氧化应激、炎性反应及细胞死亡等多种病理生理过程[17]。研究表明,TRPM2可通过促进内质网应激,促进肿瘤微环境中免疫抑制细胞浸润,并通过促进肿瘤上皮间质转化,促进肾透明细胞癌的肿瘤进展,是潜在的肿瘤治疗靶点[18]。本研究中,胰腺癌组织中TRPM2 mRNA和蛋白表达升高,提示TRPM2参与促进胰腺癌的发生。这与既往Lin等[19]学者研究结果相似,但该研究仅纳入64例胰腺癌患者,以中晚期患者为主(Ⅰ期患者仅6例),在反映不同分期胰腺癌患者TRPM2表达中代表性较差。胰腺癌中TRPM2表达升高的机制与缺氧微环境调控有关。研究表明,胰腺癌肿瘤微环境处于缺氧状态,缺氧通过促进钙离子内流诱导肿瘤细胞中线粒体游离活性氧的产生,上调并激活TRPM2的表达,促进胰腺癌细胞系PANC-1细胞的增殖、侵袭和转移能力[20-21]。本研究中,TRPM2与胰腺癌不良临床病理特征有关,提示TRPM2促进胰腺癌的肿瘤进展。有学者发现,胰腺癌患者中TRPM2的过表达可增加肿瘤细胞内钙离子浓度,直接激活蛋白激酶Cα,活化下游丝裂原活化蛋白激酶/丝裂原细胞外激酶通路,促进肿瘤细胞的增殖、迁移和侵袭能力,导致肿瘤分期升高[21]。本研究中,TRPM2阳性胰腺癌患者预后较差,表明TRPM2可能是新的评估胰腺癌预后的肿瘤标志物。分析其原因,TRPM2的表达通过增加缺氧诱导因子1A和核因子E2相关因子2蛋白的稳定性,上调多药耐药基因等的表达,导致肿瘤对化疗药的敏感性降低及患者不良生存预后[22]。另有研究发现,应用TRPM2的特异性抑制剂如邻氨基苯甲酸等能够抑制肿瘤内钙离子依赖的线粒体来源的活性氧产生,增强肿瘤细胞对化疗药治疗的敏感性,是潜在的肿瘤治疗靶点[23]。
本研究中,胰腺癌组织中CUL4B与TRPM2表达呈正相关,提示两者在胰腺癌中可能存在相互作用关系。笔者分析,可能与两者受缺氧调控有关。研究表明,缺氧条件下肿瘤细胞中TRPM2表达上调能够增加缺氧诱导因子1A蛋白稳定性,而缺氧诱导因子1A能够在转录水平直接激活CUL4B的转录,促进肿瘤上皮间质转化,导致迁移、侵袭等恶性生物学行为的发生[24]。但胰腺癌中两者具体作用仍有待进一步研究。
综上所述, 胰腺癌组织中CUL4B、TRPM2在转录水平及蛋白水平均显著升高,与患者不良临床病理特征有关,均参与促进胰腺癌的肿瘤进展。CUL4B、TRPM2是影响胰腺癌不良生存预后的独立因素,可能协助临床医生评估胰腺癌患者的临床预后,进而指导临床治疗。但本研究在数据收集和样本量等方面尚存在局限,即随访时间相对较短、样本量较小,有待今后扩大样本量,延长随访时间,进一步研究CUL4B、TRPM2的临床应用价值。
利益冲突:所有作者声明无利益冲突
作者贡献声明
马竹芳:设计研究方案,实施研究过程,论文撰写;庞林元:提出研究方向,分析试验数据,论文审核;陈保银:实施研究过程,数据收集,分析整理,论文修改;徐菁:进行统计学分析

