高温胁迫下硅添加对紫花苜蓿抗氧化系统和超微结构的影响
赵 欣,钱 程,胡雅飞,李俊霖,蔡思琪,普安德,刘大林,王 琳,李新娥
(1.扬州大学动物科学与技术学院, 江苏 扬州 225009;2.扬州大学农业科技发展研究院(国际联合实验室), 江苏 扬州 225009)
紫花苜蓿(Medicago sativa)是一种被广泛种植的豆科饲料作物,享有“牧草之王”的美誉,具有产量高、营养品质优等特点[1-2],具有较高的饲用价值和经济价值[3-4]。紫花苜蓿的主要种植区在我国北方,近年来畜牧业开始转型发展,市场对高产优质牧草的需求逐年增加,因此紫花苜蓿的种植需要进一步扩大。但是逐年的高温气候不但影响了紫花苜蓿的正常生长,更严重限制了紫花苜蓿的推广和生产利用[5-6]。因此,开发实用有效的方法来提高紫花苜蓿对高温胁迫的抗性,从而提高苜蓿生产力具有重要现实意义。近年来的研究表明硅对于缓解植物的高温胁迫具有重要作用,但相关机制的研究仍值得进一步探讨。
硅添加对于缓解植物高温胁迫下的氧化损伤以及提高光合作用效率方面具有非常积极的作用。高温会使植物细胞产生大量的活性氧(reactive oxygen species,ROS),引起细胞膜脂质氧化损伤,导致植物体细胞膜的组成成分发生改变、蛋白质变性、膜上离子种类与作用发生改变,最终会造成细胞膜选择性吸收功能损坏,出现电解质渗漏、电导率增大等现象[7-10]。这些现象降低了植物的品质,并导致植物的生物量和存活率下降。然而,植物受到高温胁迫后会因为硅的介导而放大发挥自身的适应性反应,因此硅在增强植物对高温胁迫的适应性方面起着积极的调节作用。硅添加处理后的植物在其体内如细胞壁中表现出高硅沉积,为植物的抗逆性提供了机械支撑[11-14],增加表皮蜡的形成,增加细胞的热稳定性,减少电解质泄露;还可以通过增强抗氧化酶的活性和水平来清除ROS,缓解细胞的氧化损伤,从而增强植物的耐热性[15-17];硅还可以作为信号分子上调部分基因的表达,使植物合成叶绿素的速度和能力不受胁迫影响,并提高光合性能指数,例如光下叶片的实际光能转化效率[Y (Ⅱ)]和光系统Ⅱ的最大光化学量子产量 (Fv/Fm)等,从而保证光合作用的正常运行使生物量不受高温胁迫影响[1,14-15]。而且,由于叶片抗氧化系统的酶活力在硅添加后得到提升,可能从一定程度上保护叶绿体等器官的形态和功能的稳定性。叶绿体是由外膜(chloroplast envelope)、类囊体(thylakoid)和基质(stroma) 3 部分组成,光合作用在此进行,因此它的形态结构在一定程度上可以作为表征植物高温耐受性的依据[18-19]。类囊体膜主要是由脂肪酸和不饱和脂肪酸组成,高温胁迫产生的活性氧会造成这些膜结构损害[20-21],而硅添加可以改变膜结构的不饱和脂肪酸和饱和脂肪酸的比例,维持膜的完整性和稳定性[22-23],缓解叶绿体等细胞器的超微结构畸形等[15,24]。叶绿素合成以及叶绿素a 氧化生成叶绿素b 都在叶绿体膜上进行,并且类囊体膜上含有电子传递链组分[19]。由此可见,硅添加通过对类囊体膜完整性的影响与叶绿素含量及光合电子传递存在紧密的联系。
然而,就目前硅添加对缓解植物高温胁迫的研究来看,大多独立讨论硅对抗氧化系统、光合作用效率、细胞超微结构的影响,对细胞超微结构和抗氧化系统综合探讨的研究很少,不能够反映硅添加对活性氧清理后对细胞超微结构的保护效果。高温胁迫使细胞内部产生大量的活性氧对细胞结构造成严重的损害,超微结构直接反映了细胞膜和细胞器膜的完整性,在一定程度反映抗氧化酶对活性氧的清理效果。研究叶绿体和类囊体等超微结构可以进一步印证高温造成的活性氧积累是否对细胞膜以及叶绿体结构造成损伤,以及硅添加是否能够保护其完整性。因此,以紫花苜蓿为研究对象,比较高温胁迫下添加硅和不添加硅条件下的叶片抗氧化酶活性、叶绿素特征、叶绿体超微结构等的差异,旨在进一步揭示硅添加对紫花苜蓿耐热性的影响,为开发提高苜蓿耐热性的实用有效方法提供理论依据。
1 材料与方法
1.1 试验设计
采用盆栽试验,供试紫花苜蓿品种为‘WL363’(正道种业,北京)。试验于2022 年5 月开始,首先在扬州大学草学智能温室育苗盘中播种充足数量的紫花苜蓿种子,待其发芽后约一周后移栽到花盆中。花盆选用高23 cm、直径15 cm 的塑料花盆,每盆装土2 kg,土壤为扬州大学试验田表层土与营养土混合,两种土重量比1 ∶ 1,共2 kg。移栽时选取大小相近的、2~3 cm 高的幼苗,每个花盆移栽5 株。幼苗移栽后在温室环境中生长两周之后转移到人工气候箱中(RTOP-400Y,拓普云农,浙江)开始高温胁迫和添加硅处理。试验设置两个温度和两个硅浓度水平,即常温(20 ℃/25 ℃, OT)和高温(35 ℃/40℃, HT),0 和2 mmol·L-1硅浓度(分别标记为Si0和Si2)。其中硅源为K2SiO3,为平衡K 离子浓度,0 mmol·L-1Si 的处理中加入两倍浓度的KCl 溶液。因此,共有两个温度水平和两个硅浓度水平,共4 个处理,每个处理4 个重复,共16 盆。自处理开始,每盆每天浇等量的处理溶液,浇水量视水分蒸发情况而定,每次浇100 或50 mL;此外,随机改变花盆在培养箱中的位置,以消除气候箱中微环境的影响。于2022 年8 月初进行取样,随后即进行测定试验。
1.2 取样及指标测定
1.2.1 株高、根长和生物量
在胁迫处理结束时,用直尺测量每盆植株的株高取平均值,将植株取出花盆,用自来水冲洗植株,使植株保持完整干净,然后用吸水纸吸干水分。于扫描仪(HP Desk Jet 2 132,惠普,重庆)中扫描根系图片,用Image J 软件(NIH, Bethesda, MD, 美国)测量根系长度。取一整株,将根、茎、叶用剪刀剪下,待各部分鲜重测定完成后置于105 ℃烘箱中杀青15 min,烘箱温度调至75 ℃烘干至恒重,用分析天平(CL-J120,上海亚津;精确到0.000 1 g)测定其干重。其余样品将根、茎、叶分别存放在自封袋中,放-80 ℃冰箱保存,以备后续试验采用。共取得并存放根、茎、叶样品各16 个。
1.2.2 相对电导率和抗氧化酶活性的测定
从各叶片样品中随机称取约0.1 g 新鲜叶片(5~10 片)用去离子水清洗3 次后放入去离子水清洗过的50 mL 离心管内,加入15 mL 去离子水后将离心管放在25 ℃的恒温摇床上振荡24 h。取出后用电导率仪(DDS-11A ,上海仪电,上海)测定初始电导率记为EL1,然后用100 ℃的水浴锅中煮1 h 后取出,冷却至常温后测定第二电导率,记为EL2,相对电导率EL 的值为EL = (EL1/EL2) × 100%。
同上,从各样品中随机称取6 g 新鲜叶片,液氮速冻,添加10 mL pH 为6.0 的磷酸缓冲溶液研磨成液体,4 ℃条件下4 000 离心取上清液。取0.2 mL上清液采用氮蓝四唑显色法测定超氧化物歧化酶(superoxide dismutase,SOD)活 性。取0.05 mL 上 清液用过氧化氢酶(catalase,CAT)试剂盒(索莱宝,北京)测定CAT 活性,取0.1 mL 上清液用过氧化物酶(peroxidase,POD)试剂盒(索莱宝,北京)测定POD活性。
1.2.3 叶片超微结构
叶片超微结构的样品为活体取样,从每个处理花盆中取3~5 片健康的相同叶位的叶片固定于2.5%戊二醛固定液中,送样至青岛科创质量检测有限公司,取其中一片使用超薄切片机(EM KMR3,Leica,德国)进行超薄切片,透射电子显微镜拍照观察(Tecnai 12,Philips,荷兰)其超微结构。
1.2.4 叶绿素含量与叶绿素荧光特征
叶绿素测定方法为从各样品种称取0.1 g 紫花苜蓿新鲜叶片,放入10 mL 的离心管中,并且加入5 mL浓度为95%的酒精,避光浸提48 h,用分光光度计测波长665 和649 nm 下的吸光度,同时以95%的酒精作为空白对照组。然后根据以下公式计算叶绿素a(mg·g-1)、叶绿素b (mg·g-1)和叶绿素总含量(mg·g-1)[3]。
式中:m表示称取的样品质量,Chla 代表样品中叶绿素a 的含量,Chlb 代表样品中叶绿素b 的含量,Chl 代表样品中叶绿素的总含量,D649为样品提取液在649 nm 下的吸光度,D665为样品提取液在665 nm 下的吸光度。
将紫花苜蓿盆栽在黑暗处暗处理30 min 后,使用便携式调制叶绿素荧光仪(PAM2500,Heinz Walz GmbH,德国)对紫花苜蓿叶片的叶绿素荧光参数进行检测,每盆重复测量9 次。
1.3 数据分析
利用 Excel 2019 进行数据整理采用,使用R 软件(R version 4.0.2)进行双因素方差分析和多重比较分析,用平均值±标准误表示测定结果,并采用R 软件中ggplot2 制图。
2 结果与分析
2.1 高温胁迫下添加硅对紫花苜蓿植株生长特征的影响
为了确定高温胁迫对紫花苜蓿表型的影响以及硅添加的缓解效果,分别测量紫花苜蓿的株高、根长以及单株生物量。紫花苜蓿的植株形态受到高温胁迫的影响(图1),在正常温度下生长的紫花苜蓿株高均值为19.08 (Si0)和20.03 cm (Si2),而在高温下平均株高仅为8.63 cm (Si0),硅添加处理后的平均株高为17.55 cm (Si2)。在正常温度下,硅添加将根长提高了20%,高温胁迫时有所降低,硅添加没有对高温胁迫下的根长带来正面的影响(图2);单株生物量变化与株高的基本一致,正常温度下的单株生物量分别为0.77 (Si0)和1.21 g (Si2),添加硅将单株生物量显著提高了36.5% (P< 0.05),高温下硅添加使单株生物量提高了47.0% (图2)。

图1 高温胁迫下硅添加对紫花苜蓿生长情况的影响Figure 1 Effect of silicon addition on alfalfa growth under high-temperature stress
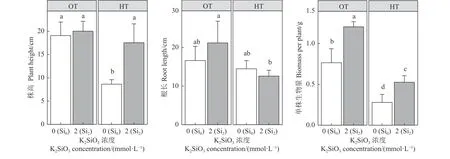
图2 高温胁迫下硅添加对紫花苜蓿株高、根长和单株生物量的影响Figure 2 Effect of silicon addition on plant height, root length, and biomass per plant under high-temperature stress
2.2 高温胁迫下硅添加对紫花苜蓿氧化防御系统的影响
在正常温度下,硅添加处理对SOD 活性没有显著影响(P> 0.05);在高温条件下,SOD 活性均相对提高,硅添加处理的SOD 活性高于Si0HT,高了约16%,但不显著。与Si0OT 比较,Si2OT 的POD 活性显著降低了17% (P< 0.05),Si0HT 和Si2HT 无显著差异。相较于Si0OT,CAT 活性在Si0HT 时显著提高了57% (P< 0.05),且Si2HT 较Si0HT 显著提高了38% (P< 0.05) (图3)。
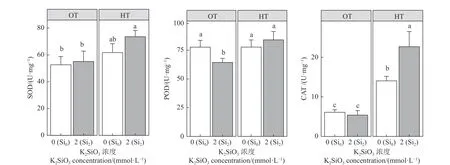
图3 高温胁迫下硅添加对紫花苜蓿超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性的影响Figure 3 Effect of silicon addition on superoxide dismutase (SOD), peroxidase (POD), and catalase (CAT)activities of alfalfa under high-temperature stress
2.3 高温胁迫下硅添加对紫花苜蓿叶片超微结构和相对电导率的影响
通常高温胁迫会使植物的叶片微观形态产生改变。Si0OT 的叶肉细胞形态完好,结构完整,Si2OT的叶肉细胞也是完整且坚固(图4A),Si2OT 的处理使细胞稳定性更强,叶绿体数量增多(图4B)。Si0HT的叶肉细胞膜损坏严重,细胞质外渗,叶绿体结构损坏(图4C),而Si2HT 的叶肉细胞膜没有过度损坏,细胞形态比Si0HT 的细胞完整,但相较于Si0OT 和Si2OT 的叶片细胞形态还是有所变形,叶绿体含量减少(图4D)。正常条件下叶绿体呈规则椭圆形,其中有组织良好的叶绿体类囊体和平行的薄片(图5A),Si2OT 的处理使细胞稳定性强(图5B),然而Si0HT 的叶绿体则变得肿胀或损坏,Si0HT 的叶绿体中类囊体薄膜破裂,并出现了大量密集的质体球(图5C),质体球在类囊体分解过程中会增加,其数量的增加可能与叶绿体的衰老有关。Si2HT 的叶绿体形态比Si0HT 的叶绿体形态完整,质体球含量减少(图5D)。除了在高温不添加硅的条件下,紫花苜蓿的叶片相对电导率的值都维持在正常的范围,高温条件下Si0处理的叶片相对电导率显著升高(P< 0.05),而Si2处理使同样在高温胁迫下的叶片相对电导率降低了41% (图6)。
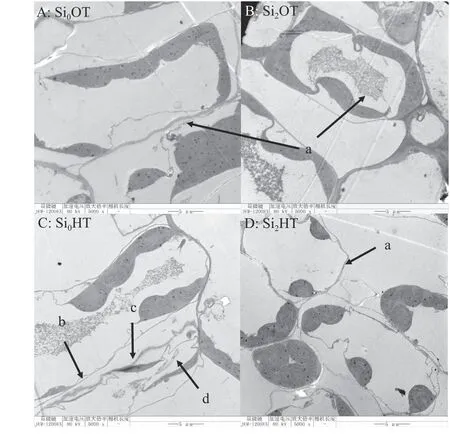
图4 高温胁迫下硅添加对紫花苜蓿细胞膜的影响Figure 4 Effect of silicon addition on alfalfa cell membrane under high-temperature stress
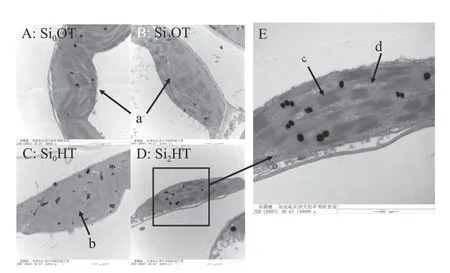
图5 高温胁迫下硅添加对紫花苜蓿叶绿体的影响Figure 5 Effect of silicon addition on alfalfa ultrastructured chloroplasts under high-temperature stress
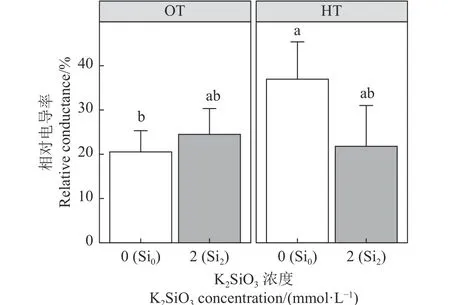
图6 硅添加对高温胁迫下紫花苜蓿相对电导率的影响Figure 6 Effect of silicon addition on the relative conductivity of alfalfa under high-temperature stress
2.4 高温胁迫下硅添加对紫花苜蓿叶绿素含量和叶绿素荧光特性的影响
叶绿素起到了吸收和传递光量子的作用,其含量高低直接影响植物光合作用的强弱。与Si0OT 相比,Si2OT 的叶绿素a 和叶绿素b 以及叶绿素总含量分别升高了12%、11%和12% (图7),与Si0HT 条件相比,Si2HT 的叶绿素a 和叶绿素总含量分别显著升高了27%和23%。Fv/Fm值反映了潜在的最大光合作用的能力,硅添加显著影响了紫花苜蓿Fv/Fm的值,在不同温度条件下,Si0HT 的Fv/Fm值显著低于Si0OT (图8),低了15%,而在高温添加硅后,Si2HT 相较于Si0HT 显著升高了19%。与Si0OT 相比,Si0HT 紫花苜蓿的Y(Ⅱ)显著降低了23%,但与Si0HT 相比,Si2HT 处理显著提高了紫花苜蓿的Y(Ⅱ) (P< 0.05) (图8)。
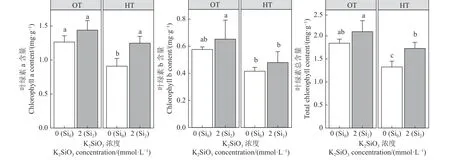
图7 高温胁迫下硅添加对紫花苜蓿叶绿素a、叶绿素b 以及叶绿素总含量的影响Figure 7 Effect of silicon addition on the activities of alfalfa chlorophyll a, chlorophyll b,and total chlorophyll content under high-temperature stress
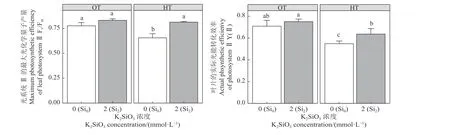
图8 高温胁迫下硅添加对紫花苜蓿Fv/Fm 和Y (Ⅱ)的影响Figure 8 Effect of silicon addition on alfalfa Fv/Fm and Y (Ⅱ) under high-temperature stress
3 讨论
硅作为外源调节剂已被广泛利用,在植物抵御环境损害方面发挥着重要作用。研究显示,硅添加在高温胁迫下显著提高番茄(Solanum lycopersicum)的枝条重量,增加大麦(Hordeum vulgare)的根长和根重,对植株的生长参数都有积极的影响[12,25-26]。本研究的生长参数结果也显示,高温胁迫明显抑制了紫花苜蓿幼苗的生长、养分的吸收和生物量的合成,而在高温下添加硅,有效缓解了紫花苜蓿在高温下的生长限制,提高了生物量。
高温胁迫下植物细胞内大量积累的活性氧对细胞的膜脂化系统造成严重的伤害,而耐热性较高的植物在受到胁迫时会提高清除活性氧和氧自由基的抗氧化系统酶的活性。SOD、POD、和CAT 等是植物体内的主要抗氧化酶,当植物遭受胁迫时,能协同清除 ROS 的过多积累对细胞膜系统造成的损伤,降低细胞膜脂过氧化程度,提高植物的抗逆性[27]。本研究结果显示,硅添加使高温胁迫下紫花苜蓿叶片的过氧化氢酶活性显著提高(图3),这有助于快速清除植物体内代谢过程中产生的对细胞膜结构造成损害的H2O2,与硅添加在高温胁迫下白菜(Brassica pekinensis)、枣椰树(Phoenix dactylifera)和草莓(Fragaria ananassa)等植物中的过氧化氢含量显著降低相一致[14,28-29]。
大量积累的ROS 对细胞器结构的完整性带来负面影响,硅激发酶的清除作用以及硅沉积则对超微结构产生保护效果。根据对紫花苜蓿叶片透射电镜影像的观察,在高温胁迫下紫花苜蓿叶片细胞膜和细胞壁都出现了破损和变形(图4C),相对电导率的显著提高也证明了其细胞膜在高温条件下受到损伤,细胞质渗漏;这种变化可能归因于高温胁迫引起的水分亏缺[30],以及高温诱导的膜蛋白和脂质改变[31]。硅添加后细胞壁和细胞膜保持了相对完整性(图4D),叶片的相对电导率有所下降(图6)。这种对细胞壁和细胞膜的保护除了是抗氧化酶对ROS 的清除以外,还有可能是硅在质膜与细胞壁的界面或在细胞间隙的沉积,这种现象在禾本植物水稻(Oryza sativa)、小麦(Triticum aestivum)中尤为突出[32-34],也有可能是因为硅通过改变不饱和脂肪酸和饱和脂肪酸的比例,来维持质膜的完整性和细胞膜的稳定性[35]。
叶绿素合成从起始到中间步骤都在叶绿体膜上进行,后期所有步骤以及叶绿素a 氧化生成叶绿素b 都发生在类囊体膜上,并且类囊体膜上含有电子传递链组分[18-19,36],因此硅添加对类囊体膜完整性的保护也会影响叶绿素合成和光合电子传递。在本研究中,高温胁迫引起了叶绿体基质中质体球增多(图5C),这是由于类囊体膜分解使光合作用的反应场所受到损伤所导致[37-40],继而造成了叶绿素a、叶绿素b 和叶绿素总量的显著下降(图7),这些与小麦、豌豆(Pisum sativum)以及葡萄(Vitis vinifera)的研究结果一致[41-43]。而高温下硅添加处理的紫花苜蓿具有完整的叶绿体和少量的质体球、叶绿素a、叶绿素b 和叶绿素总量的值以及荧光参数Fv/ Fm值和Y(Ⅱ)的值显著高于高温胁迫不添加硅的紫花苜蓿(图8),这与其他研究中烟草(Nicotiana tabacum)[44]和紫花苜蓿[45]相关指标的反应一致。这说明硅添加通过修复类囊体膜维持叶绿体形态和功能的途径有效缓解了高温胁迫对光系统的伤害[46]。
4 结论
综上,高温胁迫对紫花苜蓿的产量等各方面造成了严重的负面影响,而添加硅提高了紫花苜蓿的生物量,相关机制可能为通过提高紫花苜蓿幼苗抗氧化酶的活性,减轻了氧化损伤,增强细胞壁和细胞膜以及叶绿体类囊体膜的稳定性,提高叶绿素含量,保护紫花苜蓿叶片的光系统反应,提高光能利用效率,从而最终提高紫花苜蓿的耐热性。

