SMARCA4缺失型非小细胞肺癌患者的临床病理特征及预后影响因素分析
汤 誉, 张 萍, 王敏捷, 蓝佳琦, 林炳棋
交配型转换/蔗糖不发酵(switch/sucrose non-fermentable,SWI/SNF)复合体是一种酵母交配型转换/蔗糖不发酵复合物,在基因转录、细胞分化、DNA损伤修复等方面发挥重要作用[1]。抑癌基因SMARCA4通过编码BRG1蛋白构成SWI/SNF复合体的催化亚基[2]。研究发现,约10%的非小细胞肺癌(non-small-cell lung cancer,NSCLC)存在SMARCA4缺失[3]。SMARCA4缺失与未分化肿瘤发生、肿瘤转移能力增加密切相关[3]。据报道,约83%的SMARCA4缺失型NSCLC患者诊断时已处TNM分期Ⅳ期,中位无进展生存时间仅为30 d[4]。尽管含铂类化疗方案联合免疫检查点抑制剂是治疗SMARCA4缺失型NSCLC的常用方法,部分患者可以从中获益,但其长期治疗效果仍不确切。因此,通过分子检测进一步分析SMARCA4缺失型NSCLC患者的临床病理特征及预后影响因素,有利于今后对此类患者的疗效进行预判[5]。本研究回顾性分析SMARCA4缺失型与非SMARCA4缺失型NSCLC患者的临床资料,以期为临床工作提供参考。
1 资料与方法
1.1临床资料 回顾性分析2016年1月至2021年6月厦门大学附属东南医院和漳州市医院收治的106例SMARCA4缺失型NSCLC患者(SMARCA4缺失组)和212例非SMARCA4缺失型NSCLC患者(非SMARCA4缺失组)的临床资料。纳入标准:(1)NSCLC经组织病理学确诊。(2)首次确诊,未进行抗肿瘤治疗。(3)接受免疫组化染色,以鉴别SMARCA4缺失型和非SMARCA4缺失型NSCLC患者。排除标准:(1)合并其他恶性肿瘤患者。(2)临床资料缺失者。本研究获联勤保障部队第九〇九医院医学伦理委员会批准(批号:909022065)。
1.2资料收集 (1)通过医院电子病历系统收集患者入院后的临床资料,包括年龄、性别、吸烟史、肿瘤直径、肿瘤位置、肿瘤转移情况、TNM分期、组织学类型以及病理报告中的BRG1蛋白、CK7、CK5/6、TTF-1、P40、CD34、SALL-4、程序性死亡配体1(programmed death ligand 1,PD-L1)蛋白和肿瘤增殖指数(Ki-67)情况。(2)通过医院电子病历系统和电话随访收集患者的生存状态资料,并计算患者首次确诊后2年的总生存期(overall survival,OS)和中位总生存期(median overall survival,mOS)。末次随访时间为2023年6月13日。
1.3实验室检测方法 (1)免疫组化染色:采用EnVision两步法免疫组化染色检测肺癌活检组织中BRG1蛋白表达情况。定义BRG1蛋白表达完全缺失为与基质细胞或非肿瘤上皮细胞核中棕黄色颗粒相比,肿瘤细胞核中棕黄色颗粒表达完全缺失。定义BRG1蛋白表达部分缺失为与基质细胞或非肿瘤上皮细胞核中棕黄色颗粒相比,肿瘤细胞核中棕黄色颗粒弥漫性减少。免疫组化染色由患者所在医院的病理科完成,SMARCA4/Brg1抗体购自北京中杉金桥生物技术有限公司。(2)EGFR突变单基因检测:由患者所在医院的病理科采用实时定量聚合酶链式反应检测患者血浆中EGFR突变情况。SMARCA4缺失组63例患者、非SMARCA4缺失组173例患者进行了该项检测。(3)下一代测序(next generation sequencing,NGS)检测:SMARCA4缺失组19例患者接受了NGS检测,并接受了包括SMARCA4基因在内的425个基因筛查,其中15例为SMARCA4基因功能缺失性突变(融合突变、剪接位点突变),4例患者NGS检测时未行SMARCA4基因位点检测(通过免疫组化染色检测到肺癌组织中BRG1蛋白表达缺失而归为SMARCA4缺失组)。所有接受测序的患者均使用人类10基因突变联合检测试剂盒(厦门艾德生物医药科技股份有限公司)、基因突变的捕获探针和Illumina Miniseq测序平台,按照试剂盒说明书和实验室规范对肺癌组织进行NGS检测,并记录NGS报告中的基因移码突变、无义突变、错义突变、剪接位点突变、外显子错义突变或无义突变及肿瘤突变负荷(tumor mutation burden,TMB)情况。
1.4SMARCA4缺失型NSCLC患者治疗方法 106例SMARCA4缺失型NSCLC患者中,18例患者(Ⅲ期4例,Ⅳ期14例)因经济原因、病情恶化、个人原因未进行治疗,其余患者均接受一线治疗。Ⅰ期和Ⅱ期患者接受局部治疗或手术治疗;Ⅲ期患者中,7例接受化疗,6例接受手术治疗,2例接受局部治疗,2例接受免疫治疗联合化疗;Ⅳ期患者中,32例接受化疗,19例接受免疫治疗,3例接受姑息手术治疗(其中2例同时接受了化疗),2例接受局部治疗,2例接受靶向药物治疗。
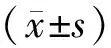
2 结果
2.1两组临床资料比较 106例SMARCA4缺失型NSCLC患者中,70例(66.04%)发生了肿瘤远处转移,远处转移部位为骨(32例)、胸膜(27例)、脑(17例)、肾上腺(16例)、肝(7例)、心包膜(6例)、肾脏(3例)、肌肉(2例)、脾(2例)、皮下组织(1例)、鼻咽(1例)和盆腔(1例),部分患者存在多处转移。与非SMARCA4缺失组比较,SMARCA4缺失组患者年龄更大,男性和吸烟史比例更高,肿瘤直径更长,Ki-67指数更高,EGFR突变比例更低,鳞状细胞癌比例更低,低分化癌比例更高,差异有统计学意义(P<0.05),见表1。

表1 两组临床资料比较[M(P25,P75),n(%)]
2.219例SMARCA4缺失型NSCLC患者的基因突变情况 (1)点突变:9例(47.37%)存在SMARCA4移码突变,3例(15.79%)存在SMARCA4无义突变,1例(5.26%)存在SMARCA4错义突变,1例(5.26%)存在剪接位点突变。(2)4例(21.05%)未发生SMARCA4突变。(3)5例(25.26%)存在SMARCA4外显子错义突变或无义突变。19例患者平均TMB值为10.43 Muts/Mb。19例SMARCA4缺失型NSCLC患者中,16例(84.21%)存在TP53突变,15例(78.95%)存在SMARCA4突变,6例(31.58%)存在LRP1B突变,5例(26.32%)存在STK11突变,4例(21.05%)存在KEAP1突变。在SMARCA4突变患者中同时存在TP53(15例,78.95%)、LRP1B(8例,42.11%)、STK11(5例,26.32%)、KEAP1(5例,26.32%)和KRAS(4例,21.05%)突变。
2.3SMARCA4缺失型NSCLC患者的病理特征 SMARCA4缺失型NSCLC患者中,95.28%(101/106)患者BRG1蛋白完全缺失,8.20%(5/61)患者CK7阴性,85.11%(80/94)患者CK5/6阴性,77.36%(82/106)患者TTF-1阴性,80.19%(85/106)患者P40阴性,66.67%(16/24)患者CD34阴性,56.52%(13/23)患者SALL4阴性,见表2。
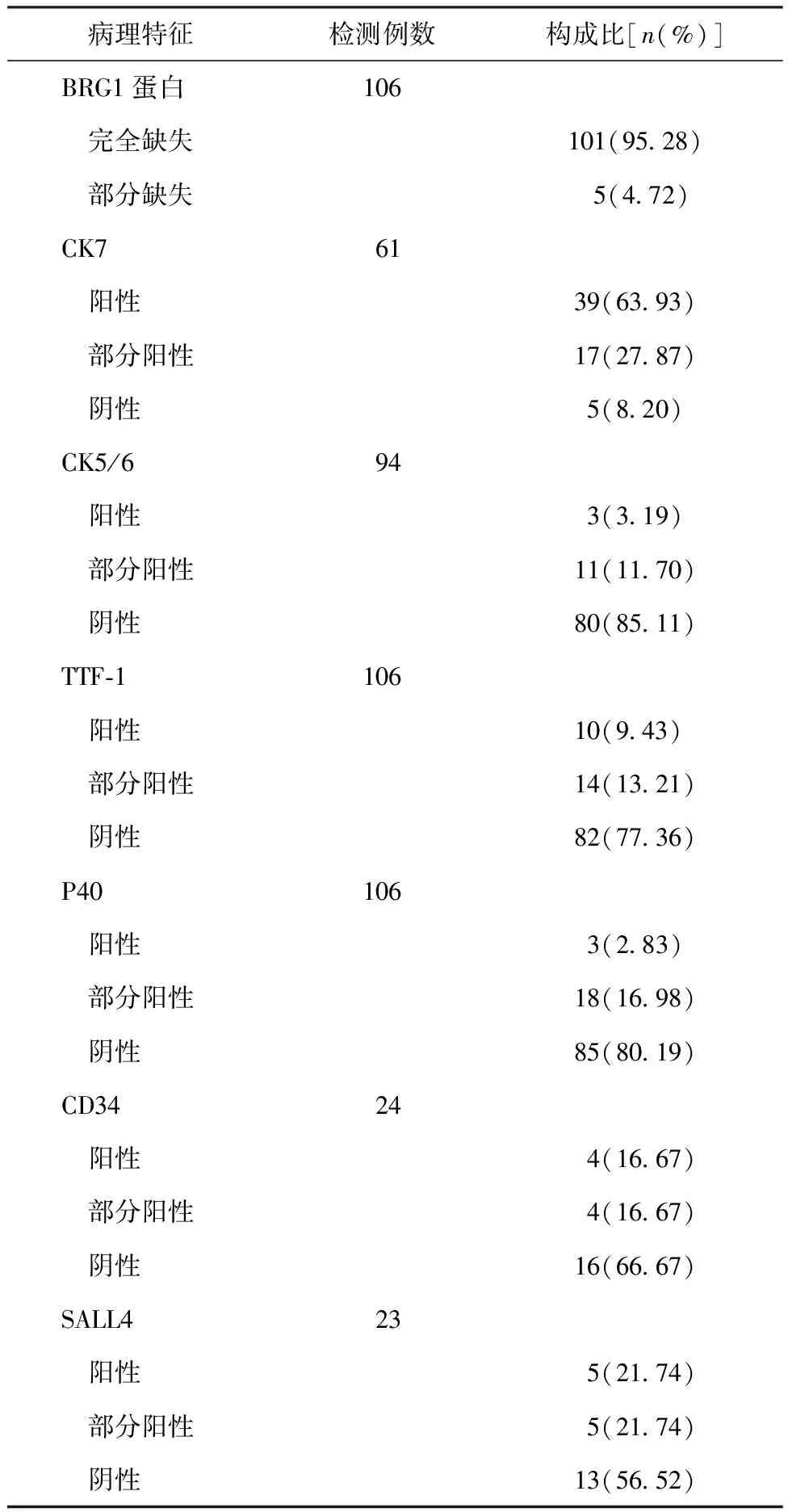
表2 SMARCA4缺失型NSCLC患者的病理特征
2.4两组患者的生存情况 随访期间,SMARCA4缺失型NSCLC患者中48例死亡,58例存活。SMARCA4缺失型NSCLC患者mOS为12.84个月,1年生存率为50.94%,2年生存率为19.81%。非SMARCA4缺失型NSCLC患者mOS为21.67个月,1年生存率为91.04%,2年生存率为75.47%。非SMARCA4缺失组2年生存情况优于SMARCA4缺失组(log-rank检验:χ2=126.837,P<0.001),见图1。
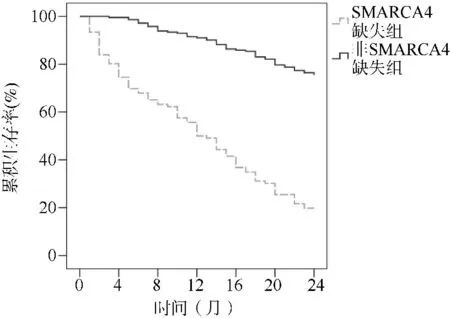
图1 两组2年生存情况的Kaplan-Meier曲线图
2.5影响SMARCA4缺失型NSCLC患者生存时间的Cox回归分析结果 单因素Cox回归分析结果显示男性、年龄、吸烟史、肿瘤直径、TNM分期、远处转移与SMARCA4缺失型NSCLC患者生存时间具有关联性(P<0.05)。进一步将这些指标纳入多因素Cox回归模型,结果显示男性、年龄增长、有吸烟史和较长的肿瘤直径是缩短SMARCA4缺失型NSCLC患者生存时间的独立危险因素,见表3。
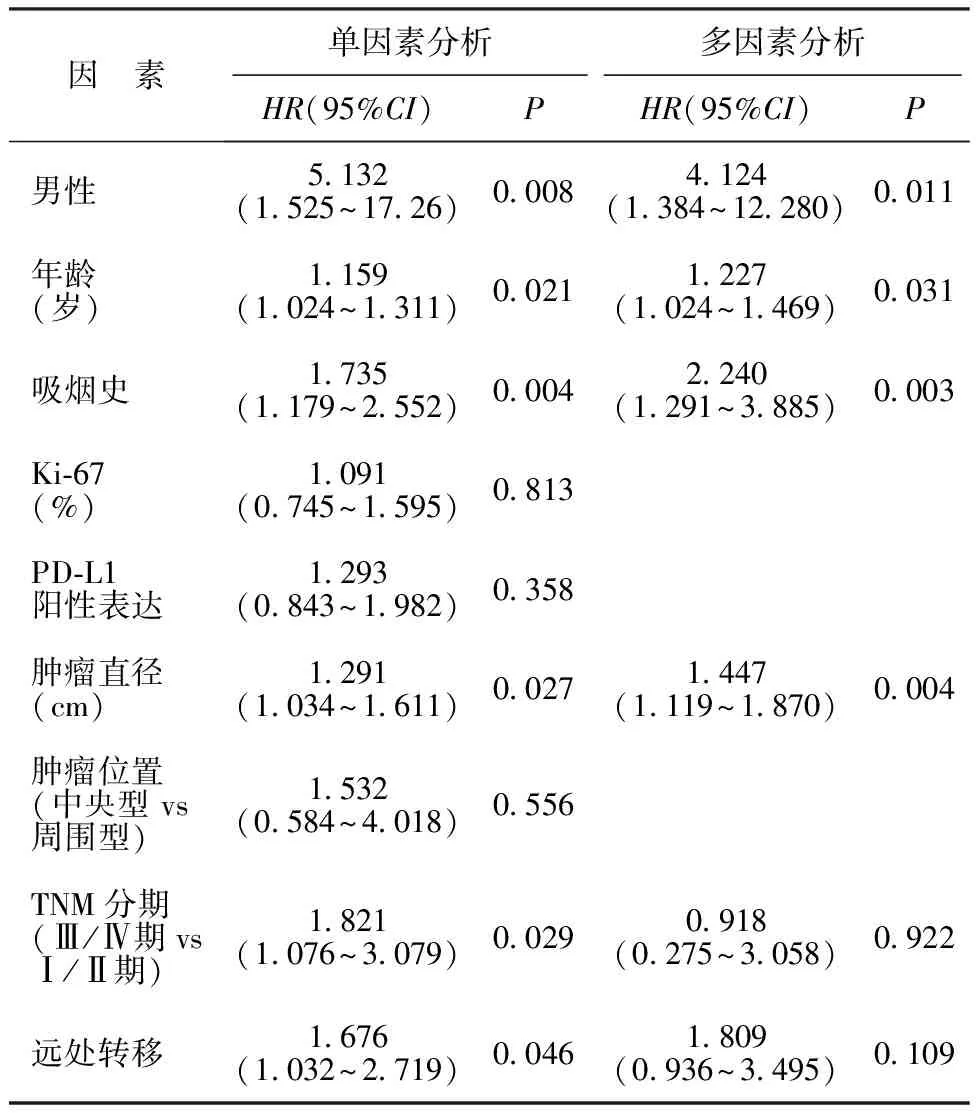
表3 影响SMARCA4缺失型NSCLC患者生存时间的Cox回归分析结果
3 讨论
3.1SMARCA4缺失型NSCLC近年来受到学者的关注。既往报道SMARCA4缺失型NSCLC有不同分化程度的病理组织学分级,也有腺癌、黏液腺癌、腺泡状癌、鳞状细胞癌、大细胞癌、肺横纹肌肉瘤以及梭形细胞癌等多种组织学分型[6]。本研究纳入的SMARCA4缺失型NSCLC患者多数为男性吸烟者,中位发病年龄约为67岁,大多数患者在确诊时已经为Ⅳ期,伴有较长的肿瘤直径、较高的Ki-67指数。此外,由于该类型NSCLC恶性程度更高,患者预后较差。
3.2SMARCA4基因位于19p13.2染色体上,SMARCA4突变可导致BRG1蛋白表达缺失[7]。因此,当免疫组化染色证实BRG1蛋白表达阴性时,不再需要进行NGS检测SMARCA4基因突变情况即可确定为SMARCA4缺失型NSCLC[8]。本研究通过NGS检测的19例患者中,4例患者经免疫组化染色证实了BRG1蛋白表达缺失而未行SMARCA4基因检测。BRG1蛋白表达缺失与SMARCA4基因内含子区域的结构变异、microRNA介导转录后抑制或其他SWI/SNF家族蛋白突变有关[9]。SMARCA4基因突变类型分为Ⅰ类突变和Ⅱ类突变,Ⅰ类突变包括截短突变(移码和无义突变)、基因融合和纯合缺失,Ⅱ类突变为错义突变。BRG1蛋白缺失与SMARCA4基因Ⅰ类突变有关,既往研究证实了Ⅰ类突变患者生存时间短于Ⅱ类突变者[10]。
3.3SMARCA4缺失型NSCLC患者的Ki-67指数较高、肿瘤直径相对较长,表明该类型肿瘤增殖速度较快。在SMARCA4缺失型未分化肉瘤[11]、消化道肿瘤[12]、妇科肿瘤[13]中也观察到类似临床特点,与SMARCA4缺失型NSCLC相似,同样为高度侵袭性恶性肿瘤,易发生转移,患者预后差。
3.4接受NGS检测的SMARCA4缺失型NSCLC患者平均TMB值为10.43 Muts/Mb。Naito等[14]研究证明,SWI/SNF复合体亚基(SMARCA4、SMARCA2、ARID1A或ARID1B)表达缺失的NSCLC患者肿瘤侵袭性更高,其PD-L1阳性率和TMB更高。关于SMARCA4缺失型NSCLC基因研究表明,患者常伴有SMARCA4、KRAS、STK11、TP53、KEAP1和LRP1B等基因突变,且伴有SMARCA4、TP53或STK11突变的NSCLC患者总生存时间相对更短[15]。KRAS、STK11和KEAP1等基因突变与患者的吸烟史有关[15]。STK11和KEAP1突变分别与化疗、免疫治疗耐药性具有相关性[16]。
3.5既往对胸部SMARCA4缺失的未分化肿瘤特征研究发现,除SALL4外,大多数SMARCA4缺失型肿瘤的CD34等干细胞标志物呈阴性[17-18]。本研究中免疫组化染色结果符合上述特征。肺腺癌大多为TTF-1阳性表达[19-21],而本研究SMARCA4缺失型NSCLC患者中77.36%为TTF-1阴性,13.21%为部分阳性。本研究SMARCA4缺失型NSCLC患者中66.04%存在肿瘤远处转移,提示SMARCA4缺失型NSCLC侵袭性较高。目前,对于SMARCA4缺失型NSCLC尚无明确的治疗方案,现有的治疗方法包括使用靶向线粒体氧化磷酸化通路抑制剂、免疫检查点抑制剂等[22-23]。此外,有研究报道顺铂和长春瑞滨可作为ⅠB期、Ⅱ期可切除性SMARCA4缺失型NSCLC的治疗方案[24]。由于本研究受限于患者临床分期和治疗方案组成种类较多,未比较不同治疗方法对患者预后的影响,这将是今后研究的一个方向。
3.6SMARCA4缺失型NSCLC患者预后较差。Nambirajan等[2]研究发现,Ⅳ期NSCLC患者mOS仅为4.4个月,显著短于Ⅱ/Ⅲ期患者。本研究SMARCA4缺失型NSCLC患者mOS为12.84个月,1年生存率为50.94%,2年生存率为19.81%,患者mOS长于文献[2,25]报道的4~7个月。这可能是由于近年来PD-L1单抗等免疫治疗药物发展,尤其是免疫疗法联合化疗的治疗策略进展对SMARCA4缺失型NSCLC患者的预后具有一定帮助,此外,也可能与SMARCA4缺失型NSCLC患者本身异质性较强有一定关联。本研究通过多因素Cox回归分析确定了男性、有吸烟史、年龄增长和较长的肿瘤直径是缩短SMARCA4缺失型NSCLC患者生存时间的独立危险因素,这与既往研究结果相似[25-27]。本研究生存分析结果显示SMARCA4缺失型NSCLC患者2年生存率显著低于非SMARCA4缺失型NSCLC患者,提示SMARCA4缺失型NSCLC患者预后相对较差。
3.7本研究为回顾性研究,具有一定的局限性:(1)只有部分患者进行了PD-L1、NGS和特定免疫组化染色检查。(2)对于分期和治疗方法不同的SMARCA4缺失型NSCLC患者,未比较无进展生存期、OS等差异。(3)本研究纳入的SMARCA4缺失型NSCLC女性患者数量相对较少,而性别差异是否会对患者预后造成影响需要进一步证实。
综上所述,本研究通过分析SMARCA4缺失型与非SMARCA4缺失型NSCLC患者的临床特征,以及SMARCA4缺失型NSCLC患者的病理特征、基因突变情况及预后影响因素,证实了SMARCA4缺失型NSCLC是一种不同于非SMARCA4缺失型NSCLC的肿瘤,患者预后较差,肿瘤侵袭性高。今后需要进行前瞻性、大样本研究以明确不同分子特征和治疗方法对SMARCA4缺失型NSCLC患者预后的影响。

