胰腺实性假乳头状瘤伴肝转移一例
江敏芝, 江书典, 胡明政
1 病例介绍
患者,女,44岁,因“发现腹部占位1周”于2020年4月20日入住宜昌市中心人民医院。体格检查:腹部平软,无压痛、反跳痛,未触及包块,肝脾未触及,Murphy征(-),肝区无叩击痛,无移动性浊音,肠鸣音正常。血常规、生化检查无明显异常,肿瘤标志物阴性。胰腺平扫增强CT检查(见图1):胰腺尾部见团块状混杂低密度影,大小约6.3 cm×5.8 cm,病灶密度不均,内见点状钙化,周围间隙稍模糊,增强扫描病灶强化程度低于正常胰腺强化程度,肝内见多发类圆形低密度影,边界欠清,增强扫描病灶环形强化,胆囊结节状高密度影,脾脏增大。胰腺动、静脉造影检查:胰腺病灶由脾动脉分支供血,脾脏静脉受侵,近中远段闭塞,周围多发侧支血管,胃壁静脉曲张,右侧见副肾动脉。影像学诊断考虑胰腺癌伴肝转移、胆囊结石、脾大。正电子发射断层扫描/计算机断层扫描(positron emission tomography/computed tomography,PET/CT)提示胰腺尾部团块病灶,代谢异常增高,考虑肿瘤;肝脏多发低密度结节,代谢增高,考虑肝脏转移。患者于2020年4月22日在超声引导下行肝占位穿刺活检术,病理结果提示:镜下见肝细胞分化尚好,另见较多异型细胞呈腺样、实性巢状排列,周围间质细胞见黏液样变性,细胞内外可见嗜酸性小体,考虑为恶性肿瘤。肝脏穿刺物免疫组化结果(见图2):CK8/18(+),CK19(-),CK7(-),AFP(-),GS(+),Glypican-3(+),HSP70(弱+),CD10(+),Ki-67(约7%+),CgA(-),Syn(-),CD56(膜+),HCC(-),pgp9.5(-),CD34(血管+),Vimentin(+),PR(弱+),β-catenin(浆、核+),NSE(部分弱+),E-cad(-)。特殊染色结果:PAS(+),PAS+淀粉酶(+)。5月8日在全麻下行腹腔镜辅助中转开腹的胰体尾切除、脾脏切除、胆囊切除、肝脏多发肿瘤切除术,术后予以对症治疗。术后病理结果:(1)结合镜下形态及免疫表型,符合胰腺实性假乳头状瘤(solid pseudopapillary neoplasm of the pancreas,SPN)伴出血,肿瘤大小约6.5 cm×6.0 cm×5.0 cm。免疫组化结果(见图3)为CD10(+),CD56(+),CgA(-),Cyclin D1(+),Galectin-3(散在+),NSE(部分+),Vimentin(+),PR(部分+),Ki-67(约5%+),Syn(散在+),β-catenin(+),PCK(AE1/AE3,散在+)。(2)送检(肝转移瘤)镜下可见实性假乳头状瘤图像,染色结果:PAS(+),PAS+淀粉酶(+)。(3)慢性胆囊炎伴胆石症。术后病理结果结合手术标本免疫组化结果,诊断为SPN伴肝转移。患者出院后2次来院行介入栓塞治疗。患者于当地医院定期复查,电话随访3年,未见复发及转移。本研究获宜昌市中心人民医院医学伦理委员会批准。
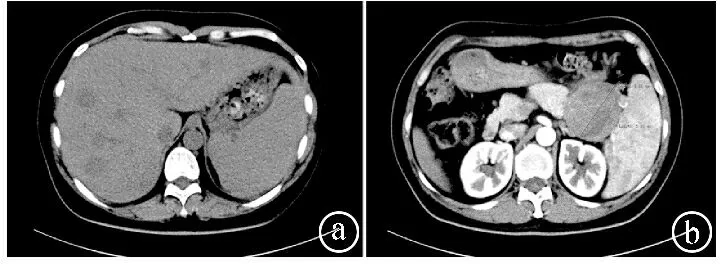
ⓐ肝脏多发低密度影;ⓑ胰腺尾部可见团块状低密度影
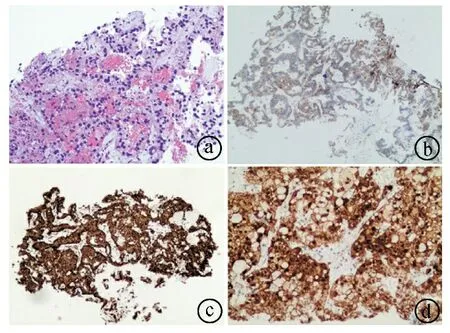
ⓐHE染色(×100);ⓑCD10染色(×40);ⓒVimentin染色(×40);ⓓβ-catenin染色(×100)
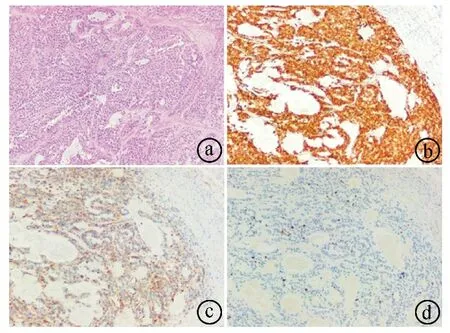
ⓐHE染色(×100);ⓑCD10染色(×40);ⓒVimentin染色(×40);ⓓβ-catenin染色(×100)
2 讨论
2.1SPN是罕见的胰腺低度恶性肿瘤。该肿瘤一般为较大且边界清楚的混合性实体瘤或囊性肿瘤,占外分泌型胰腺肿瘤的1%~2%,占胰腺囊性肿瘤的5%[1]。SPN可发生在胰腺任何部位,以体尾部较常见。有研究表明,性激素可能参与SPN的发病机制,孕酮可能是其致癌因子,因此SPN常见于年轻女性,男性和老年人的发病率较低[2-3]。转移性SPN少见,占SPN的5%~15%,肝脏转移的报道较常见,可能与胰腺静脉回流有关[4]。因胰腺是腹膜间位器官,当肿瘤向周围侵犯时,其邻近器官组织,如肝脏、十二指肠、腹膜及邻近血管等容易受累[5]。本例报道为44岁女性患者,其肿瘤发生在胰腺体尾部并肝脏多发转移。
2.2大多数SPN患者有上腹不适等非特异性症状,或有肿瘤逐渐增大产生的压迫症状,部分患者完全没有症状,仅通过影像学检查偶然发现肿瘤,几乎没有实验室特异性指标[6]。SPN在CT上通常表现为边界清楚的圆形或卵圆形低密度影,出血和囊变则表现为更低密度区,难以与其他胰腺肿瘤相鉴别,例如胰腺癌、胰腺浆液或黏液性囊腺瘤、囊腺癌、胰腺囊肿等[7]。本例患者急行腹部CT时发现大小约6.3 cm×5.8 cm的胰腺尾部占位性病变,脾脏血管受侵,考虑为胰腺癌,并且肝内占位图像与胰腺占位有相似表现,PET/CT提示胰腺尾部团块病灶及肝脏多发低密度结节代谢异常增高,初步诊断为胰腺癌伴肝脏转移,但仍需进一步病理检查明确诊断。
2.3SPN可采用超声内镜进行占位组织穿刺活检[8]。本例患者有肝脏转移灶,先进行肝脏占位组织活检,检查结果考虑为恶性肿瘤,遂行腹腔镜下胰腺体尾切除、脾脏切除、胆囊切除、肝脏多发肿瘤切除术。SPN通常为边界清楚的圆形或类圆形肿物,一般较大,有实性、囊性、出血和坏死等多样表现,以实性为主的SPN较少见[9]。本例患者胰腺肿物与周围组织分界较清,切面灰白,呈实性,部分区域出血、坏死;肝脏转移瘤直径为0.9~2.7 cm,包膜完整,与周围组织分界较清,切面灰白,呈实性。SPN在镜下呈一种带有血管柄的假乳头和有出血的囊性成分的特征性结构,间质伴透明变、黏液变,其间有丰富的毛细血管,肿瘤细胞的细胞质嗜酸性,核圆而小,染色质细腻,常有核沟或凹陷,通常呈凹槽状[10]。本例患者送检标本镜下可见多异型细胞,周围间质细胞黏液样变性,细胞内外可见嗜酸性小体。除了镜下形态,还需要通过免疫组化来进一步明确诊断。不同肿瘤细胞表现出不同程度的异质性,在SPN中,β-catenin、Vimentin、α1-抗胰蛋白酶、神经元特异性烯醇化酶等通常呈强阳性染色,CD10以及孕激素受体大多呈阳性,角蛋白在大部分病例中有表达[11-12]。本例患者胰腺肿物及肝脏穿刺物免疫组化结果显示β-catenin、Vimentin、CD10等染色阳性,明确诊断为SPN伴肝脏转移。
2.4手术是SPN患者的首选治疗方案,具体手术方式取决于肿瘤的位置、大小以及其对周围组织侵犯、转移等情况。肿瘤若发生在胰头,一般行根治性胰十二指肠切除术;若发生在胰腺体尾部,一般行远端胰腺切除术。有研究提出SPN摘除术不仅能取得相似的手术效果,也不会增加复发风险,而且与传统术式相比,还有恢复更快、减少腺体分泌功能影响的优点[13-14]。由于SPN的罕见性和惰性,其肝转移的最佳治疗方案尚不明确。本例患者肿瘤发生在胰腺尾部及肝脏,首选行腹腔镜下胰体尾、肝脏多发转移瘤、脾切除术,由于患者脾脏动脉和静脉受侵犯,分离困难,最终行中转开腹术。与胰腺癌不同,大多数SPN伴肝脏转移的患者进行转移病灶手术切除后存活时间延长,预后良好[13,15]。对于不能切除或不能完全切除肝脏转移灶的患者,采用射频消融术、介入栓塞术、放疗或化疗等措施也能取得良好效果[6]。本例患者肝脏转移灶>5个,不适宜行肝脏转移瘤射频消融术,出院后患者2次来院行介入栓塞术治疗。在3年随访中,患者未见复发及转移。
综上所述,SPN是一种罕见的低度恶性肿瘤,常见于年轻女性,罕见转移。实验室检查以及影像学检查往往难以确诊,SPN诊断标准主要依靠病理检查。SPN伴肝转移通常首选的治疗方式为手术切除原发肿瘤以及转移灶,针对不能手术切除的肝转移灶也可行射频消融术、介入栓塞术等综合治疗,一般预后良好。

