基于分子库策略的蛋白质O-糖基化研究
巩金媛, 商世瑛, 谭忠平*
(1)中国医学科学院/北京协和医学院药物研究所合成药物化学研究室, 北京 100050;2)清华大学药学技术中心, 北京 100084)
自从30多年前认识到蛋白质糖基化(glycosylation)可能的重要性之后,包括生物和化学等许多学科展开了在这个方向上的探索[1,2]。这些探索提供的大量数据表明,糖基化可以大幅提高蛋白质的结构多样性,进而提高其性质和功能的多样性;特定的糖基化模式可以赋予蛋白质特定的性质和功能,而异常的糖基化模式则有可能是导致许多人类疾病的重要因素。糖基化的这些作用很可能是通过调节蛋白质的构象和/或结构实现的[3]。然而,由于严重缺乏具有高纯度和均一组成的样品,蛋白质糖基化长期以来一直未得到充分和可靠的研究,导致许多问题,例如糖基化能够调节蛋白质的哪些性质和功能,糖基化是如何实现对这些性质和功能的调节,这些调节在生物体中有何重要性和必要性,以及如何能够更好地利用蛋白质糖基化进行疾病的诊断治疗和工业用酶性能的提高等,都未得到较好的回答。要想找到这些问题全面且准确的答案,首先需要获得适合研究的样品。然而,由于生物体中蛋白质糖基化过程的复杂性和制备方式以及制备工具的匮乏,在较长一段时间里,这一需求一直未得到满足[4]。
在生物体中,糖基化是在蛋白质的翻译过程中或翻译完成后,由各种不同的酶,包括糖基转移酶(glycosyltransferase,GTs)和糖苷水解酶(glycoside hydrolases,GHs),利用活化的糖单元,在细胞的内质网(endoplasmic reticulum,ER)、高尔基体(Golgi apparatus,Golgi)或细胞质(cytoplasm)中完成的[5]。在糖基化中,糖是以糖苷键的形式(共价键)连接到特定的氨基酸侧链的官能团上。糖基化是除了磷酸化之外蛋白质上带有的最常见的修饰形式。根据糖苷键中与糖相连的氨基酸侧链原子的不同,蛋白质糖基化可以分为主要的两大类,即氮(N)-糖基化和氧(O)-糖基化。在N-糖基化中,糖主要与天冬酰胺(asparagine, Asn)残基侧链酰胺官能团中的N原子相连。这类糖基化的Asn位点的共同特征是它们都存在于保守序列Asn-Xaa-Ser/Thr中,其中Xaa是除了脯氨酸(proline, Pro)外的所有其它天然氨基酸。在O-糖基化中,与糖相连的主要是丝氨酸(serine, Ser)和苏氨酸(threonine, Thr)侧链羟基官能团中的O原子。含有O-糖基化位点的蛋白质序列虽然也有时存在一定的规律性,但是到目前为止,仍未发现像N-糖基化那样的保守序列[6]。
同所有酶催化的生物合成过程一样,糖基化同时受到包括基因因素和环境因素在内的许多因素的共同影响和调控。这些因素包括蛋白质的氨基酸序列、糖基化位点的局部构象特性和糖基化位点附近的空间结构、糖基化过程中活化糖单元底物和酶的种类以及浓度等。除了基因因素外,大多数因素在调控时存在较大的不确定性和随机性,导致生物体中合成出来的糖蛋白质主要以复杂混合物的形式存在,特别是当同一个蛋白质中含有多个糖基化位点的时候。在这种情况下,糖基化位点会随着生物合成条件的变化而在占有程度上发生变化:有的位点糖基化的程度高,有的位点程度低。这种位点占有程度的变化会导致蛋白质糖基化的宏观异质性。宏观异质性在蛋白质的其它类修饰中,例如磷酸化、硫酸化和糖化(glycation)等修饰中也非常常见。然而,糖基化的另外一个特点,微观异质性,在这些修饰中却并不存在。所谓微观异质性,是指连接在同一个糖基化位点上的糖分子在大小、电荷状态、分支模式和糖苷键的立体构型等相对细微的特征上存在差异。这两种同时存在的异质性的组合,使从生物体中获得的糖基化的蛋白质(简称糖蛋白,glycoprotein)通常以含有多达上百种不同异形体(简称糖基化异形体,glycoforms)的复杂混合物的形式存在[7]。
糖蛋白混合物中具有不同糖基化位点占有度和/或带有不同糖结构的异形体具有几乎相同的色谱性质。目前,仍未见任何可靠的方法能够对混合物里的糖基化异形体分别进行定量,也未见可靠的技术能够将异形体逐一分离开,并将其纯化成适合研究的具有高纯度的样品。这些长期存在的问题导致许多研究中使用的样品都是组成完全未知的生物来源的混合物。在这些研究中,分析糖基化作用的常用方法之一是直接比较糖基化异形体混合物与其对应的未糖基化的蛋白质的性能的不同。这样的方法给出的糖基化的作用,在大多数时候只是混合物中所有不同位点、不同结构的糖的平均作用,并不能给出特定结构的糖在特定的糖基化位点会有什么样的作用。更为复杂的是,不同团队在研究同一个糖蛋白时使用的混合物的组成通常无法完全相同,这种情况导致的结果就是他们的研究结论可能会不一致,有的时候甚至相反。前期研究所得结论的这种模糊性和不一致性,让人很难通过对文献的调研和总结,推断出关于蛋白质糖基化作用的可能答案,这在一定程序上打击了从事糖基化研究的热情,导致其发展与进步异常缓慢[8]。
要想获得对蛋白质糖基化生物学作用全面、准确和深入的认识,首先需要获得组成均一、结构确定的高纯度的样品。为了实现这一目标,研究人员探索了许多种不同的方法。这些方法,从本质上看,可以被归为两大类,一类是生物学方法,包括糖基化途径改造(glycosylation pathway engineering)[9]、糖结构重塑(glycan remodeling)[10]和酶法糖基化合成(enzymatic glycosylation)[11],另一类是化学合成法(chemical glycosylation)[12]。利用这些方法,近年来,逐渐制备出了一些在糖基化模式(包括糖基化位点和糖结构)上具有系统差异的糖基化异形体分子库(glycoform library)。这些分子库中包含的分子都具有已知的结构和较高的纯度。分子库的这些特征保证了糖基化研究结果在一定程度上的正确性。
然而,截止到目前为止,由于技术上的限制,不论是使用哪种方法,分子库的制备都极其困难,因此,基于糖基化异形体分子库进行的研究和获得的结论还屈指可数,远未达到能够形成融合在一起的具有高度系统性的知识体系的程度;同时,各个研究团队都是在自己熟悉的领域,选择使用自己擅长的糖蛋白作为模式分子进行研究。这些分子不但蛋白质部分结构迥异,糖部分的结构也截然不同,这种在研究对象上的选择随意性和差异性,导致仍无法将其在研究中获得的糖基化的作用放在同一个框架內进行直接地相互比较;另外,由于不同的研究团队对分子库制备方法的熟悉和掌握程度不同,因此,在使用分子库研究策略的时候,库中糖基化异形体分子的数目和后续实验的设计也存在较大的差异。这种差异在一定程度上影响了其糖基化作用研究结论的全面性和深入程度[13]。总之,目前的研究状况决定了在现阶段仍无法把基于糖基化异形体分子库的研究象其它已经趋于成熟的领域和方向那样,把已有的研究综合在一起,经过高度的归纳和提炼,形成一个具有一定普适性的中心观点,而是只能以一个个“案例”的形式进行阐述和分析。
在本综述中,我们选择大致按照时间的顺序和使用的模式分子,对前期基于分子库策略进行的蛋白质O-糖基化研究“案例”从研究对象、研究的主要目的、分子库构建的方法、分子库的大小和分子结构、取得的成果和结论等方面进行简洁的疏理和总结。在综述最后的结论与展望部分,我们根据前期的研究内容,对分子库策略的优缺点、存在的问题、和在未来的进一步应用进行了简单的讨论。
综述选择的蛋白质的O-糖基化与N-糖基化相比,是一种可以分成更多不同种类的更复杂的糖基化类型。在哺乳动物中,根据连接到丝氨酸和苏氨酸侧链氧原子上第1个糖的结构的不同,O-糖基化至少可以分为7类,包括N-乙酰氨基半乳糖 (α-O-GalNAc)、甘露糖 (α-O-Man)、 岩藻糖 (α-O-Fuc)、葡萄糖 (β-O-Glc)、N-乙酰氨基葡萄糖 (β-O-GlcNAc)、半乳糖 (β-O-Gal) 和木糖 (α-O-Xyl)糖基化[14]。在先前使用的分子库策略对O-糖基化进行的研究中,连接在研究对象上的第1个糖分子结构单元也主要是以上这些分子。
在哺乳动物中,O-糖基化主要发生在内质网、高尔基体和细胞质中,它们通过改变蛋白质的稳定性、聚集性、结合力和活性等的方式对生命活动产生影响。在这些糖基化中,最常见的主要是3种:N-乙酰氨基半乳糖,N-乙酰氨基葡萄糖和甘露糖糖基化。N-乙酰氨基半乳糖糖基化主要在高尔基体中,由约20种不同类型的转移酶将N-乙酰氨基半乳糖转移到已经折叠好的分泌蛋白质上,进而通过更多酶催化的糖链延长而实现。N-乙酰氨基葡萄糖糖基化则通常在细胞质中,由2种非常特殊的酶,N-乙酰氨基葡萄糖糖转移酶和水解酶的催化,实现该糖的添加和去除的循环发生。甘露糖糖基化的发生涉及细胞内3个不同的空间位置。首先是在细胞质中,由酶复合物催化合成多甘醇磷酸甘露糖供体分子,然后在内质网中,通过蛋白质O-甘露糖基转移酶将甘露糖连接到蛋白质上,最后,在高尔基体中,由更多酶的催化,实现糖链的进一步延长和结构多样性的增加。
1 表皮生长因子样重复序列O-糖基化作用的探索
在2010年,Shin-Ichiro Nishimura课题组(以下简称Nishimura组)使用化学合成的方法制备了3个表皮生长因子样重复序列12(epidermal growth factor, EGF12)的糖基化异形体(其中包括1个未糖基化的分子,这一点在后面所有研究对象的描述中都一样)。NOTCH信号通路是许多生物中常见的信号转导系统。EGF12样重复序列是NOTCH1受体的胞外域的重要组成部分,它的Thr15带有α-O-Fuc糖基化。本研究的主要目的,就是通过核磁共振 (nuclear magnetic resonance, NMR),对3个合成的分子进行结构上的表征和比较分析,从而探索这类糖基化在EGF12的结构中可能的作用[15]。研究结果表明,糖基化并未改变EGF12的骨架结构;但是α-O-Fuc上的甲基可以与空间上邻近的氨基酸残基形成相互作用,从而帮助稳定EGF12的反平行β-折叠结构;同时,在α-O-Fuc添加GlcNAc会导致糖基化位点附近的三肽序列发生显著的构象变化。这些发现说明,糖基化可能会通过改变EGF12的结构特征,从而在调节NOTCH1受体-配体相互作用中发挥一定的作用。
在2017年,Nishimura组又使用化学合成法制备了另外3个EGF12的糖基化异形体。加上前面合成的,凑成了总共6个分子,用来对糖基化在EGF12折叠的过程中可能发挥的作用进行比较分析(Fig.1A)。研究结果表明,在Ca2+存在的条件下,未糖基化的EGF12在体外氧化折叠过程中会产生大量错误的折叠产物(>50%)。糖基化对折叠的影响比较复杂:Ser7上的β-O-Glc单糖能够较好地促进EGF12的正确折叠,而Thr15上的α-O-Fuc单糖对折叠的影响不大;增加Ser7上糖的长度对糖在EGF12的正确折叠的作用有负面影响,而增加Thr15上糖的长度则对糖在折叠中的作用有正面影响[16]。

Fig.1 O-Glycosylation of epidermal growth factor (EGF) (A)-(B) Synthetic glycoforms of EGF12, 10 and 11 used in the studies. The C-terminus of EGF10, 11, and 12 is amidated, and the N-terminus of EGF10 and 11 is acetylated. Disulfide bonds are denoted by the blue line
在2020年,Nishimura组使用类似的化学合成方法制备了4个EGF10和5个EGF11的糖基化异形体(Fig.1B,C)。对这些异形体的折叠和NMR结构研究的结果表明,特定的O-糖基化对EGF10的体外折叠影响大于对EGF11的影响;位于EGF11的Thr34上的β-O-GlcNAc可以与位于EGF11和12之间铰链区中的Ile40发生特定的相互作用;在EGF10的Thr34上的β-O-GlcNAc则可以与位于EGF10和11之间铰链区中的Gln40发生特定的相互作用。这些相互作用帮助调节NOTCH1细胞外结构域的柔性和刚性。另外还发现,EGF10中Ser7上的三糖与Lys24形成的相互作用也能影响构象稳定性[17]。综上所述,Nishimura组的结果表明,O-糖基化在NOTCH1胞外结构域的折叠和构象形成中可能存在一定的重要性。这些研究为更全面地了解NOTCH1信号转导指出了一个重要的研究方向。
2 水蛭素P6的O-糖基化对其功能的作用
在2014年,Richard Payne课题组(Payne组)使用分子库策略研究了水蛭素P6(hirudin P6)中O-糖基化的作用。水蛭素P6是一种抗血栓蛋白质,分别在Thr43 上带有α-O-GalNAc和在Tyr61带有磺酸基。他们使用化学合成的方法制备了6种水蛭素P6的糖基化异形体(包含带有磺酸基和不带磺酸基的变体)(Fig.2)[18]。通过对合成的异形体进行比较,研究发现,糖基和磺酸基对水蛭素P6的修饰都可以提高其对人凝血酶的纤维蛋白溶解活性和酰胺溶解活性的抑制作用。二糖的抑制作用大于单糖。这个研究表明,O-糖基化和其它一些翻译后修饰可以作为有效的手段,用于更好地调控水蛭素P6的抗血栓活性。
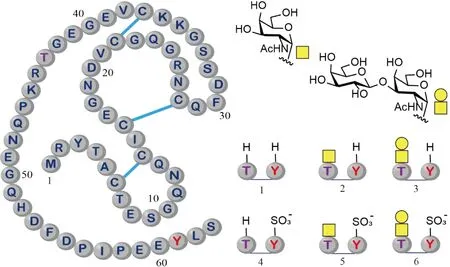
Fig.2 Structures of the synthetic glycoforms of hirudin P6 Hirudin P6 is glycosylated at Thr43 and sulfonated at Tyr61 (Left). The right side displays the glycans utilized in this study, along with the chemically synthesized glycoforms. Disulfide bonds are denoted by the blue line
3 碳水化合物结合模块的O-糖基化对其性能的作用
在2014年,谭忠平课题组(谭组)使用分子库策略开始了在蛋白质O-糖基化方面的研究。他们使用化学合成的方法,利用真菌二糖水解酶中的碳水化合物结合模块 (family 1 carbohydrate binding module,CBM)作为模式分子进行研究[19]。CBM之所以作为模式分子使用,主要是因为它的2个特点:一是它的氨基酸序列相对比较短,可以有效地减少化学合成制备糖基化异形体时的繁琐程度和耗时长度,从而能够在合理的时间内获得足够数量的分子;二是它具有大多数糖蛋白共有的结构特征,包括多于1个糖基化位点和二硫键,明显的二级结构和三级结构,多种不同的性质和功能等。在将近10年的系统研究中,该组合成并使用了最大的分子库。库中含有多于60个糖基化异形体(Fig.3)。这些异形体,既有在不同位点带有不同糖的分子,也有带有氨基酸突变的分子。通过对这些分子的酶稳定性、热稳定性、底物结合力、特异性以及结构的表征和系统的比较分析,该组首次获得了对O-糖基化作用和作用机制比较全面和深入的认识。
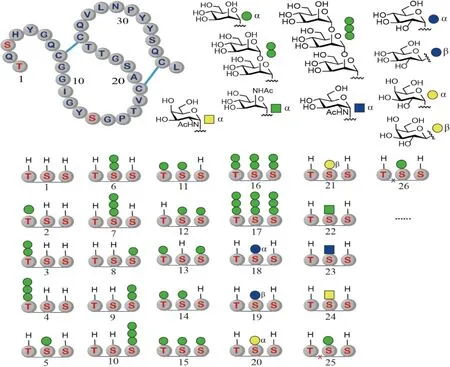
Fig.3 Representative structures of the synthetic CBM glycoforms CBM is glycosylated at Thr1, Ser3, and Thr14 with α-O-Man (top left). The glycans used in the studies are depicted in the top right, and some of the chemically synthesized glycoforms are shown in the bottom. Disulfide bonds are denoted by the blue line, and x represents the mutated amino acids
3.1 糖基化CBM分子库的化学合成
CBM上带有3个糖基化的位点,Thr1,Ser3和Ser14。在这3个位点上,主要存在3种糖基化状态:未糖基化,连有1个、2个和3个甘露糖(Fig.3)。化学合成法和酶合成法都有可能用于糖基化CBM的合成。结合模块由于相对较小,在化学合成法的能力范围之内。同时,由于化学合成法在引入糖基化的时候不像酶法一样由氨基酸序列决定和控制,因此,即使在带有氨基酸突变的CBM上,它也可以引入糖基化,从而能够最大程度提高研究样品的多样性,使其全面深入进行研究成为可能。为了制备不同的糖基化异形体,谭组首先优化合成了多种氨基和侧链,使其被合适的基团保护的糖基化氨基酸[20]。虽然在CBM中最常见的O-糖是丝氨酸和苏氨酸连接的甘露糖,但为了挖掘糖基化的作用,该组还合成了较多带有不同类型保护基的糖基化氨基酸砌块[21]。这些砌块的合成量一般可以达到克级和10克级。这样大量的糖基化氨基酸砌块的获得,使糖基化的CBM优化和合成成为了可能。利用这些砌块,通过系统筛选树脂、偶合试剂、假脯氨酸二肽、脱保护试剂和条件、以及折叠缓冲液等,该组找到了能大幅提高糖基化CBM制备效率的优化条件[22]。使用这种优化的条件,不但大幅缩短了糖肽固相合成的时间,也缩短了糖肽折叠生成糖蛋白的时间,最终提高了糖基化异形体的合成效率,从而能够制备出迄今为止最大的糖基化异形体分子库[23]。
3.2 糖基化对CBM酶稳定性和热稳定性的作用与可能的机制
在大的糖基化异形体分子库合成之后,谭组的研究证明,它是一个定量确定O-糖基化在调控蛋白酶水解稳定性和热稳定性方面发挥作用的较好策略。在多次探索之后他们发现,只有当在结构上具有系统差异的异形体的数目达到15种以上时,通过对它们性质的比较,才能获得对糖基化作用更好的了解[19]。比较的结果显示,糖基化对CBM稳定性的作用受较多不同因素的影响。这些因素既包括糖基化的位点、又包括糖的大小、糖的结构、连接糖的氨基酸的结构以及糖基化位点附近氨基酸的结构。糖基化一般都能够提高CBM的稳定性,某些特定的糖结构可以更好地提高其稳定性;Ser3位点(离蛋白酶水解位点很近)上的糖基化的作用大于其它位点上的糖基化;糖基化能否发挥作用大多数在单糖的水平上就能观察到,增加糖的大小可以进一步提高CBM的稳定性;天然的氨基酸序列和天然的糖结构(α-连接的甘露糖)能带来更好的稳定性;蛋白酶水解稳定性和热稳定性随糖基化的变化而变化的规律基本一致[21]。这些结果说明,决定蛋白酶水解稳定性和热稳定性的因素可能是类似的;通过协同改变蛋白酶水解位点附近的氨基酸序列和糖基化位点上的糖结构,同时辅以添加更多的糖基化位点,可以找到具有更好的蛋白酶水解稳定性和热稳定性的糖基化异形体。
3.3 糖基化对CBM底物结合力和特异性的作用及其机制
糖基化除了对蛋白质自身的性质(如稳定性)产生影响之外,还会对蛋白质与其它分子的相互作用产生影响,特别是与底物的结合。目前,对糖蛋白在这个方面的研究,了解的知识仍非常少。要想加深了解,需要对多种糖基化异形体和多种不同的底物的结合进行系统的研究和比较。CBM能够与多种不同的纤维素(cellulose)底物,例如结晶纤维素(bacterial microcrystalline cellulose,BMCC),Avicel®PH-101、清洁(CF)纤维素和磷酸溶胀纤维素(phosphoric acid swollen cellulose,PASC),以及多种不同的木质素(lignin)底物,又如清洁(CF)木质素和硫酸盐木质素(Kraft lignin)等的结合。在获得了大量的糖基化异形体后,CBM就成为了研究糖基化如何对底物结合力和选择性产生影响的模式分子。
使用之前开发的基于质谱的方法,谭组测试了每种CBM糖基化异形体与多种不同纤维素和木质素底物的结合力。研究结果清晰地表明,大部分糖基化能够提高CBM对纤维素的结合力(Kads),结合力提高的幅度有大有小。与此相反,大部分糖基化不能提高CBM对木质素的结合力,有些糖基化甚至能够大幅降低对木质素结合力。这些结果证明了糖基化具有改变蛋白质底物结合选择性的能力。
使用分子动力学模拟(molecular dynamics simulation),该组对糖基化的这种作用机制进行了探索。结果表明,不同糖基化位点之间存在协同运动,协同运动的结果是使多位点糖基化的CBM异形体能够更好地选择性结合纤维素的原因之一。利用计算出的Spearman相关系数,该组评估了运动相关性和结合力之间的关联度。结果发现,在所有的相关性中,最为重要的是Ser3和Ser14之间的运动相关性。这个运动相关性与CBM和纤维素的结合力正相关,与对木质素的结合力负相关[24]。
除了测定了糖基化模式对不同固体底物结合的不同外,利用合成的异形体,谭组还研究了糖基化对CBM与可溶性底物——纤维六糖,在结合力和结合机制上的不同。该组使用等温滴定量热法技术(isothermal titration calorimetry,ITC)获得了糖基化异形体与纤维六糖结合的热力学数据后发现,与和固体底物的结合不同,糖基化会使CBM和纤维六糖的结合力下降,下降的程度与糖基化位点以及糖的大小有关。更具体的分析结果表明,糖基化位点的增加和糖链的增大会使结合的焓变(ΔH)数值更负,说明糖会帮助增加CBM与底物之间形成的各种氢键;而糖基化位点的增加和糖链的增大也会使焓变(ΔS)数值更负,说明糖的引入会造成疏水作用的降低。氢键和疏水作用变化的总体结果最终决定了结合力的变化。
接下来,该组使用分子动力学模拟技术,对糖基化影响CBM与可溶性底物以及不溶性底物结合的差异从机制上进行了探索。探索的结果表明,CBM上的糖在与纤维六糖结合时,由于纤维六糖以一条单链的形式存在,糖基部分与底物的氢键相互作用和蛋白质部分与底物的疏水相互作用之间存在着直接竞争。如果糖与底物之间形成更多的氢键,则氨基酸与底物的疏水相互作用就会变弱,从而导致总体的结合力变弱。而当糖基化的CBM与不溶性的纤维素结合时,由于纤维素中含有无数条糖链,糖基部分与底物的氢键相互作用和蛋白质部分与底物的疏水相互作用之间在空间上不存在直接竞争。因此,CBM在糖与底物形成更多氢键的同时,利用底物的其它链形成近乎不变的疏水相互作用,从而使总体的结合力得到提升。
在对底物结合机制的探索研究中,谭组还发现了一个意想不到但又在情理之中的现象,那就是糖基化促进CBM从A形向B形的“进化”。A形CBM的主要结构特征是具有一个平坦的底物结合界面,该界面适应于结合固体纤维素的表面。B形CBM的主要结构特征则是具有一个表面凹槽,该凹槽能与可溶性底物的单个糖链相互作用。A形CBM主要通过熵驱动的过程实现与纤维素结合,而B形CBM则主要通过焓驱动的过程实现与可溶性底物结合。该组的研究表明,未糖基化的CBM具有明显的A形结构和结合特征,而糖基化的CBM则显示出B形分子特有的结构和结合特征。该发现证明了一个重要的科学推测,即糖基化很可能是推动蛋白质“进化”的一股力量。在这个力量的推动下,蛋白质不需要进行氨基酸序列的改变就能够实现结构和性能上的多样化,进而通过筛选,实现结构和性能上的优化[25]。
利用化学合成的灵活性,谭组还测定并探索研究了O-糖基化和S-糖基化的不同。在O-糖基化中,糖与Ser或Thr侧链的氧(O)原子相连。在S-糖基化中,糖则是与Cys侧链的硫(S)原子相连。由于O和S属于同族元素,长期以来,人们认为含O的糖苷键可以被对化学和酶更稳定的含S糖苷键所替代。然而,研究发现,O原子被S原子替代后,连接在蛋白质内糖的作用会发生明显的改变。核磁共振结构的比较和分析对含有O-连接糖和S-连接糖的CBM的不同进行了较好的解释。不同的糖苷键虽然不会带来CBM蛋白质骨架结构的较大变化,但是能够带来糖的运动自由度上的较大改变。分子动力学模拟分析表明,糖的运动自由度变化是由于糖与周围的氨基酸之间形成的氢键的差异所致。O-连接糖能够形成更多的氢键,因此,能够保持相对确定的构象,S-连接糖则由于难以形成氢键,从而以不确定的构象存在。通过计算分析,该组进一步解释了观察到的O-和S-糖基化对CBM与底物结合的不同影响。计算结果显示,这2种糖基化在底物结合中能够带来氢键和糖的运动自由度上不同程度的变化,因而能够导致不同的焓变和熵变数值结果。这些数值的加和,最终导致O-糖基化比S-糖基化表现出更好的底物结合力[26]。
总之,通过结合使用研究和计算方法系统地比较一系列CBM糖基化异形体与不同底物的结合,谭组探索出了蛋白质的O-糖基化对底物的结合产生的不同影响,以及产生不同影响的机制,提供了新的认识。探索的结果表明,氢键和位阻以及糖的运动可能是糖影响与底物之间相互作用的主要机制。由于底物的性质不同,在结合时,糖会产生不同的氢键。同时,由于糖的大小不同,在结合时,糖会对蛋白质原有的结合能力和结合方式产生不同程度的不利影响。另外,不同的糖或不同连接的糖,在与底物结合和未与底物结合时的运动自由度变化也会不同。蛋白质糖基化对结合力的总体影响的不同就是由上述这些不同的加和决定的。这一认识不但可以提高对糖基化在CBM与底物结合中的作用和作用机制的理解,也帮助提高对糖基化在其它蛋白质与底物中可能发挥作用的预测水平。
4 固有无序连接区的O-糖基化
在2018年,谭组使用类似的分子库策略对真菌二糖水解酶中的另一个特征区域,固有无序连接区(intrinsically disordered linker regions, IDRs)O-糖基化(α-O-Man)的作用以及可能的作用机制进行了探索研究。IDR是一类特殊的结构,它们不含固有的二级结构,非常柔性,因此很容易被蛋白酶所水解。O-糖基化是保护IDR免受蛋白酶切割的重要方式。早先的研究发现,真菌和酵母菌中大多数分泌到细胞外的蛋白质含有的IDR都是O-甘露糖基化的,但是为什么这种特定的O-糖基化被它们选用并不清楚。为了回答这一问题,该组使用化学合成的方法,制备了3种分别带有不同单糖(α-O-Man,α-O-Gal和α-O-Glc)的IDR分子(Fig.4)。通过比较分析它们在嗜热蛋白酶中的稳定性,结果发现,甘露糖基化的IDR的半衰期是未糖基化分子的112倍,是半乳糖基化分子的16倍,葡萄糖基化分子的3倍。这一研究结果说明,甘露糖基化很可能是真菌和酵母菌等在进化中优选的糖基化方式,选择的原因之一很可能是由于这种糖基化能够更好地提高它们分泌蛋白质中IDR的酶解稳定性。
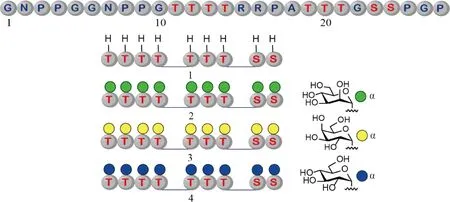
Fig.4 Structures of the synthetic glycoforms of an intrinsically disordered linker with nine glycosylation sites The glycosylation sites are distributed across three regions: Thr11-Thr14, Thr19-Thr21, and Ser23-Ser24 (Top). Four distinct glycoforms with their glycan structures shown at the bottom right were chemically synthesized and studied to elucidate the role of glycosylation
为了找到是什么原因导致了甘露糖更好的稳定性,该组通过计算模拟进行了研究。糖基化增加稳定性的原因,一般认为是由于糖分子产生的空间位阻限制蛋白酶对切割位点的接近。然而,比较计算获得这几个分子的溶剂可及表面积却发现,它们的溶剂可及表面积非常接近,说明存在其他的原因。根据酶催化的水解反应机制,推测这个原因是甘露糖基化能够提高IDR的结构刚性,从而使其难以形成肽键断裂所需要的过渡态。计算的结果与这个假设非常接近。简而言之,计算比较的结果表明,甘露糖中采取直立取向的2-OH影响了其形成分子内氢键的数目,进而导致甘露糖的糖平面主要以和肽骨架平行的方式存在。这种在多个位点上与肽骨架平行的糖平面严重地限制了IDP肽链的扭曲自由度,大幅增强了其伸展的长度和刚性,进而使其水解速度变得较慢。与甘露糖相比,半乳糖和葡萄糖的糖平面与IDR骨架更接近于垂直,肽链扭曲自由度大,因此,对蛋白酶水解的抑制力相对较低。在模拟中,该组还比较了带有更大糖分子的IDR的稳定性。结果说明,与肽相连的第1个糖的结构是决定稳定性中的主要力量。此外,在模拟结果的基础上,还推断出了甘露糖基化另一个可能的重要作用,那就是:作为连接分泌蛋白质中不同功能域的连接区,甘露糖基化的IDR由于延伸得更长,可能为这些功能域提供更佳的距离[27]。
5 趋化因子配体5的O-糖基化
在2018年,谭组使用类似的分子库策略对人趋化因子配体5(C-C motif chemokine ligand 5,CCL5)的O-糖基化(α-O-GalNAc)作用进行了研究。研究的主要目的是确定糖基化是否能用于将CCL5开发成用于艾滋病治疗的药物。CCL5能够通过与它的受体CCR5的结合,促进CCR5的内吞作用,同时竞争性抑制艾滋病毒HIV-1利用CCR5对免疫细胞的侵袭,从而抑制HIV-1感染(Fig.5A)。然而,CCL5其它的生物学性能,例如自聚与糖胺聚糖(glycosaminoglycan, GAG)和受体结合等引起的免疫细胞迁移,可以导致严重的炎症副作用,限制了它在艾滋病治疗方向上的应用。为了探索是否可以利用糖基化等翻译后修饰降低CCL5与炎症相关的性能,该组使用化学合成的方法,制备了15个具有不同糖基化模式的异形体。通过对这些分子性能的系统比较和分析,研究结果发现,在Ser4和Ser5位点上连上α-O-GalNAc (Fig.5B),可以降低CCL5的聚集性质以及和糖胺聚糖(GAG)结合的能力,进而能够从总体上降低CCL5趋化免疫细胞定向移动的能力。糖基化的这些抑制作用,有些与糖基化的位点和糖的大小有关。当与糖的大小有关时,二糖的抑制效果大于单糖的效果。通过研究测定发现,糖基化也能降低CCL5抑制HIV-1感染的能力,这可能是由于糖基化降低了CCL5与CCR5的结合力[28]。这项工作证明,糖基化可以作为一种有效的方法用于调控蛋白质分子的副作用,但是需要找到一个可行的策略,使得在副作用降低的同时,不降低其治疗作用。
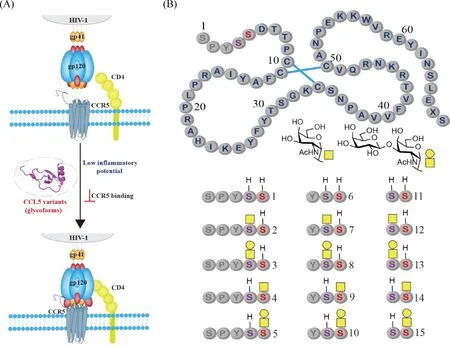
Fig.5 O-Glycosylation of CCL5 (A) Schematic representation of the potential role of O-glycosylation in regulating CCL5 function. (B) Structures of 15 CCL5 glycoforms with systematically varied N-terminal truncation and glycosylation patterns. The three truncatable N-terminal aminoacids are in gray. X represents norleucine
6 胰岛素的O-糖基化改造
在2018年,谭组使用类似的分子库策略对人胰岛素(insulin)进行了O-糖基化(包括α-O-GalNAc和α-O-Man)改造的研究。研究的目的是利用已有对O-糖基化作用的认识对胰岛素分子进行改造,使其具有口服药物分子的性能。由于频繁的注射给药会给糖尿病患者带来较多不适和不便,许多患者希望胰岛素分子能够以口服方式给药。然而,由于体积小、相对易吸收的胰岛素单体较容易在小肠内被蛋白酶水解。在这些因素的困扰下,导致口服胰岛素的开发一直困难重重。为了降低口服胰岛素的开发难度,该组在先前研究结论的基础上推测,如果在人胰岛素B链Thr27位连上O-连接的糖,有可能实现在维持胰岛素单体存在状态的同时,提高胰岛素在小肠内的存活时间,从而提高口服胰岛素的活性。
通过化学合成,课题组首次制备了带有天然糖苷键和糖结构的13个人胰岛素糖基化异形体。通过对这些异形体性质和功能的系统比较发现,在B链Thr27上连有O-连接的三甘露糖的分子(Fig.6),除了能够改善胰岛素的生物功能之外,还能够大幅降低它的自聚倾向,使它较好地保持单体的状态,同时提高它对小肠内存在的蛋白酶的抵抗力[29]。该研究进一步说明,通过筛选糖的结构和大小,可以找到更好地改善药用分子性能的糖基化模式。

Fig.6 Structures of the synthetic glycoforms of human insulin It was monoglycosylated using three Ser residues and two Thr residues (Top). The glycosylation pattern of each glycoform is illustrated at the bottom left, and the structures of the glycans are presented at the bottom right. Disulfide bonds are denoted by the blue line
7 α-突触核蛋白O-糖基化的作用
在2019年,Matthew Pratt课题组(Pratt组)使用分子库策略研究了β-O-GlcNAc糖基化对α-突触核蛋白(α-Synuclein)的聚集和毒性作用的影响。α-突触核蛋白的病理性聚集与累积是帕金森病(Parkinson’s disease,PD)的一个重要特征。前期的研究表明,该蛋白质可能在9个不同的位点上带有β-O-GlcNAc糖基化。根据以前的结论,Pratt组推测,这些糖基化也许能够改变其聚集特性。为了验证这一假设,该组使用化学合成和生物表达相结合的半化学合成方法,制备了6种α-突触核蛋白的糖基化异形体,其中4种只占有1个糖基化位点,另1种占有3个糖基化位点(Fig.7)。通过比较分析各种生化研究获得的结果发现,β-O-GlcNAc可以抑制α-突触核蛋白聚集的成核步骤,并改变形成的聚集物的结构。另外,在共聚集实验中还发现,占有3个糖基化位点的蛋白质可以抑制未糖基化的α-突触核蛋白的聚集。更为重要的是,细胞培养研究的结果显示,β-O-GlcNAc可能具有抑制α-突触核蛋白在聚集中产生神经毒性的能力[30]。这些有毒性的聚集物被认为可能是帕金森病发病的罪魁祸首之一。为了研究β-O-GlcNAc是否在抑制α-突触核蛋白聚集时存在独特之处,Pratt组在2021年使用类似的方法,比较了Thr72位上β-O-GlcNAc与同一位点上连接的β-O-Glc、β-O-GalNAc和α-O-Man的差异(Fig.7)。研究结果表明,天然选择的β-O-GlcNAc具有最强的聚集抑制作用,β-O-Glc的抑制作用最弱,而β-O-GalNAc和α-O-Man的抑制作用处于中等水平[31]。上述发现说明,β-O-GlcNAc是生物体用来防止蛋白质聚集的一种策略。α-突触核蛋白对β-O-GlcNAc的选择是进化的结果。对这种策略的进一步研究,可能会更好地促进神经退行性疾病的诊断与治疗。
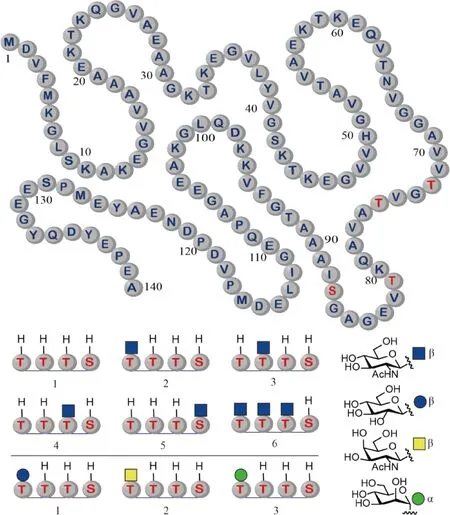
Fig.7 Structures of the synthetic glycoforms of α-synuclein Glycosylation occurs at four different sites: Thr72, Thr75, Thr81, and Ser87 (Top). In the synthetic glycoforms, the glycosylation sites are variably occupied by four different monosaccharides (Bottom)
8 小热休克蛋白的O-糖基化与蛋白质聚集
在2021年,Pratt组使用半合成策略,建立了小热休克蛋白(small heat shock protein,sHSPs)的糖基化异形体的分子库,这些分子同样带有β-O-GlcNAc修饰(Fig.8B)。作为分子伴侣,sHSPs通过结合未折叠和/或错误折叠的蛋白质防止其发生聚集(Fig.8A)。该组研究了3个小热休克蛋白质,1个是带有4个β-O-GlcNAc糖基化位点的HSP27,另1个带有1个糖基化位点的αAC,还有1个带有2个糖基化位点的αBC。初步的比较分析结果表明,所有位点上的β-O-GlcNAc都有增强小热休克蛋白抑制α-突触核蛋白聚集的能力。对3个小热休克蛋白质的保守糖基化位点的进一步研究表明,在这些位点上的β-O-GlcNAc糖基化均能增强它们对β淀粉样肽Aβ42聚集的抑制能力[32]。上述结果证明了Pratt组的假设,即β-O-GlcNAc连接在蛋白质上除了直接抑制其聚集外,还能以增强小热休克蛋白活性的间接方式实现抑制蛋白质聚集。

Fig.8 O-Glycosylation of Heat Shock Proteins (HSPs) (A) Schematic representation of the function of HSPs to block aggregation. (B) Structures of the synthetic glycoforms of HSP27, αAC, and αBC
9 趋化因子配体14的O-糖基化
在2021年,Payne组使用分子库策略,对人趋化因子配体14 (CCL14)的O-糖基化(α-O-GalNAc)作用进行了研究。研究的目的是确定糖基化是否能够调节CCL14的活性。该组使用化学合成的方法制备了5种CCL14(1~74)的糖基化异形体(Fig.9)。通过对这些分子的表征和比较分析,研究发现,CCL14(1~74)的糖基化不影响其与CCR1受体的结合和后续信号的传导,但是能够提高其在人纤溶酶中的稳定性[33]。上述发现说明,糖基化是通过调节CCL14(1~74)的酶解稳定性来实现调控其作为趋化因子功能的。
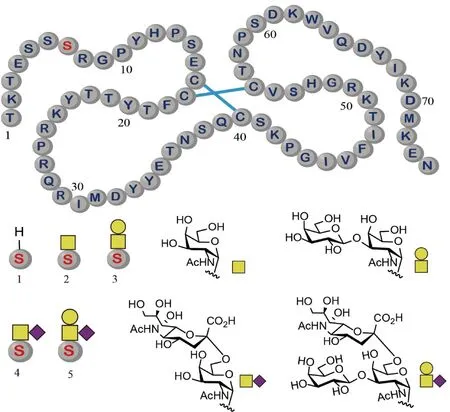
Fig.9 Structures of the synthetic glycoforms of CCL14 CCL14 contains one glycosylation site at Ser7 (Top). The glycoforms exhibit four different glycans at this site (Bottom). Disulfide bonds are denoted by the blue line
10 β淀粉样肽的O-糖基化与其聚集的关系
在2021年,董甦伟课题组(董组)使用分子库策略对β淀粉样肽(Amyloid-beta,Aβ42)中不常见的1个O-糖基化,酪氨酸(tyrosine,Tyr )糖基化(α-O-GalNAc)的作用进行了研究。Aβ42在大脑中的聚集和累积是阿尔茨海默病(AD)患者的一个重要特征。为了研究Tyr10上连接的O-糖是否在Aβ42的聚集/酶降解中发挥抑制作用,该组利用化学合成的方法,制备并比较分析了4个糖基化异形体的不同(Fig.10)。研究的结果表明,糖基化,特别是含有唾液酸的三糖,能够抑制Aβ42的聚集和纤维化。使用冷冻电镜结构技术,该组从分子水平上证明,糖基化可以使Aβ42形成一种新的纤维结构,这种结构具有不太稳定的丝状界面,因此,更容易被酶降解[34]。这项研究说明,糖基化可以作为一种有效的策略,抑制Aβ42的病理性聚集。

Fig.10 O-Glycosylation of Aβ42 The study focuses on the glycosylation of Tyr10 (Top). Three different glycans were incorporated at this site to generate the glycoforms (Bottom)
11 白细胞介素-2的O-糖基化与其活性的作用
在2022年,王平课题组(王组)使用分子库策略研究了白细胞介素-2 (interleukin-2,IL-2)中(α-O-GalNAc)糖基化的作用。IL-2作为一种重要的白细胞介素,通过对T细胞的调控来调节免疫应答。IL-2虽然作为最早的肿瘤免疫疗法药物之一已经上市约30年,时至今日,它仍因为疗效及不良反应等问题在临床使用上存在较大限制。该组研究的目的,是通过了解IL-2糖基化的构效关系,为开发IL-2的高效药物寻找新的方向。该组使用化学合成和生物表达相结合的方法,合成了3种IL-2的糖基化异形体(Fig.11)。对这些分子的表征和比较表明,IL-2的糖基化能够改变其在T细胞分化过程中的活性;含有唾液酸三糖的存在,能将IL-2的活性从上调常规T细胞(conventional T cell,Tcon)的增殖变成下调其增殖[35]。该组的研究为糖基化在调控IL-2性能中的作用提供了初步证据,揭示了IL-2糖基化在今后药物研发中可能的重要意义。
12 问题与展望
随着组成均一、结构确定的高纯度的蛋白质糖基化异形体制备技术的进步,世界上越来越多的课题组开始探索使用基于异形体分子库的策略来研究蛋白质O-糖基化的作用和作用机制。这些处于研究早期的初步结果,为我们提供了一些可以用来了解和利用O-糖基化的信息。过去10多年的研究表明,O-糖基化根据其位置、结构、大小和所连接蛋白质的不同,可以对蛋白质的不同性质产生不同方向(正向和反向)和不同程度的影响,具体的影响来自于以上多种因素的平衡。这其中一个简单而粗略,同时也可能不完全正确的规律是:(1)位于蛋白质酶解位点/易聚集位点附近的糖基化,一般能提高蛋白质的酶解稳定性/降低蛋白质的聚集倾向,而且一般糖越大这些性质的改善程度越高;(2)位于蛋白质底物结合位点/生物活性位点附近的糖基化,一般会降低蛋白质与底物的结合力或蛋白质的生物活性,而且一般糖越大这些性能降低的幅度越大;(3)蛋白质不同的糖基化位点之间一般会存在协同作用,可以共同改变蛋白质的性能。这个简单而粗略的规律虽然可以用来对非糖基化的蛋白质进行改造,但它的使用带来的成功的例子仍较少。
导致目前获得的糖基化的作用规律存在简单而粗略问题的主要原因,还是由于研究进行得仍然很不透彻,研究结果存在很大的初级性。尽管基于分子库的方法已经被证明是一个非常可靠的研究方法,但是这个研究方法在实际使用时仍然存在较多限制。第一个限制就是分子库合成的困难性。由于跟糖相关的合成技术,无论是化学合成还是生物合成,都存在高度的复杂性,目前,只有少数科研人员能够熟练掌握。由于这一特点,使得分子库在制备时,耗时又耗钱,难以成为流行的研究方向;即使有科研人员不畏困难,愿意进行这一方向上的探索,通常会由于难以获得研究所必须的分子数和分子结构而难以达到研究的最终目的。第二个限制就是深入研究的困难性。蛋白质糖基化的研究是一个全新的、覆盖面很广的研究领域。分子库的制备和简单的生化测试、比较分析只是研究的冰山一角。要想真正了解糖基化全面的作用和作用机制,仍需要更多该领域的专业人员,包括熟悉生物、计算、结构分析等方面的人员对同一个分子库的分子进行深入的研究;同时,不但需要研究目前可以获得的带有相对较小、较少糖的小糖蛋白质,还要研究大量带有更多、更大糖分子的较大的糖蛋白质。这类研究的实现,仍需要长时间的技术和人才积累。
要想完全解决这些分子库策略中存在的问题,获得准确而细致的糖基化作用规律,实现可预知结果的蛋白质糖基化改造,还有很长的路要走。可喜的是世界各国已经开始认识到了蛋白质糖基化的重要性。随着越来越多的科研基金的投入,我们在糖蛋白合成方面的能力将会变得越来越强,能够掌握这项技术的科研人员也会越来越多,糖生物学的研究也会变得越来越流行。这些进步可能会使基于分子库的研究方法能够和其它一些生物学方法,如基于基因重组的表达方法助力蛋白质的研究一样,更好地助力蛋白糖基化研究,实现对糖基化作用机制更好的了解和在蛋白质功能改造方面更好的应用。

