颅脑创伤患者早期血清PDCD4 GDF11水平及其与病情和预后的关系
刘进 张雷
颅脑创伤具有较高的死亡率和致残率[1]。颅脑创伤后患者血脑屏障受损,脑实质暴露,导致脑组织损伤、神经功能障碍、脑水肿等多种病理变化,对患者病情及预后极为不利[2]。目前临床上主要采取影像学手段[3-4]、格拉斯哥昏迷指数(Glasgow coma scale,GCS)[5]、格拉斯哥预后评分(Glasgow outcome score,GOS)[6]等衡量患者病情及预测预后情况,但容易受到医生主观因素及患者状态的影响[7],准确度并不理想。因此,寻找能够准确预测患者病情及预后的生物学指标对于临床判断患者病情,预测预后情况具有重大现实意义。程序性细胞死亡因子4(programmed cell death4,PDCD4)是一种肿瘤抑制因子,参与各种细胞过程[8]。生长分化因子11(growth differentiation factor 11 ,GDF11)是转化生长因子-β超家族的成员,能够改善神经退行和神经血管疾病[9]。本研究通过检测颅脑创伤患者血清PDCD4、GDF11水平,以探讨两者与患者病情及预后的关系,旨在为PDCD4、GDF11作为颅脑创伤的预后生物标志物提供参考。
1 资料与方法
1.1 一般资料 选取2020年1月至2022年4月成飞医院收治的112例颅脑创伤患者为研究对象(研究组),其中男性65例,女性47例,年龄32~58岁,根据GCS评分[5]将研究组患者分为轻度组(48例,13≤GCS评分≤14分),中度组(36例,9≤GCS评分≤12分),重度组(28例,3≤GCS评分≤8分)。使用GOS评分[6]评估患者预后,将患者分为预后不良组(42例,1~3分),预后良好组(70例,4~5分)。另选取同时期在成飞医院进行健康体检的志愿者110例为对照(对照组),男性58例,女性52例,研究组与对照组性别、年龄、BMI比较差异无统计学意义(P>0.05),具有可比性,见表1。所有受试者签署书面知情同意书。本研究经成飞医院伦理委员会批准(审批号:20190226)。
表1 研究组与对照组血清PDCD4、GDF11水平比较()
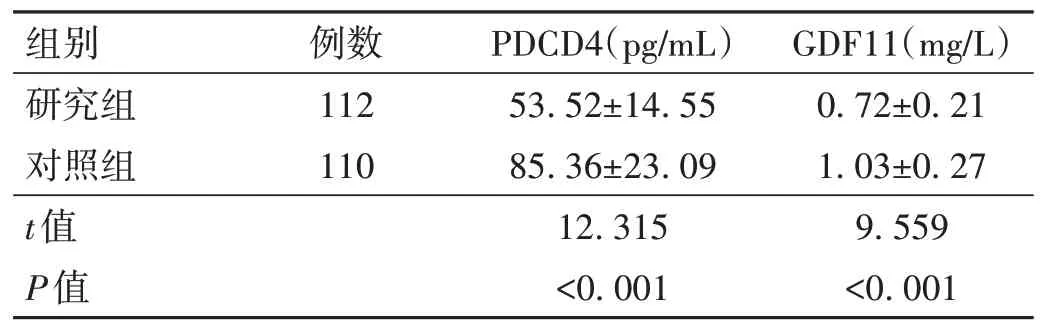
表1 研究组与对照组血清PDCD4、GDF11水平比较()
注:PDCD4为程序性细胞死亡因子4;GDF11为生长分化因子11。
GDF11(mg/L)组别例数PDCD4(pg/mL)0.72±0.21 1.03±0.27 9.559<0.001研究组对照组t值P值112 110 53.52±14.55 85.36±23.09 12.315<0.001

表1 两组研究对象一般资料比较
1.2 纳入与排除标准 纳入标准:①符合《成人颅脑损伤治疗指南》[10]中有关诊断标准;②所有患者颅脑创伤病因明确;③均于创伤发生后12 h以内入院接受治疗;④经头颅CT证实确为颅脑创伤;⑤首次发生颅脑创伤;⑥同意接受随访。排除标准:①创伤前合并脑部疾病患者;②伴有颅脑手术史患者;③妊娠期患者;④中途转院、自动放弃治疗患者;⑤恶性肿瘤患者;⑥严重的心肝肾器官病变患者;⑦颅脑创伤前合并认知异常患者;⑧有其他部位严重创伤患者;⑨失血性休克的患者;⑩术后颅内感染的患者。
1.3 方法
1.3.1 一般资料收集 患者入院后,收集患者基本资料,包括性别、年龄、BMI、高血压、糖尿病、高血脂、入院体温、心率、收缩压、舒张压、平均动脉压、并发症情况(蛛网膜下腔出血、脑积水、硬膜外出血、硬膜下血肿、癫痫、脑疝)、是否有手术治疗史以及入院时GCS评分。
1.3.2 生化指标检测 通过全自动生化分析仪(型号: URIT-8401,购自桂林优利特医疗电子有限公司)检测入院患者乳酸、血红蛋白、血尿酸、白蛋白水平;酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法检测所有受试者血清中枢神经特异性蛋白(S100β)和神经元特异性烯醇化酶(NSE)水平(试剂盒货号:E-EL-H1297c和E-EL-H1047c,均购自武汉伊莱瑞特生物科技股份有限公司)。
1.3.3 颅内压检测 无创颅脑监测仪(海威廉,型号NIP-200W),持续监测至患者颅内压稳定。监测方式:患者保持平躺,双眼闭合并覆盖眼罩,使用医用乙醇对贴片及皮肤消毒,电极贴在枕骨粗隆上3 cm,左右两侧各1个电极,前额正中发际处贴上参考电极,眉间位置贴上接地电极,电极间阻抗不超过20 KΩ,记录入院12 h内患者颅内压值,每隔1 h记录一次,连续记录12次,取平均颅内压值。
1.3.4 血清PDCD4、GDF11水平检测 研究组患者入院时(对照组为体检当日)采集肘部静脉血5 mL,4℃离心机中3 000 r/min离心15 min,分离出血清置-80℃冰箱保存待测。ELISA法检测所有受试者血清PDCD4(试剂盒货号:EH2218,购自武汉菲恩生物科技有限公司)、GDF11(试剂盒货号:69-45251,购自默沙克生物科技有限公司)水平。严格按照ELISA试剂盒说明书进行操作。
1.3.5 随访 患者受伤入院后3个月内每2周观测1次患者预后情况,在医院住院和按约到医院复诊的直接进行了评估并有随访记录,不能到医院的进行电话随访,记录随访患者GOS评分以评估患者预后情况。
1.4 统计学方法 利用SPSS 25.0软件分析数据。符合正态分布的计量资料以表示,组间比较采用独立样本t检验;多组比较行单因素方差分析,进一步两两比较行SNK-q检验;不符合正态分布的计量资料以M(P25,P75)表示,两独立样本比较行Mann-WhitneyU检验,3个独立样本比较行Kruskal-WallisH检验;计数资料以百分比表示,组间比较采用χ2检验;Pearson相关性分析研究组血清PDCD4水平与GDF11水平的相关性,Spearman相关性分析研究组患者血清PDCD4、GDF11水平与GCS、GOS评分的相关性;多元线性回归检验血清PDCD4和GDF11水平以及二者分别与GCS的共线性,自变量间容忍度均大于0.1,且方差膨胀因子(variance inflation factor,VIF)小于5表示二者无共线性。多因素logistic回归分析颅脑创伤患者预后的影响因素;受试者工作特征(receiver operating characteristic,ROC)曲线评价血清PDCD4、GDF11对颅脑创伤患者预后的预测价值,PDCD4、GDF11联合预测与两者单独预测ROC曲线下面积(area under the cure,AUC)的比较采用Z检验。以P<0.05为差异有统计学意义。
2 结果
2.1 研究组与对照组血清PDCD4、GDF11水平比较研究组血清PDCD4、GDF11水平均低于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 不同病情颅脑创伤患者血清PDCD4、GDF11水平比较 重度组患者血清PDCD4、GDF11水平均低于轻度组和中度组,差异有统计学意义(P<0.05),中度组患者血清PDCD4、GDF11水平均低于轻度组,差异有统计学意义(P<0.05)。见表2。
表2 不同病情患者血清PDCD4、GDF11水平比较()

表2 不同病情患者血清PDCD4、GDF11水平比较()
注:PDCD4为程序性细胞死亡因子4;GDF11为生长分化因子11;与轻度组比较,①P<0.05;与中度组比较,②P<0.05。
GDF11(mg/L)0.88(0.70,1.02)0.71(0.58,0.86)①0.51(0.38,0.65)①②27.960<0.001组别轻度组中度组重度组F/H值P值例数48 36 28 PDCD4(pg/mL)64.70±12.89 52.13±11.10①36.15±9.81①②53.750<0.001
2.3 不同预后颅脑创伤患者临床资料及血清PDCD4、GDF11水平比较 两组性别、年龄、BMI、高血压、糖尿病、高血脂、心率、平均动脉压、硬膜外出血、硬膜下血肿、癫痫、手术治疗例数、入院体温、血红蛋白、血尿酸比较差异无统计学意义(P>0.05);预后不良组脑疝比例、脑积水比例比例、入院后12 h内颅内压、乳酸、S100β、NSE均高于预后良好组(P<0.05),清蛋白、GCS评分、GOS评分以及血清PDCD4、GDF11水平均低于预后良好组(P<0.05)。见表3。
2.4 研究组血清PDCD4、GDF11水平的相关性及两者与GCS、GOS评分的相关性 研究组血清PDCD4水平与GDF11水平呈正相关(r=0.500,P<0.001);Spearman相关性分析显示,血清PDCD4水平与GCS、GOS评分均呈正相关(r=0.672,0.519,P<0.001),血清GDF11水平与GCS、GOS评分均呈正相关(r=0.636,0.505,P<0.001)。
2.5 颅脑创伤患者预后的多因素logistic回归分析根据结果“2.4”可知血清PDCD4和GDF11水平以及二者分别与GCS存在相关性,进一步通过多元线性回归验证后,血清PDCD4和GDF11水平以及二者分别与GCS均不存在共线性(自变量间容忍度=0.491,VIF=2.125)。因此以预后情况(预后良好=0,预后不良=1)为因变量,以是否并发脑疝(是=1,否=0)、是否并发脑积水(是=1,否=0)、入院后12 h内颅内压(实测值)、乳酸(实测值)、清蛋白(实测值)、GCS评分(实测值)、S100β(实测值)、NSE(实测值)、PDCD4(实测值)、GDF11(实测值)水平为自变量进行多因素logistic回归分析,结果显示,脑疝影响是颅脑创伤预后的危险因素,GCS评分、PDCD4、GDF11是影响颅脑创伤预后的保护因素(P<0.05)。见表4。

表4 颅脑创伤患者预后的多因素logistic回归分析
2.6 血清PDCD4、GDF11对颅脑创伤患者预后的预测价值 以血清PDCD4、GDF11和Logistic回归模型公式计算两指标联合预测患者预后概率值为检验变量,以颅脑创伤患者预后情况为状态变量(预后不良=1,预后良好=0)绘制ROC曲线,ROC曲线分析显示,血清PDCD4单独预测颅脑创伤患者预后的AUC为0.894(95%CI:0.837~0.951),灵敏度72.9%、特异度92.9%,截断值为55.23 pg/mL;GDF11单独预测颅脑创伤患者预后的AUC为0.840(95%CI:0.765~0.914),灵敏度77.1%,特异度88.1%,截断值为0.70 mg/L;两者联合预测的AUC为0.961(95%CI:0.928~0.994),灵敏度92.9%、特异度81.4%,两者联合预测的AUC大于PDCD4单独预测的AUC(Z=1.993,P=0.046)及GDF11单独预测的AUC(Z=2.907,P=0.004)。见图1。
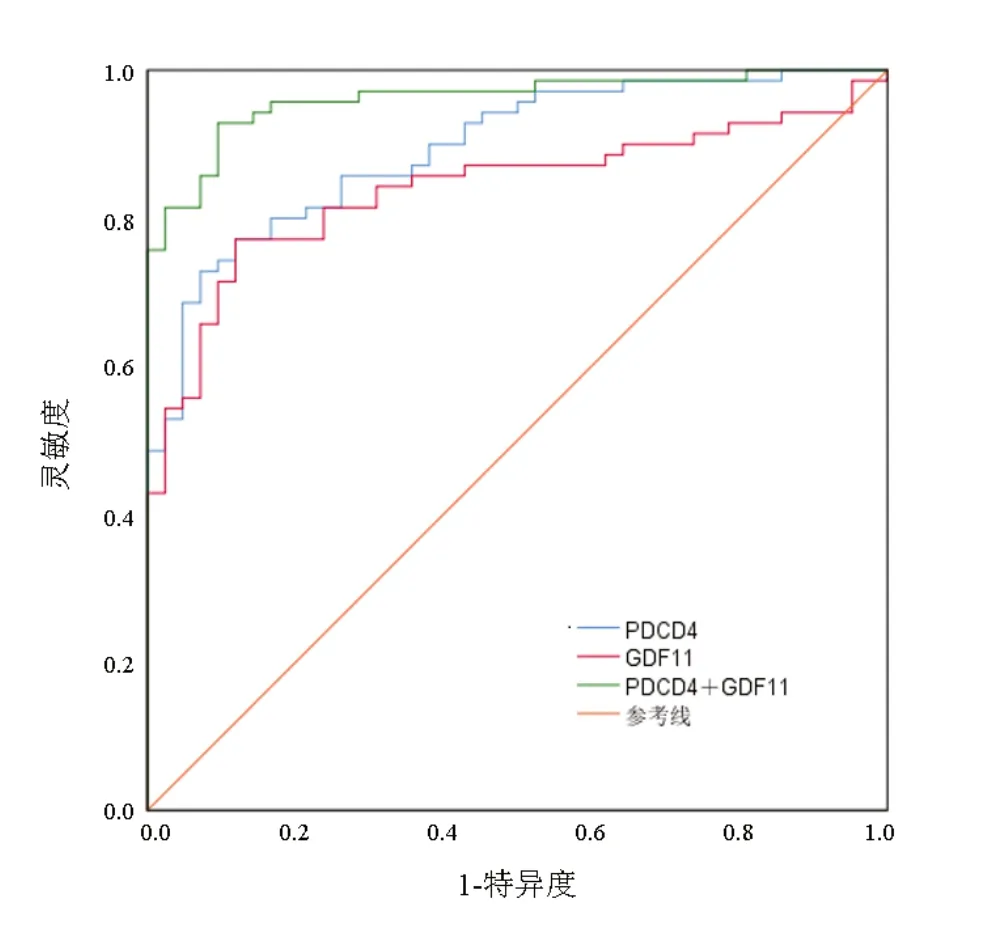
图1 血清PDCD4、GDF11预测颅脑损伤患者预后的ROC曲线
3 讨论
颅脑创伤多由高空坠落、交通事故、钝器等直接或间接作用脑部造成,患者伤后会出现不同程度的昏迷。多数患者颅脑创伤后会出现多种病理变化,患者神经系统受损的同时会导致全身多个器官功能受损[11-12]。我国颅脑创伤患者死亡率高达0.13%[13]。寻找能够准确判断患者病情及预后的生物标志物对于颅脑创伤的治疗具有重要意义。GCS评分被认为是创伤性脑损伤患者意识状态的金标准。有学者认为在复苏后生命体征平稳状态下的GCS评分用于预后判断准确性更高[14]。孙国章等[15]发现首诊GCS评分是创伤性颅脑损伤患者不良预后的影响因素。本研究结果显示,预后不良组患者GCS评分较低,且回归分析发现GCS评分越低,患者预后越差,与以往研究一致[15]。
PDCD4已被证实在乳腺癌[16]、慢性淋巴细胞白血病[17]、结肠癌[18]等多种恶性肿瘤中表达下调,增加其表达具有肿瘤抑制作用。Zhou等[19]研究发现,PDCD4在心肌梗死大鼠模型中表达降低。Redell等[20]通过对创伤性脑损伤大鼠模型进行研究发现,PDCD4在脑损伤后的海马区表达降低。本研究中,研究组血清PDCD4水平低于对照组,提示PDCD4的表达可能与颅脑创伤的发生有关。PDCD4是miR-21的直接靶标,接受miR-21的负向调控,miR-21已被证实在颅脑创伤海马区及细胞外囊泡中表达上调[20-21],这可能是PDCD4在颅脑创伤中的作用机制之一。研究证实,GDF11在脑缺血再灌注小鼠模型中表达下调[22]。而在另一项研究中发现,GDF11能够通过减轻线粒体动力学异常及功能障碍进而减轻脑出血后的继发性脑损伤[23]。本研究中,研究组血清GDF11水平低于对照组,可能与颅脑创伤后线粒体功能受损有关[24]。Chen等[22]研究发现,miR-125b-5p/GDF11信号通路受circUCK2的调控参与脑缺血再灌注损伤中的细胞凋亡,GDF11在颅脑创伤中的具体作用机制可能与circUCK2/miR-125b-5p/GDF11信号通路有关,需进一步研究证实。
本研究还发现,重度组患者血清PDCD4、GDF11水平均低于轻度组和中度组,且中度组水平低于轻度组,同时相关性分析显示,患者血清PDCD4水平与GDF11水平呈正相关且两者水平与GCS评分均呈正相关,提示两者共同参与颅脑创伤的病情进展过程。随访3个月后依据GOS评分对患者进行分组,结果发现,预后不良组血清PDCD4、GDF11水平均低于预后良好组,相关性分析显示,两者水平与GOS评分均呈正相关,同时多因素logistic回归分析表明,PDCD4、GDF11是影响颅脑创伤患者预后的保护因素,提示血清PDCD4、GDF11水平越低,越可能出现不良预后。进一步的ROC曲线表明,PDCD4、GDF11联合对于颅脑创伤患者预后具有更高的预测价值。为临床评估患者预后提供了参考。颅脑创伤患者病情变化快,其预后受到多种因素的影响,临床医师可根据患者血清PDCD4、GDF11水平,结合影像学手段、GCS评分等对患者病情严重程度做出判断,对可能出现的预后情况做出推测,并对出现脑疝并发症的患者给予关注,及时采取有效的治疗措施和干预措施。
综上所述,颅脑创伤患者血清PDCD4、GDF11水平降低,两者与患者病情及预后关系密切,两者联合对患者预后具有较高的预测价值,可作为颅脑创伤的生物标志物。本研究不足之处:①所纳入样本数量较小,由于个体差异的存在,所检测出的实验数据可能会存在一定的偏颇;②仅以患者入院时血清样品进行研究,没有动态演变;③未结合细胞实验、动物实验,从信号传导通路等方面深入探究PDCD4、GDF11在颅脑创伤中的具体作用机制。针对上述局限性,后期将扩大样本量,收集多个时间点PDCD4、GDF11水平变化,并结合基础实验明确二者在颅脑创伤中具体作用。

