TLR4/NF-κB p65高表达对皮肤鳞状细胞癌增殖、侵袭和转移的影响
刘 莉
(宁夏医科大学总医院肿瘤研究所,宁夏 银川,750001)
皮肤鳞状细胞癌简称皮肤鳞癌,属于恶性肿瘤,在国内外均较为常见。该疾病来源于皮肤的鳞状上皮组织,属于非黑色素瘤皮肤癌[1-2]。近些年,由于环境污染与人口老龄化的原因,皮肤癌的发病率也随之升高,有研究显示,在我国皮肤恶性肿瘤中,皮肤鳞状细胞癌的比例占到80.0%,且发病率仍在上升,对人类生命安全造成严重的威胁[3]。皮肤鳞癌的病因至今仍未明确,可能与紫外照射损伤、人乳头瘤病毒、免疫抑制、砷角化病、放射性皮炎、黏膜白斑、瘢痕和白化病等有关[4-5]。皮肤鳞癌的发生仅次于基底细胞癌,占非黑色素瘤皮肤癌的20%。与基底细胞癌不同,皮肤鳞癌具有高度的侵袭能力,因此容易发生转移和复发[6]。早期的皮肤鳞癌可以通过手术切除,但是对发生转移的皮肤鳞癌患者的长期预后效果很差,1年的生存率为50%,5年的生存率仅有5%,而对于复发的患者,5年的生存率也不到10%[7]。核因子KappaB(NF-κB)存在于人体内,属于重要的转录因子,在抑制肿瘤细胞增殖、促进细胞凋亡中发挥作用,NF-κBp65是常见的NF-κB类型[8]。近年来研究证明,在皮肤鳞状细胞癌中,NF-KBp65蛋白呈现出低表达状态,而且当病情加重时,其表达水平也随之降低[9]。Toll样受体4(Toll-like recepTor 4,TLR4)不仅可以识别胞外抗原,对胞内损伤相关因子也起到应答作用,进而促使细胞分泌炎性因子和干扰素[10]。本研究具体探讨与分析了TLR4/NF-κB p65高表达对皮肤鳞状细胞癌增殖、侵袭和转移的影响,以明确TLR4/NF-κB p65的作用机制,现报道如下。
1 材料与方法
1.1 材料来源
研究时间为2020年2月—2023年2月,自武汉普诺赛生命科技有限公司购买人皮肤鳞状细胞癌A431细胞株,细胞培养于含10.0%胎牛血清(生产企业:杭州四季青生物公司)、100 U/ml青霉素(生产企业:上海生物工程有限公司)、0.1 mg/ml链霉素(生产企业:上海生物工程有限公司)的DMEM低糖液体培养液(生产企业:美国InviTrogene公司)中,超表达载体-pc3.0-TLR4NF-κB p65与空载体pc3.0由本实验室保存,LipofecTamine 2 000购自美国InviTrogene公司。Transwell小室、MTT试剂盒、AnnexinV-FITC试剂盒都购自碧云天公司,抗Caspase-9蛋白、抗Myc蛋白购自美国InviTrogene公司。
1.2 细胞转染
A431细胞在37 ℃、5%CO2条件下培养,实验时取对数生长期细胞。空白组不进行转染,加入等量的DMEM培养基;对照组的转染物质为pc3.0空载体,实验组的转染物质为pc3.0-TLR4NF-κB p65载体。
1.3 TLR4/NF-κB p65 RNA表达检测
细胞转染后24 h、48 h,收获细胞,并提取总RNA(方法为:Trizol法),使用qRT-PCR方法检测mTLR4/NF-κB p65的表达水平,配制20μL体系,行定量PCR检测,每个反应3个复孔。PCR条件:95 ℃3 min,35个循环:95 ℃12 s,56 ℃ 50 s。
1.4 MTT检测细胞增殖活性
取对数期生长期的转染后24 h、48 h的细胞,行胰酶消化,随后取细胞,使用新鲜培养基重悬细胞,以1×103/孔接种细胞到96孔板中,将其放入37 ℃孵箱中培养。培养12 h后加入MTT溶液10μl/孔,再将其放入37 ℃孵箱,培养时长为1 h。用酶标仪测定450 nm测定OD值,计算细胞增殖活性。
1.5 Transwell小室检测细胞侵袭和转移指数
转染24 h、48 h后,将细胞进行铺板,位置:Transwell小室里的上层、下层加入DMEM+10.0%胎牛血清培养基600 μl,把Transwell小室放进24孔板里,培养24 h后取出,多聚甲醛固定并用结晶紫染色,选择5个随机视野进行细胞计数,计算细胞侵袭指数与细胞转移指数。
1.6 Western blot法检测Caspase-9、Myc蛋白表达水平
转染24 h、48 h后,收集细胞并加入细胞裂解液,充分裂解后以12 000 r/min离心,定量蛋白浓度后进行SDS-PAGE凝胶电泳,电泳结束后进行转膜,采用5.0%的脱脂奶粉进行封闭。加入抗Caspase-9蛋白、抗Myc蛋白,稀释浓度分别为1:500与1:1 000,洗膜后加入二抗,室温孵育1 h,洗膜后用化学发光剂显色,使用凝胶成像仪,观察目的蛋白条带表达情况,以β-acTin作为内参蛋白,计算目的蛋白的相对表达水平。
上述实验均进行3次,取平均值。
1.7 统计学分析
选择SPSS 22.0软件对本研究所有的计量数据进行统计学分析,描述计量数据为(),两组间比较行t检验,多组间比较行方差分析。P<0.05代表差异有统计学意义。
2 结果
2.1 TLR4/NF-κB p65 RNA表达水平
转染24 h、48 h后,实验组的TLR4、NF-κB p65 RNA表达水平均较对照组与空白组高,差异有统计学意义(P<0.05),空白组与对照组比较,差异无统计学意义(P>0.05),见表1。
表1 三组转染不同时间点后的TLR4/NF-κB p65 RNA表达水平比较 ()
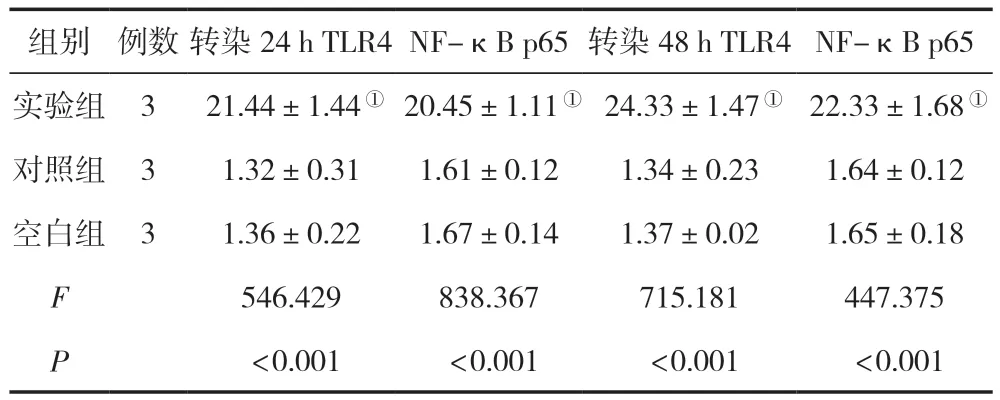
表1 三组转染不同时间点后的TLR4/NF-κB p65 RNA表达水平比较 ()
注:与对照组相比,①P<0.05。
组别例数转染24 h TLR4NF-κB p65 转染48 h TLR4NF-κB p65实验组3 21.44±1.44① 20.45±1.11① 24.33±1.47① 22.33±1.68①对照组31.32±0.311.61±0.121.34±0.231.64±0.12空白组31.36±0.221.67±0.141.37±0.021.65±0.18 F 546.429838.367715.181447.375 P<0.001 <0.001 <0.001 <0.001
2.2 细胞增殖指数
转染24 h、48 h后,实验组的细胞增殖指数显著低于空白组与对照组,差异无统计学意义(P<0.05),对照组与空白组比较,差异无统计学意义(P>0.05),见表2。
表2 三组转染不同时间点后的细胞增殖指数比较 (,%)

表2 三组转染不同时间点后的细胞增殖指数比较 (,%)
注:与对照组相比,①P<0.05。
组别例数24 h48 h实验组3 45.87±3.14① 56.69±4.21①对照组3 78.20±13.2989.20±4.39空白组378.44±2.8789.60±3.57 F 18.624 24.932 P<0.001<0.001
2.3 细胞侵袭指数与细胞转移指数
转染24 h、48 h后,在细胞侵袭指数与细胞转移指数方面,实验组均较空白组、对照组低,差异无统计学意义(P<0.05),对照组与空白组比较,差异无统计学意义(P>0.05),见表3。
表3 三组转染不同时间点的细胞侵袭指数与细胞转移指数比较 (,%)
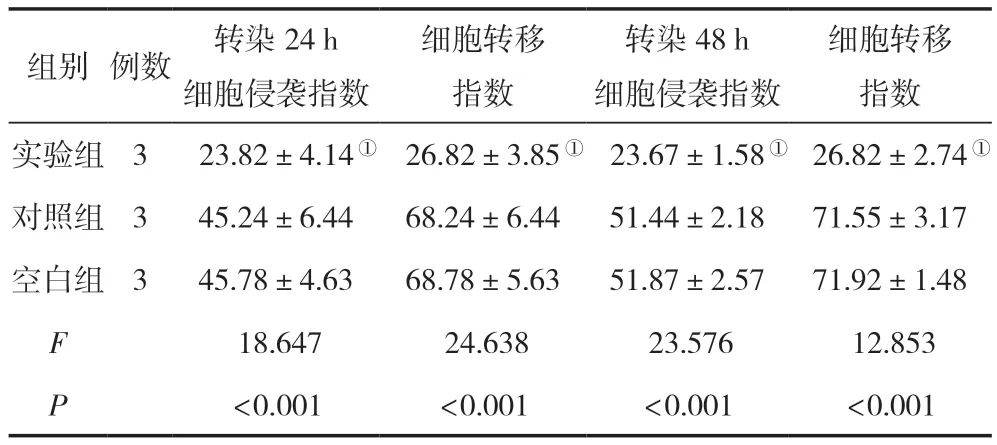
表3 三组转染不同时间点的细胞侵袭指数与细胞转移指数比较 (,%)
注:与对照组相比,①P<0.05。
细胞转移指数实验组3 23.82±4.14① 26.82±3.85① 23.67±1.58① 26.82±2.74①对照组345.24±6.4468.24±6.4451.44±2.1871.55±3.17空白组345.78±4.6368.78±5.6351.87±2.5771.92±1.48 F 18.647 24.638 23.576 12.853 P<0.001<0.001<0.001<0.001组别例数转染24 h细胞侵袭指数细胞转移指数转染48 h细胞侵袭指数
2.4 Caspase-9/Myc蛋白表达水平
转染24 h、48 h后,实验组的Caspase-9/Myc蛋白相对表达水平与空白组、对照组相比显著增高,差异有统计学意义(P<0.05),空白组与对照组比较,差异无统计学意义(P>0.05),见表4。
表4 三组转染不同时间点后的Caspase-9/Myc蛋白表达水平比较 ()
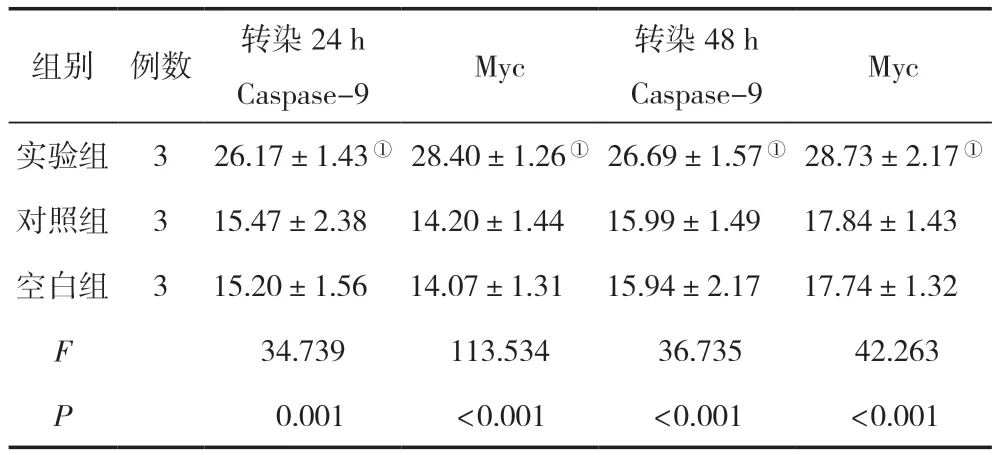
表4 三组转染不同时间点后的Caspase-9/Myc蛋白表达水平比较 ()
注:与对照组相比,①P<0.05。
组别例数转染24 h Caspase-9Myc 转染48 h Caspase-9Myc实验组326.17±1.43①28.40±1.26①26.69±1.57①28.73±2.17①对照组3 15.47±2.38 14.20±1.44 15.99±1.49 17.84±1.43空白组3 15.20±1.56 14.07±1.31 15.94±2.17 17.74±1.32 F 34.739113.534 36.735 42.263 P 0.001<0.001<0.001<0.001
3 讨论
当前皮肤鳞状细胞癌对人们健康的威胁日益严重,虽然当前医疗技术显著提高,但患者的5年病死率一直居高不下[11]。至今为止,该疾病的发病机制仍不明确,涉及的病因包括炎性反应因子、外伤、人乳头瘤状病毒感染、长期暴露于不良环境、免疫抑制状态等[12]。当前皮肤鳞状细胞癌的发生具有逐渐上升的趋势,尤其是在老年人中的发病率逐年增高,严重威胁着人类的健康[12]。本研究结果显示,转染24 h、48 h后,实验组的TLR4、NF-κB p65 RNA表达水平较对照组、空白组高(P<0.05),空白组与对照组比较无明显差异(P>0.05);实验组的细胞增殖指数显著低于空白组与对照组(P<0.05),对照组与空白组比较无明显差异(P>0.05),表明TLR4/NF-κB p65高表达能抑制皮肤鳞状细胞癌细胞的增殖。从机制上分析,Toll样受体在固有免疫及获得免疫过程中发挥着重要作用,是哺乳类动物细胞表面的跨膜受体[13]。TLR4是Toll样受体的主要成员之一,可以识别各种与损伤有关的分子模式(damage-associaTedmolecularpaTTern,DAMPs)、病原有关分子模型(pathogen-associated molecular paTTern,PAMP),可激活下游NF-κB p65的表达,引起多种炎性反应介质的释放,从而介导调节机体的免疫反应与炎性反应。TLR4/NF-κB p65高表达可调节肿瘤浸润免疫作用,可抑制肿瘤细胞增殖[14-15]。
皮肤鳞状细胞癌的发生、发展是多步骤、多因素共同作用的结果,在非黑色素瘤皮肤癌中,该疾病的发病率处于第二位,病死率一直比较高。当前研究显示,TLR4介导炎性反应信号通路的持续激活,还可调控肿瘤细胞增殖活性,TLR4信号通路的活化可抑制多种恶性肿瘤的异常增殖[16]。TLR4在皮肤鳞状细胞癌中的高表达可促进炎性反应,抑制肿瘤恶化[17]。本研究结果显示,转染24 h、48 h后,实验组的细胞侵袭指数与细胞转移指数都明显低于空白组与对照组(P<0.05),对照组与空白组对比差异无统计学意义(P>0.05),表明TLR4/NF-κB p65高表达能抑制皮肤鳞状细胞癌细胞侵袭与转移。从机制上分析,TLR4是Toll样受体家族亚型中最重要的成员,不仅广泛表达于免疫原性细胞,也表达于多种躯体恶性肿瘤与脑肿瘤细胞中,与多种肿瘤的生物学行为密切相关。TLR4在发挥抗肿瘤作用时,可通过T细胞的方式,TLR4在诱导抗肿瘤免疫应答时,可通过Myd88依赖性途径间接诱导,从而实现肿瘤抵抗作用[18]。TLR4还可通过活化多种信号途经激活Fas介导的途径,可抑制肿瘤细胞的增殖,也可促进肿瘤细胞的凋亡[19]。
皮肤鳞状细胞癌的发生、发展与多种信号通路失调有关,在皮肤鳞状细胞癌中有多个蛋白表达水平发生异常。特别是在肿瘤的发生与蛋白酶级联反应等相关程序的启动与激活密切相关,因而参与细胞凋亡过程。细胞凋亡等相关级联反应主要是由Caspase蛋白家族介导执行,其中Caspase-9、Myc作为凋亡启动因子,非常重要,对其表达水平进行检测后,其结果可作为细胞凋亡发生情况的间接反映。本研究结果显示,转染24 h、48 h后,实验组的Caspase-9/Myc蛋白相对表达水平与空白组、对照组相比显著增高(P<0.05),空白组与对照组相比差异无统计学意义(P>0.05),表明TLR4/NF-κB p65高表达能促进皮肤鳞状细胞癌细胞的Caspase-9/Myc蛋白表达水平,从而发挥促进细胞凋亡的作用。上调TLR4的表达可将c-Myc和K-Ras相关通路激活,将促进Caspase-3、Caspase-9的表达,从而促进肿瘤细胞的凋亡[20]。不过本研究也有一定的不足,实验分组比较少,尤其是没有进行剂量分析,也没有进行相应的临床与动物模型分析,将在之后的研究中进行深入分析。
综上所述,TLR4/NF-κB p65高表达能抑制皮肤鳞状细胞癌细胞的增殖、侵袭,也可促进Caspase-9/Myc蛋白的表达,从而发挥促进肿瘤细胞凋亡的作用。

