四种生防菌对猕猴桃果实腐烂病菌的室内抑制试验
刘伟光
(广州市农业科学研究院,广东广州 510335)
通过调查可知,在众多果蔬中,猕猴桃的采后病害情况尤为严重,在采后的运输、储存、售卖过程中,受到多种因素的影响,大批量猕猴桃出现腐烂情况[1]。从当下国内外对猕猴桃采后病害的研究现状来看,普遍对采后病害的研究仅限于病原菌鉴定,如软腐病、灰霉病、黑星病等,对于如何采取生物学技术对猕猴桃采后病害进行有效控制,缺乏具体化的研究成果[2]。此次试验通过分离猕猴桃果实上的4 种病原菌,然后利用效果较好的生防菌进行测试,深入分析了不同环境下的防治效果差异,进而初步制订出科学、合理的使用方法,为陕西省宝鸡市眉县控制猕猴桃采后病害提供有效的生物学技术支持。
1 材料与方法
1.1 试验材料
1)病菌材料。此次试验通过病原菌分离法,从具有采后病害的眉县猕猴桃中分离出4 种病原菌,分别编号为B1、B2、B3、B4。
2)生防材料。采用广州市农业科学研究院果树研究所提取的X1、D3-2、GK、BAR1-5 共4 种生防菌种,放入-90 ℃的超低温冰箱储存。
3)培养基材料。①生防菌培养基:分别配备黄豆粉培养基、发酵培养基、高氏一号培养基。②病原菌培养基:取30 g 眉县猕猴桃,加入20 g 琼脂,用1.5 L 蒸馏水煮沸15 min。
4)仪器材料。海尔超低温冰箱、PM200 型电子天平、Leica DMLS2 型显微镜、培养皿、台式离心机、恒温培养箱、微孔过滤膜等。
1.2 试验方法
1.2.1 病原菌提取
利用病原菌分离法,将腐烂的眉县猕猴桃多次消毒后,分割成3 cm 左右的小块,放入培养基,在26 ℃下,培养至病原菌落直径在1 cm 以上时,将其挑到事先备好的同规格培养基内,恒温26 ℃继续培养;如此反复2~4 次即可,随后将病原菌挑回眉县猕猴桃,观察前后症状是否一致,若一致即可将病原菌作为试验菌种。
1.2.2 致病性检测
分别将提取出来的4 种病原菌接种到有伤、无伤2 种不同的猕猴桃上,观察其不同情况下的致病性。
1.2.3 制作无菌液
将生防菌放入发酵培养基,恒温26 ℃培养48 h,随后按照15%的接种标准,转移到备好的黄豆培养基里,继续发酵,恒温26 ℃培养120 h,以4 000 r·min-1转速离心20 min 后,取上方清液过滤即可得到无菌液。
1.2.4 生防菌对病原菌抑制效果检测
使用3%次氯酸钠对猕猴桃表面进行10 min 消毒处理,随后在猕猴桃中央打一小孔,晾干后接种生防菌,再次晾干后,接种病原菌,依次操作完成后,覆盖一层保鲜膜,常温下培养120 h 后,与未接种生防菌但接种了病原菌的猕猴桃进行比对,计算抑制效果。
式中:Ce为抑制效果,%;X0为未接种生防菌的猕猴桃侵染直径,cm;X1为接种了生防菌的猕猴桃侵染直径,cm。
1)浓度。采用1.2.4 的检测方法,将生防菌滤液分别稀释为原液浓度的2 倍、4 倍、6 倍,对猕猴桃依次进行接种,培养120 h 后检测不同浓度的生防菌滤液抑制效果。2)温度。按照1.2.4 的检测方法,分别将接种了生防菌的猕猴桃依次放在0 ℃、10 ℃、20 ℃的恒温环境中,培养120 h 后,检测不同温度下的抑制效果。
2 结果与分析
2.1 猕猴桃病原菌分离情况
此次试验通过病原菌分离法,将病变果实中的4 种病原菌提取出来,分别编号为B1、B2、B3、B4,4 种常见病原菌的具体性状见表1(室温26 ℃,培养120 h 后的结果)。如表1 所示,B3、B4 病原菌生长速度最快,直径已经达到了5.5 cm,而B1 病原菌生长速度也相对较快,直径达到了5.0 cm,B2 病原菌生长速度较慢,直径仅有3.5 cm。

表1 不同病原菌分离后的性状情况表
2.2 生防菌抑制效果检测
此次试验采用了平板对峙法,将提取到的4 种生防菌进行抑菌效果比对。如表2 所示,4 种生防菌所表现出的抑制效果均较良好,其中X1 生防菌对B3 病原菌的抑制效果相对较好,抑菌带宽度为8.0 mm,对B1、B2、B4 病原菌的抑制效果接近持平,抑菌带宽度分别为5.0 mm、5.9 mm 和5.0 mm;D3-2 生防菌对4 种病原菌的抑制效果相差不大,抑菌带宽度依次为4.8 mm、6.1 mm、4.9 mm 和3.5 mm;GK 生防菌对B1、B3 病原菌的抑制效果均较明显,抑菌带宽度依次为8.0 mm 和8.2 mm,而对B2、B4 病原菌的抑制效果相对较差,抑菌带宽度仅有5.9 mm 和5.5 mm;BAR1-5 生防菌对B1、B3 病原菌的抑制效果尤为突出,抑菌带宽度分别高达11.5 mm 和12.8 mm,而对B2、B4 病原菌的抑制效果虽没B1、B3 病原菌那么明显,但相比其他3 种生防菌也比较可观,抑菌带宽度分别为8.5 mm 和9.2 mm。
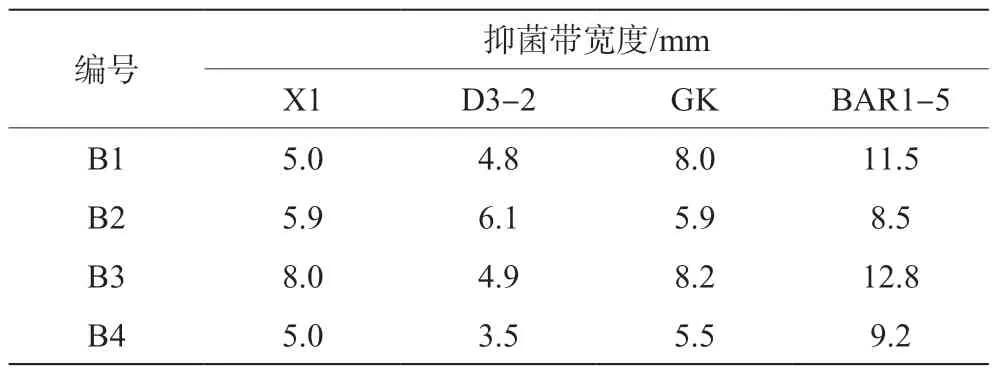
表2 不同生防菌对病原菌的抑制效果
2.3 不同浓度的生防菌抑制效果测试
如表3 所示,随着4 种生防菌浓度的不断稀释,其整体的防效率也在逐渐降低,其中X1 生防菌对B1病原菌的防效率下降较为明显,对B2 生防菌的防效率影响较小,在稀释2 倍时对B4 生防菌的防效率较高;D3-2 生防菌在2 倍、4 倍、6 倍稀释后,整体的防效率差异不大,呈稳步下降的趋势;GK 生防菌在稀释2 倍后,对B2 生防菌的防效率下降尤为明显,经过6 倍稀释后,对B2、B3 病原菌的防效率已经呈负数比例,但不同倍数稀释后,对B1 病原菌防效率的下降趋势较为缓慢,与4 倍的防效率比,6 倍的防效率仅下降了1.06 个百分点;BAR1-5 生防菌在2 倍稀释后对B2、B4 病原菌的防效率较高,对B1 病原菌在6 倍稀释后的防效率比2 倍时有所下降,对B3 病原菌6 倍稀释后的防效率下降趋势较小,对比4 倍防效率仅下降了1.40 个百分点。
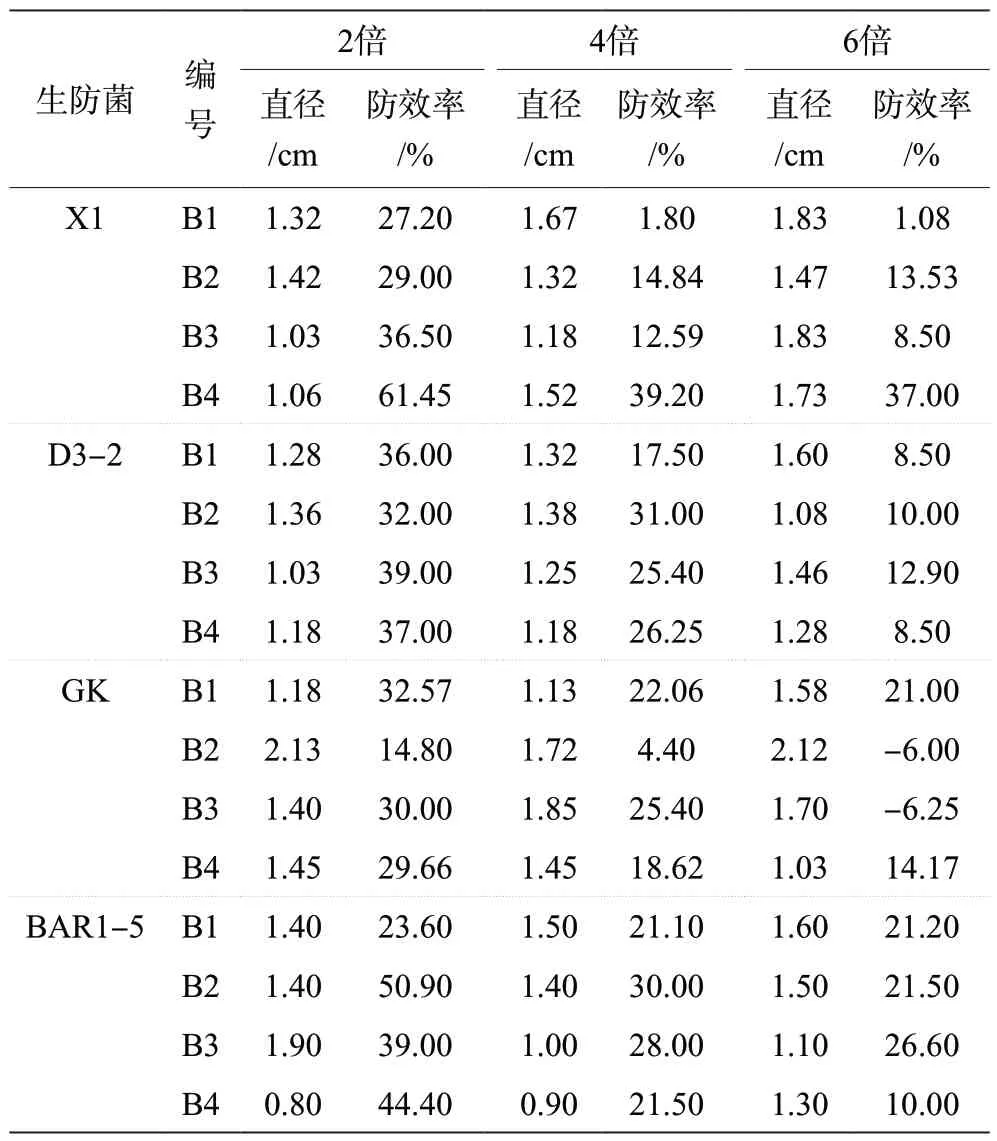
表3 不同浓度不同生防菌对病原菌的抑制效果检测
2.4 不同温度下生防菌抑制效果测试
由于不同生防菌对不同病原菌所产生的防治效果不同,此次在进行温度测试时,会将4 种生防菌混合起来,以便其能够充分发挥抑制作用,并计算其整体随着温度变化,所产生抑制效果的变化。
如表4 所示,在10 ℃时生防菌的防效率达到了最大值,对不同病原菌的防效率均在50%~60%,防治效果较为明显;在20 ℃时,由于温度升高,病原菌的活力增强、侵染速度加快,导致整体防效率偏低,尤其是对B4 病原菌的防效率,呈急剧降低趋势,防效率仅有9.70%;在0 ℃时,由于温度相对较低,在导致病原菌活力降低的同时,抑制了生防菌的代谢能力,进而使得对猕猴桃表面的防护效果下降。0 ℃时的整体防效率在25%~40%,对比10 ℃时有所降低;值得注意的是,在0 ℃与20 ℃时,生防菌对B2 病原菌的防效率几乎持平,由此可知,在低温与高温环境中,生防菌对B2 病原菌仍有较好的抑制效果。
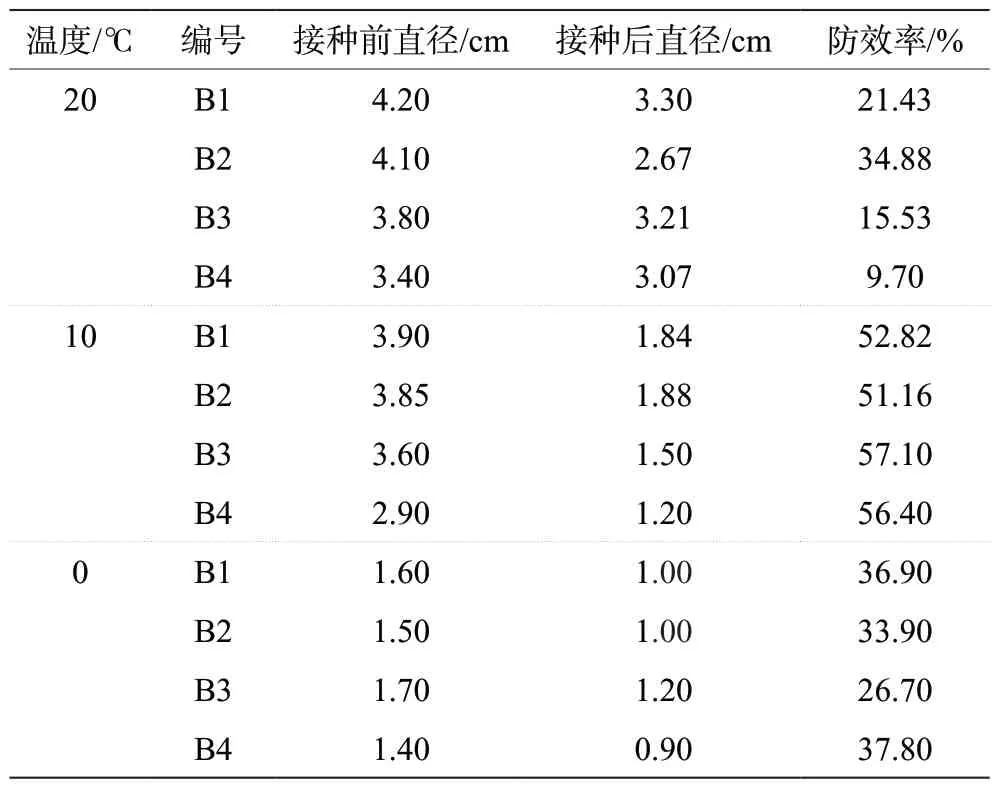
表4 不同温度下混合生防菌对不同病原菌的防效测试
3 结论与讨论
3.1 结论
此次试验通过将眉县猕猴桃作为试验材料,采用了病原菌分离法、平板对峙法等多种试验方法,深入分析了不同浓度、不同温度对病原菌防治效果的影响。经过鉴定:B1 病原菌属粉红镰孢霉,B2 病原菌属白地霉,B3 病原菌属尖镰孢霉,B4 病原菌属细交链孢霉,上述4 种病原菌均为弱寄生菌。
在不同生防菌对病原菌的抑制测试中,BAR1-5的抑制效果最为显著,对B1、B2、B3、B4 病原菌的抑菌带宽度均在8.0 mm 以上,尤其是对B1、B3 病原菌的抑菌带宽度在11.5 mm 及以上;X1 生防菌对B3病原菌的抑制效果最佳,抑菌带宽度也达到了8.0 mm;GK 生防菌对B1、B3 病原菌的抑菌带宽度均在8.0 mm及以上;相比之下,D3-2 生防菌对4 种病原菌抑制效果较差,抑菌带宽度普遍在3.5~5.0 mm,仅有B2病原菌的抑菌带宽度达到了6.1 mm。
3.2 讨论
控制果蔬采后病害对生物学技术的安全性、防效性要求较高[3]。在有效控制采后病害的同时,需确保不会对人们身体健康造成不良影响[4]。此次试验选取的生防菌是具有拮抗作用的微生物细菌。BAR1-5 生防菌属于一种稀有放线菌(假诺卡氏菌),目前,也是首次采用此生防菌进行试验,对4 种不同的病原菌均有明显的防治效果[5]。在4 种生防菌中,与GK 生防菌(木葡糖酸醋杆菌)、BAR1-5 生防菌、D3-2(链霉菌)相比,X1 生防菌是目前应用最为广泛的淡紫灰链霉菌,X1 生防菌的防治原理主要是利用抑制效果极强的代谢物质,对病原菌进行防治,淡紫灰链霉菌对尖孢镰孢霉有着明显的防治效果[6]。因此,可以利用分离、提纯4 种生防菌代谢物的方式控制果蔬采后病害。

