慢性闭角型青光眼合并Fuchs角膜内皮营养不良1例
唐 莹,赵 鋆,李 佳
(吉林大学第二医院 眼科中心,吉林 长春130041)
青光眼是世界首位不可逆性致盲性眼病,慢性闭角型青光眼患者因自觉症状不明显,易被延误,早发现且早治疗是避免进一步视神经损害的有效方法。本文发现1例慢性闭角型青光眼患者角膜内皮有点滴样赘疣物,表现出更严重的视力下降和角膜内皮数量降低,临床诊断为慢性闭角型青光眼伴Fuchs角膜内皮营养不良(FECD),报道如下。
1 临床资料
患者男性,50岁,因“右眼视物模糊3年伴加重3个月”于2023年6月就诊吉林大学第二医院青光眼科。既往史:2023年6月20日于本院行左眼周边虹膜激光打孔术。否认高血压、糖尿病、心脏病等病史。眼部检查:视力右眼0.5,矫正不应;左眼1.0。右眼眼压28 mmHg(1 mmHg=0.133 kPa),左眼18 mmHg。右眼球结膜混合充血,角膜略粗糙,角膜内皮见点状赘生物,金箔样反光(图1),前房浅,瞳孔正圆,直径4.0 mm,对光反射迟钝,虹膜纹理清,晶体混浊,眼底视盘界清色苍白,C/D=0.8,黄斑中心凹反光不清。左眼球结膜无充血,角膜内皮见点状赘生物,金箔样反光(图1),前房略浅,瞳孔欠圆,直径3.0 mm,对光反射灵敏,虹膜纹理清,颞上方激光孔通,晶体混浊,眼底视盘界清色淡红,C/D=0.4,黄斑中心凹反光清。辅助检查:眼科超声生物显微镜(UBM)示双眼角膜内皮欠光滑,前房变浅,右眼前房深度为1.53 mm,左眼前房深度为1.50 mm,双眼房角狭窄,大部分房角关闭,虹膜平坦,虹膜根部向前膨隆,睫状体前移。光学相干断层扫描(OCT):右眼黄斑区神经纤维层薄于正常值。左眼黄斑区网膜形态大致正常。右眼黄斑区上方、下方、颞上方、颞下方神经纤维层重度变薄,鼻侧神经纤维层中度变薄。视野:(30-2)右眼管状视野,左眼周边相对性暗点;(10-2)右眼大部分视野缺损。眼轴:右眼22.30 mm;左眼21.98 mm。双眼角膜内皮镜显示右眼细胞密度3 046.4/mm2,六角形细胞密度占33%;左眼细胞密度3 228.8/mm2,六角形细胞密度占27%,双眼角膜内皮镜下均可见大片暗区。角膜共聚焦显微镜:可见双眼角膜内皮细胞间有散在暗区,暗区中央有一高亮点,似疣状隆起,少数聚集成团,为典型的角膜内皮赘疣表现(图2)。诊断:双眼慢性闭角型青光眼;双眼白内障;右眼视神经萎缩;双眼Fuchs角膜内皮营养不良;左眼眼术后(LPI术后)。治疗:双眼酒石酸溴莫尼定滴眼液2次/d;布林佐胺滴眼液3次/d;马来酸噻吗洛尔滴眼液2次/d。患者住院期间双眼眼压均控制在20 mmHg以下。考虑到该患者Fuchs角膜内皮营养不良为染色体异常导致可能性大,建议患者进行基因测序明确是否带有突变基因,患者因自身原因拒绝检查。患者自觉当前视力条件下生活无障碍,且Fuchs角膜内皮营养不良尚无有效治疗方法,行青光眼手术治疗可能导致角膜内皮细胞失代偿,进一步加重病情。向患者及其家属交代病情,患者及其家属拒绝承担手术产生的风险,拒绝进一步治疗。予以患者降眼压药物,建议患者门诊随访,必要时行青光眼滤帘切除术+虹膜周边切除术+虹膜前房角黏连松解术联合或不联合角膜移植手术。

图1 双眼慢性闭角型青光眼合并Fuchs角膜内皮营养不良患者眼前段照片
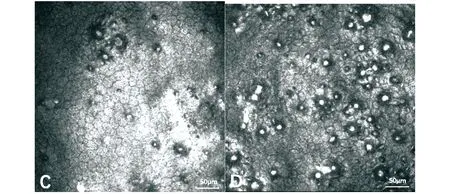
图2 双眼慢性闭角型青光眼合并Fuchs角膜内皮营养不良患者角膜共聚焦显微镜照片
2 讨论
青光眼被定义为一种与眼压升高相关的进行性视神经病变,是导致不可逆性失明的最主要原因[1]。根据各种类型原发性青光眼的流行病学情况,我国绝大多数原发性青光眼属闭角型青光眼,而慢性闭角型青光眼居于首位[2]。主要的危险因素包括女性、老龄、亚洲人种、短眼轴、浅前房、晶状体较厚且位置靠前等[3]。慢性闭角型青光眼早期常无症状,患者未觉任何不适,晚期出现视野缺损就医时才确诊。不足30%的患者可能会出现急性原发性房角关闭,患者自觉眼部疼痛、恶心、呕吐和间歇性视物模糊,特征表现为明显的结膜充血、角膜水肿、浅前房和大于30 mmHG的眼压。SIHOTA等[4]发现前房深度与内皮细胞密度呈正相关,原发性慢性闭角型青光眼和闭角型青光眼急性发作患者的眼睛中角膜内皮细胞密度显著降低。
目前全球的主流治疗手段为使用降眼压药物,必要时行激光周边虹膜切开术或小梁切除术以消除瞳孔阻滞。如果由于白内障因素导致房角关闭可行白内障摘除+人工晶体植入术[5]。
Fuchs角膜内皮营养不良作为一种复杂的遗传性疾病,被认为是遗传和紫外线辐射等环境因素共同作用的结果,是角膜内皮变性的常见原因[6]。美国40岁以上人群FECD的发病率为4%,在中国的发病率暂无相关报道[7-8]。其特征为角膜内皮细胞进行性丧失、持续性角膜基质或上皮层水肿、后弹力层上或者内疣状赘生物、角膜后弹力层局限性增厚[8-10]。早期由于周边角膜内皮六角形细胞扩大或迁移,患者常无症状,晚期出现眼痛、眩光、光晕和视力下降,严重后果为角膜上皮大疱、瘢痕和血管形成[11]。患者常自觉视物模糊感晨重暮轻,原因可能为夜晚眼睑闭合导致角膜水合增加,白天角膜暴露在空气中,水分蒸发导致角膜相对性脱水,因此患者感觉视物模糊有所好转[10]。患者常因其他疾病就诊,在裂隙灯下观察到角膜后金箔样反光,有点滴样赘疣,角膜内皮镜下发现角膜内皮细胞形状异常和大小异常[12]。进一步检查角膜共聚焦显微镜发现角膜内皮六角形细胞间存在暗区,中间有一高亮圆形斑点,似疣状隆起,相邻滴状赘疣可融合形成大片不规则暗区,中央有高亮区等FECD特征性改变而确诊[13]。但是由于角膜内皮细胞不可逆性减少,且伴有双侧角膜滴状赘疣,使角膜难以维持透明性,均增加了白内障摘除手术后角膜变性的可能性[14]。
高渗盐水滴剂或软膏有助于减轻角膜水合作用[10]。FECD的首选手术方法为后弹力层剥离内皮角膜移植术(DSEK)和后弹力层内皮角膜移植术(DMEK),最新研究发现Rho激酶抑制剂(ROCK)可增强细胞黏附,促进角膜内皮细胞再生使角膜恢复透明,但是仍缺乏长期的临床数据支持[15]。
关于闭角型青光眼与Fuchs角膜内皮营养不良两者合并发生的病例极少报道。有研究证明FECD与轴向远视和浅前房有关,而这两个因素正是闭角型青光眼的危险因素[16]。NAGARSHETH等[17]通过大样本量回顾性研究发现:与未受影响的眼睛相比,严重FECD的患者更容易发生青光眼和(或)高眼压症。由于慢性闭角型青光眼和FECD均会使得角膜内皮细胞数量减少,两种疾病可能相互影响,促进疾病进一步发展[18]。HU等[19]发现FECD的标志性CUG重复RNA病灶在小梁网中也有大量表达,而小梁网和角膜内皮细胞同属于胚胎神经嵴组织来源,增殖能力有限,更易形成病灶。CUG重复RNA病灶在小梁网中的大量表达是否会增加青光眼患病风险需要更深入的研究。
该患者自述出现视物不清已有3年,而慢性闭角型青光眼和FECD早期均无症状,发展至中晚期出现视物模糊、眼痛等症状,病史应远超3年。为患者行裂隙灯检查时发现角膜内皮有金箔样反光,怀疑为FECD,行角膜共聚焦显微镜进一步检查,发现右眼正常角膜内皮数量较左眼更少,细胞扩张移形更明显。患者右眼前房更深,双眼房角关闭情况相同的情况下,表现出右眼更高的眼压是否与FECD的致病基因在小梁网中的高表达有关,需要更多相关病例验证该推测。FECD发病率低,症状体征表现不明显易被其他疾病表现遮盖,使得该病容易误诊漏诊,患者可能出现术后远期视觉效果下降。该病例提醒我们,对于慢性闭角型青光眼患者伴有视物模糊晨重暮轻的情况下,需详细询问病史,必要时进一步行角膜内皮镜检查和角膜共聚焦显微镜,以明确是否合并FECD。有研究发现浅前房的患者行晶状体超声乳化术会导致更高的手术源性角膜内皮细胞丢失率,因角膜内皮细胞损伤后不可再生,若角膜内皮细胞失代偿可能导致视力严重下降[20]。因此选择手术方式前对患者进行详细的眼部检查、风险评估和术前沟通具有重要的临床意义。

