左室心肌应变技术评估糖尿病前期左室收缩功能损害和心肌力学改变的临床价值
朱雯,林苏苏,王磊
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病(DM)患者致死原因之一,主要与DM引起的心肌结构和功能异常有关[1-2]。目前,临床诊断DCM 主要包括检测左室舒张功能、左室射血分数(LVEF)及病理性左心室肥厚和间质纤维化等指标。研究表明,28%LVEF正常DM患者存在左室径向和纵向收缩期应变减低[3-4],因此应考虑将收缩期应变减低作为评估前期DM左室收缩功能减损的首选指标。本研究拟分析左室心肌应变技术评估DM 前期左室收缩功能损害和心肌力学改变的临床价值,现报道如下。
1 资料与方法
1.1 一般资料 收集2023 年1—5 月余姚市人民医院收治的DM 患者40 例(C 组)及DM 前期患者40例(B组),另取40 例来院体检的健康人群设为A组。纳入标准:(1)符合DM 和DM 前期的诊断标准[5];(2)年龄≥18 岁;(3)愿意参与研究并完成相关检查。排除标准:(1)存在严重的心、肝及肺功能不全者;(2)合并血液系统疾病者;(3)妊娠或哺乳期者;(4)患有遗传性心脏病或其他病因引起的继发性心脏病者;(5)合并急性感染者;(6)合并恶性肿瘤者。本研究获得余姚市人民医院伦理委员会批准,所有研究对象均同意参加本研究并签署书面知情同意书。
A 组男20 例,女20 例;年龄34 ~75 岁,平均(54.4±10.1)岁;文化程度初中及以下8 例,高中及大专9 例,本科及以上23 例;收缩压(SBP)为(121.79±6.82)mmHg(1 mmHg≈0.133 kPa),舒张压(DBP)为(78.46±5.92)mmHg。B 组男23 例,女17例;年龄32 ~71 岁,平均(52.9±9.8)岁;文化程度初中及以下10 例,高中及大专12 例,本科及以上18 例;SBP 为(123.06±7.15)mmHg,DBP 为(79.67±6.11)mmHg。C 组男21 例,女19 例;年龄35 ~75 岁,平均(55.2±9.6)岁;文化程度初中及以下12 例,高中及大专11 例,本科及以上17 例;SBP 为(124.14±6.83)mmHg,DBP 为(80.23±6.04)mmHg。3 组基线资料差异无统计学意义(均P >0.05),具有可比性。
1.2 方法 3 组均采用左侧卧位,调整呼吸,使用飞利浦EPIQ 7C彩色多普勒超声诊断仪进行心动图检查。探头频率为2.0 ~5.0 MHz,并连接心电图进行心脏扫描。通过Teich 方法测量并计算左室功能,包括左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD)、左室后壁厚度(LVPWT)、室间隔厚度(IVST)、LVEF 和左室短轴缩短率(FS)。同时,启动组织速度成像(TVI)模式,获取心尖四腔、两腔及心尖长轴切面的图像。存盘,脱机,将取样点置于左室前壁及后壁、前间隔及后间隔、侧壁及下壁的基底部、中间部的内膜下心肌层,获得患者心肌组织应变率曲线,并通过分析软件测量这些节段的收缩期整体纵向应变(global longitudinal strain,GLS)及收缩期应变率(systolic strain rate,SRs)。以上各项值均取3 个心动周期的平均值。
1.3 统计方法 使用Epidata3.1 软件建立数据库,使用SPSS26.0 软件分析。计量资料采用均数±标准差表示,采用F 检验或LSD-t 检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 左室功能指标比较 C 组左室 LVESD、LVEDD、LVPWT 及IVST 均大于A 组(t≥2.37,均P<0.05),LVEF、FS 均小于A 组(t≥2.22,均P <0.05);B 组与A 组左室LVESD、LVEDD、LVPWT、IVST、LVEF 及FS 差异均无统计学意义(t≤1.09,均P >0.05),B 组与C 组左室LVESD、LVEDD、LVPWT、IVST、LVEF 及FS 差异均无统计学意义(t≤0.77,均P >0.05),见表1。
表1 3 组左室功能指标比较(=40)

表1 3 组左室功能指标比较(=40)
注:LVESD 为左室收缩末期内径,LVEDD 为左室舒张末期内径,LVPWT 为左室后壁厚度,IVST 为室间隔厚度,LVEF 为左室射血分数,FS为左室短轴缩短率
?
2.2 左室各壁基底段心肌GLS 及SRs 比较 C 组与B 组左室各壁基底段心肌GLS、SRs 均低于A 组(t≥2.30,均P <0.05),C 组左室各壁基底段心肌GLS、SRs均低于B组(t≥2.35,均P<0.05),见表2。
表2 3 组左室各壁基底段心肌GLS、SRs 比较(=40)
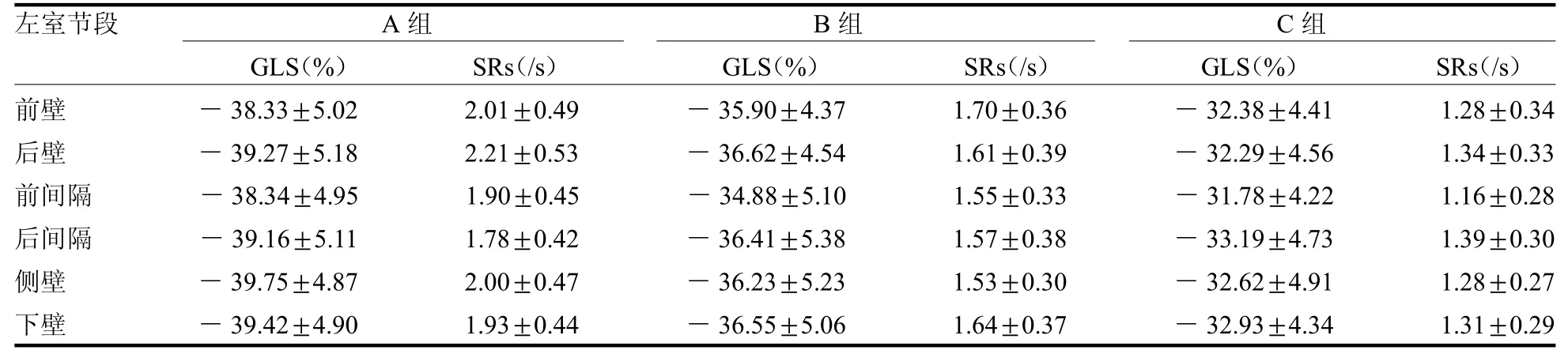
表2 3 组左室各壁基底段心肌GLS、SRs 比较(=40)
注:GLS 为整体纵向应变,SRs 为收缩期应变率
?
2.3 左室各壁心尖段心肌GLS 及SRs 比较 C 组与B 组左室各壁心尖段心肌GLS、SRs 均低于A 组(t≥2.20,均P <0.05),C 组左室各壁心尖段心肌GLS、SRs均低于B组(t≥2.16,均P<0.05),见表3。
表3 3 组左室各壁心尖段心肌GLS、SRs 比较(=40)

表3 3 组左室各壁心尖段心肌GLS、SRs 比较(=40)
注:GLS 为整体纵向应变,SRs 为收缩期应变率
?
2.4 左室各壁中间段心肌GLS 及SRs 比较 C 组与B 组左室各壁中间段心肌GLS、SRs 均低于A 组(t≥2.10,均P <0.05),C 组左室各壁中间段心肌GLS、SRs均低于B组(t≥2.65,均P<0.05),见表4。
表4 3 组左室各壁中间段心肌GLS 及SRs 比较(=40)
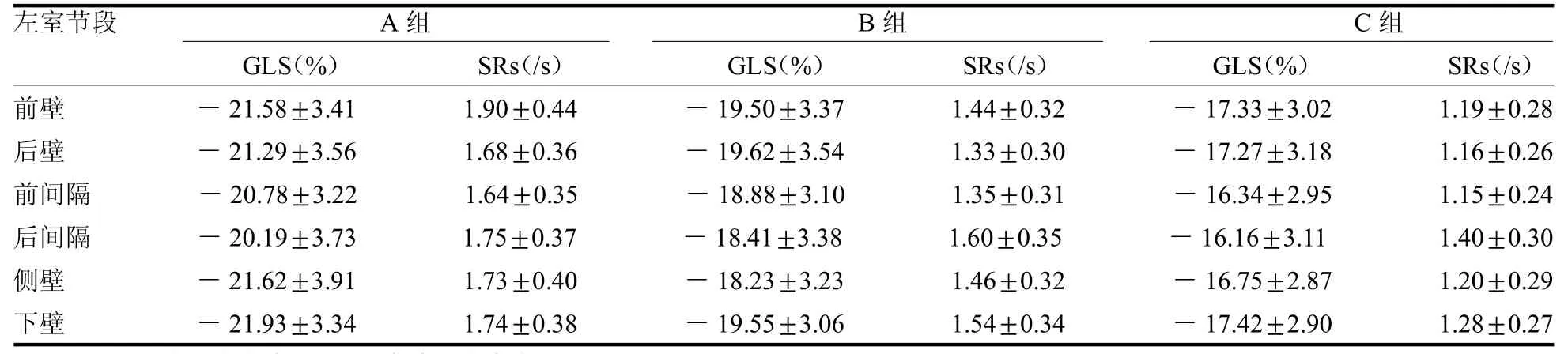
表4 3 组左室各壁中间段心肌GLS 及SRs 比较(=40)
注:GLS 为整体纵向应变,SRs 为收缩期应变率
?
3 讨论
DM 前期有相应心脏损害,研究表明,该期患心血管疾病、脑卒中和全因性死亡的风险明显较高[6-8]。因此,早期诊断DM 患者心肌功能受损具有重要临床价值。当前临床主要通过LVEF 及心室壁节段运动来评估心脏功能,但受检测仪器及检测人员操作水平的影响,室壁节段运动判断结果相对主观。并且常规超声心动图通过LVEF、FS 等评价左室收缩功能,而这些指标往往是在患者已发生DCM 时才可见明显改变,此时患者心脏功能损害较为严重,治疗棘手且预后不佳。本研究结果显示,C 组左室LVESD、LVEDD、LVPWT、IVST 均大于A 组(P <0.05),LVEF、FS 均小于A 组(均P <0.05);而B 组与A 组、B 组与C 组左室LVESD、LVEDD、LVPWT、IVST、LVEF、FS差异均无统计学意义(均P>0.05),提示常规超声心动图检查难以有效反映DM前期患者左室功能异常情况。
超声心肌应变技术可以测定组织应变和应变率。与组织多普勒速度指标相比,应变和应变率可以更直接地反映局部心肌变形模式,不会受到心脏整体运动和拖拉效应的影响,具有高时间和空间分辨率,所得结果相对准确和客观[9]。心肌纤维主要分为纵向纤维(约30%)和环形纤维(约70%),前者舒张及收缩活动在维持心脏正常功能中起到了重要作用[10-11]。本次研究检测心脏各切面和节段也倾向于心肌纵向纤维。心肌组织应变率曲线在一个心动周期内分为三个阶段:收缩期、舒张早期和舒张晚期。通过检测每个阶段的应变峰值和最大应变率,可以反映各阶段的最大形变程度[12-13]。其中,GLS 表示收缩期纵向峰值,用于反映心脏收缩功能;收缩期峰值应变率SRs 为负值,用于评估收缩功能。本研究结果显示,C组与B组左室各壁基底段、心尖段及中间段的心肌GLS、SRs 均低于A 组(均P <0.05),表明DM前期患者和DM患者左室收缩功能均存在损害,而C 组左室各壁基底段、心尖段及中间段心肌GLS、SRs 均低于B 组(均P <0.05),说明DM 患者心肌收缩功能的损害程度对比DM前期患者更为显著,这也符合DCM 发展过程,同时也表明左室心肌应变技术可以敏感反映DM 早期心肌受损。
综上所述,左室心肌应变技术可以早期反映出DM患者左室收缩功能受损和心肌力学改变的情况。
利益冲突 所有作者声明无利益冲突

