钛表面氨基杂化介孔硅基纳米形貌保护涂层的构建及成骨效果评价
杜诗敏, 刘蕴贤, 常晓峰, 李哲
1.西安交通大学口腔医院 陕西省颅颌面精准医学研究重点实验室,陕西 西安(710004); 2.西安交通大学口腔医院口腔种植科,陕西 西安(710004); 3.西安交通大学口腔医院数字化种植修复科,陕西 西安(710004)
钛金属因其良好的生物相容性和优异的机械性能,已成为口腔种植体的首选材料。钛表面通常缺乏骨诱导活性,因而骨结合时间相对较长(3 ~ 6 个月)。通过在钛表面构筑有序纳米形貌可调控多种骨再生进程[1],其中以钛纳米管阵列结构(titanium nanotube,TNT)的相关研究最为广泛。研究发现,通过改变阳极氧化电压可制备出不同管径TNT 形貌,并在血凝块形成[2]、免疫炎症反应[3]、血管新生[4]、新骨形成[5]等多个骨再生阶段发挥重要调控作用。目前纳米形貌改性钛种植体已在合成方法、机制探索、体内验证等方面得到了系统论证,但至今尚未在临床中广泛应用,其主要原因之一是对纳米形貌机械强度的担忧[6]。例如,种植体植入体内过程中需要对抗较高扭力,纳米形貌是否可以抵抗较高的剪切应力并完整进入体内发挥作用?同时纳米形貌若发生剥脱也会引发生物安全性的问题[7],因此,提高种植体表面纳米形貌的机械稳定性至关重要。
贝壳是一种典型的具有轻质、高强、高韧性能的材料,其珍珠层由文石片碳酸钙(约95%)及有机质(约5%)有序排列而成,由于其独特的“砖-泥” 结构使其具有极高的强度,同时兼具良好的韧性[8]。受此启发,仿贝壳高强高韧材料已成为工业制造领域研究热点。Song 等[9]利用氧化石墨烯纳米片与磺化苯乙烯-丁乙烯/丁苯乙烯复合物制备了一种超坚韧的人造珍珠层,可表现出约15.3 MJ/m3的超高韧性,优于天然珍珠层(约1.8 MJ/m3)和其他石墨烯基纳米复合材料(约0.3 MJ/m3)。理论上,若能在钛表面模仿出贝壳的“砖泥”结构,即在无机纳米形貌的间隙中原位生长有机纳米材料,或将提升纳米形貌在植入过程中的机械稳定性。
有机杂化介孔硅(hybrid organic- inorganic mesoporous silica,HMS)是由有机硅源和无机硅源共同组成的孔径介于2 ~ 50 nm 之间的多孔纳米材料,其中以氨基杂化介孔硅(Amino-HMS,AHMS)的研究最为广泛。因其无毒、可降解、易于修饰等优势被广泛应用于生物医学领域[10-11]。介孔硅基材料已被证明可以与TNT 通过氢键作用牢固结合[12],此外氨基基团(NH2-)和硅元素(Si)的存在也被证明对成骨细胞黏附、增殖和分化发挥重要作用[13-14]。因此,本研究以TNT 为模型材料原位沉积AHMS(TNT@AHMS),通过不同比例的有机/无机硅源用量探索合成参数;通过多种仪器完成TNT@AHMS 的材料表征;通过体内外实验验证其机械强度、降解行为、细胞活性和促成骨能力,旨在为钛表面纳米形貌保护涂层设计提供可行方案。
1 材料和方法
1.1 主要材料、试剂和仪器
纯钛圆片(直径15 mm,厚度1 mm)、纯钛螺纹钉(直径1.5 mm,长度2.5 mm)(宝鸡钛业有限公司,中国);防水SiC 砂纸400 ~2 000 目(Matador,德国);氢氟酸、丙酮、乙醇(天津富宇化工有限公司,中国);去离子水(第四军医大学口腔医院药剂科,中国);十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)、氨丙基三乙氧基硅烷(3-aminopropyl triethoxysilane,APTES)、正硅酸乙酯(tetraethyl orthosilicate,TEOS)、氢氧化钠、环己烷、DAPI(Sigma-Aldrich,美国);原硅酸四乙酯(tetraethyl orthosilicate,TEOS,玛雅试剂,中国);αMEM 培养基、胎牛血清(Gibco,美国);青霉素、链霉素、胰蛋白酶(Sigma,美国);4% 多聚甲醛、25% 戊二醛、六甲基二硅胺烷(天津天力化工,中国);CCK-8 试剂盒、MicroBCA 试剂盒、碱性磷酸酶(alkaline phosphatase,ALP)定量及染色试剂盒(碧云天,中国);阳极氧化电源(DH18600,北京大华无线电仪器厂,中国);数控超声波清洗器(KH-600GTDV,昆山市超声仪器有限公司,中国);恒温细胞培养箱(Thermo ScientificTMFormaTMⅡ,Thermo,美国);场发射扫描电镜(S-4800,HITACHI,日 本);ICP -AES 分 析 仪(Spectro Genesis,PE5300DV,德国);水接触角测定仪(KRUSS,EasyDrop-Standard,德国);共聚焦显微镜(A1 PLUS,Nikon,日本);X 射线光电子能谱仪(X-ray photo-electron spectroscopy,XPS)(Thermo Scientific K-Alpha,ThermoFisher,美 国); Micro-CT(SKYSCAN 2214,Bruker,比利时);采用小鼠前成骨细胞系(MC3T3-E1 亚克隆14,ATCC,美国)进行体外细胞实验;SD 大鼠(雄性、6 周龄)来源于西安交通大学动物实验中心。动物许可编号:SCXK(陕)2023-002。
1.2 纯钛表面纳米管TNT 的制备
使用砂纸依次将纯钛试样抛光并置0.5% 氢氟酸中反应30 min 取出,部分试样记做纯钛酸蚀组(Ti 组)。其余试样进一步置于0.5 % 氢氟酸电解液中,采用20 V 恒压直流电对试样进行阳极氧化处理,持续时间1 h,记为纳米管组(TNT 组)。所有试样依次在丙酮、无水乙醇、去离子水中超声荡洗10 min,晾干备用。
1.3 纳米管间氨基杂化介孔硅TNT@AHMS 的制备
AHMS 的沉积策略采用课题组前期使用的油水两相法[12]:将60 mg CTAB、250 μL NaOH(0.1 mol/L)依次加入到30 mL 水中获得水相溶液;将钛试样放入上述液体中60 ℃反应1 h;将40 μL 有机硅源(APTES)和无机硅源(TEOS)的混合液溶于1 mL环己烷中,并逐滴加入到水相溶液中,APTES/TEOS 用量比分别为 3∶1,1∶1,1∶3。继续反应4 h后取出试样,采用无水乙醇、去离子水交替冲洗,经60 ℃干燥1 h 后,采用含0.2 wt % NH4NO3的乙醇溶液60 ℃下回流 2 h,共重复3 次以彻底去除CTAB模板剂,晾干备用。
1.4 细胞培养与接种
采用MC3T3-E1 细胞系作为实验细胞,培养基为含有10% FBS、青链霉素双抗(100 U/mL)的α-MEM 培养基,置于含有5% CO2的 37 ℃孵箱中培养,隔日换液。细胞密度达到85 %时,使用胰蛋白酶消化细胞并传代。钛试样的消毒采用75%乙醇过夜浸泡,细胞接种前紫外照射至少30 min。
1.5 材料表征
扫描电镜:将试样置于扫描仓中采用20 kV 加速电压进行形貌观察;亲水性测定:校准水平面后,将50 μL 去离子水滴加在试样表面,待液滴稳定后使用DSA1 软件(KRUSS,德国)测量接触角并拍照记录。XPS:采用氮气清理洁净试样表面,使用单色Al-Kα X 射线源,工作电压为12 kV ×15 mA,压力为2 × 10-7Pa,使用Xpspeak 4.1 软件来分析高分辨率光谱。采用纳米压痕仪测定材料表面涂层强度并绘制载荷-深度曲线。
1.6 体外机械强度评估
将试样轻柔倒扣于24 孔板底部,每孔加入1 mL PBS 溶液后采用超声震荡仪荡洗15 min,取出后晾干观察。
1.7 体外降解行为观察
将试样置于 24 孔板,每孔加入 1 mL PBS 溶液,在恒温摇床的晃动下进行体外模拟浸泡实验(37 ℃,80 rpm),2、8、12、24、72 h 后取尽上层浸提液用作 ICP-AES 硅浓度检测。
1.8 细胞早期黏附和活力测定
将MC3T3-E1 细胞接种于材料表面24 h 后去除培养液,采用 2.5%戊二醛固定,电镜试样采用乙醇梯度脱水后上机观察;共聚焦显微镜检测试样采用DAPI 染液孵育15 min 后封片观察;细胞活力测定采用CCK-8 法,具体步骤依照厂商提供的说明书进行,450 nm 波长下测量OD 值。
1.9 ALP 染色及活性测定
接种于材料表面的MC3T3-E1 细胞成骨诱导培养7 d后,4 %多聚甲醛室温固定,每孔加入 200 μL ALP 染液孵育20 min,置于体式显微镜下拍摄;活性检测:成骨诱导7 d 后,每孔加入250 μL 细胞裂解液冰上裂解15 min,收集裂解液于EP 管中给予冻融循环3 次,离心取上清后加入显色底物和检测缓冲液孵育30 min,测定405 nm 处吸光度,剩余ALP 样品采用MicroBCA 试剂盒行细胞内总蛋白定量,对ALP 活性结果标定。
1.10 钛螺纹钉修饰、体内植入实验及Micro-CT检测
酸蚀粗化(Ti)、阳极氧化(TNT)、以及含纳米管形貌保护涂层(TNT@AHMS)的钛螺纹钉合成方法同1.2,1.3 部分。临床中种植体推荐的植入扭力一般为35 Ncm,但鉴于本实验所用螺纹钉的直径仅为1.5 mm,且大鼠股骨皮质骨较薄,因此常规备洞植入可能会影响植体初期稳定性和涂层保护能力的评估。因此本实验在不备洞的情况下随机将TNT、TNT@AHMS 试样植入3 只SD 大鼠两侧股骨干骺端(每只大鼠每侧股骨同时植入TNT、TNT@AHMS试样各一枚,即每组进行6 次重复),严密缝合后观察1 d 并再次取出,采用胰蛋白酶处理血凝块后PBS 漂洗3 遍,上机观察。另将18 只SD 大鼠随机分为Ti 组、TNT 组和TNT@AHMS 组,植入螺纹钉后分层缝合,术后连续3 d 肌注青霉素,术后4 周处死大鼠取股骨样本进行Micro-CT 扫描,评估不同试样表面成骨情况。选择感兴趣区域(region of interest,ROI)行三维图像重建,并定量分析骨体积分数。
动物实验经西安交通大学医学部动物实验伦理批准(XJTUAE2023-1288)。
1.11 统计学分析
使用 GraphPad Prism 8 软件进行统计学分析,计量资料用均数 ± 标准差表示,采用单因素方差分析进行多组间比较,P<0.05 为差异具有统计学意义。
2 结 果
2.1 钛表面形貌扫描电镜观察
扫描电镜观察可见氢氟酸酸蚀后钛表面出现了微米坑样形貌(图1a);通过20 V 电压下阳极氧化成功在钛表面制备出了管径约100 nm 均匀排列的管状阵列结构(图1b);采用3∶1,1∶1,1∶3 三种不同APTES/TEOS 用量比于TNT 表面沉积AHMS涂层,结果显示3∶1 和1∶1 用量比未能沉积介孔纳米涂层(图1c、1d),但在用量比为1:3 时可见钛纳米管间均匀覆盖AHMS 涂层,介孔孔径约4 nm(图1e、1f)。

Figure 1 Scanning electron microscopy images of acid-etched titanium, anodized titanium, and AHMS coatings deposited in situ with different APTES/TEOS ratios图1 酸蚀钛、阳极氧化钛以及不同APTES/TEOS 用量比下原位沉积AHMS 涂层后的电镜图
2.2 亲水性、元素表征及纳米压痕检测
水接触角测定结果显示Ti、TNT、TNT@AHMS的亲水角分别约为36.1°、14.73°、12.78°(图2a),其中TNT@AHMS 的亲水性显著优于Ti(P<0.001),但与TNT 之间未见明显差异(P= 0.425,图2b)。XPS 检测结果显示,相比于TNT,AHMS 沉积后试样出现了明显的N1s 峰(图2c),再次证明了TNT@AHMS 合成成功。纳米压痕仪生成的载荷-深度曲线可见,在同样施加200 N 载荷的条件下,纳米探头在TNT@AHMS 表面的压入深度仅为50 nm,而在TNT 表面可达100 nm,这说明TNT@AHMS 具有更优异的表面机械强度(图2d)。

Figure 2 Water contact angles, XPS measurements and nanoindentation tests on different sample surfaces图2 不同试样表面水接触角、XPS 及纳米压痕检测结果
2.3 体外机械性能测定
扫描电镜可见,在相同条件下超声震荡15 min后TNT 形貌破坏明显,部分TNT 从基底剥脱,形成大量无规则碎片,而TNT@AHMS 仍维持原有结构,两者结合紧密未见破坏(图3)。
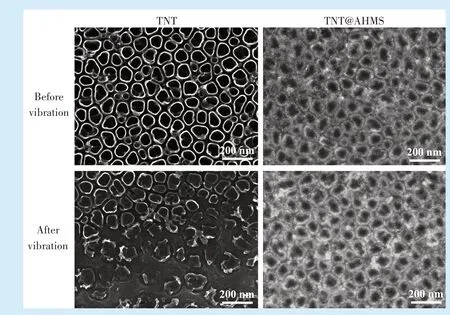
Figure 3 Scanning electron microscopy images of different samples before and after ultrasonic vibration for 15 min图3 不同试样超声震荡15 min 前后的扫描电镜图像
2.4 体外降解性实验
TNT@AHMS 的降解过程如图4,其中硅离子浓度测定结果可见:在浸泡早期,AHMS 可以发生快速降解,硅离子浓度升高明显,8 h 后表面基本观察不到介孔结构,12 h 后累计硅释放量进入平台期,约10 ppm。而电镜结果可见AHMS 介孔结构可维持2 h,在12 h 后则恢复为基底TNT 形貌,这与硅离子释放结果基本一致。

Figure 4 Silicon ion release curve and morphology changes of TNT@AHMS图4 TNT@AHMS 硅离子释放曲线及形貌变化
2.5 细胞实验
材料表面生物相容性主要通过细胞早期黏附、形态和活性进行评价。接种24 h 后,SEM 镜下可见TNT@AHMS 表面细胞黏附数量明显升高,细胞为多边形,可见大量伪足呈放射状伸展,细胞连接增多,此时Ti、TNT 表面细胞伸展相对不足,伪足较少(图5a)。CCK-8 结果显示,在接种 24、48、72 h后, TNT@AHMS 表面细胞始终保持最高的活性(图5b)。共聚焦显微镜下细胞计数结果(图5c、5d)与电镜结果一致(TNT@AHMSvsTi:P<0.001;TNT@AHMSvsTNT:P<0.05)。成骨诱导7 d 后,经ALP 染色比较成骨细胞分化能力,TNT@AHMS表面细胞的ALP 活性最高,进一步采用ALP定量试剂盒进行半定量分析,其结果与上述染色结果基本一致(TNT@AHMSvsTi:P<0.001;TNTvsTi:P<0.01,图5e、5f)。
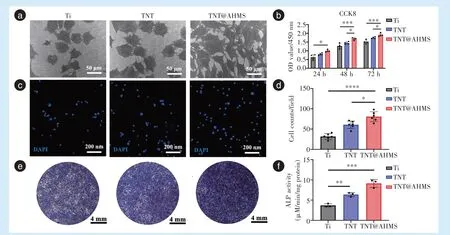
Figure 5 Cell adhesion behaviors, cell activity and ALP levels on different surfaces of the samples图5 不同试样表面细胞黏附数量、形态、活性及ALP 水平测定
2.6 体内植入试验及成骨效果评价
所有试样均在不备洞情况下手动攻入大鼠股骨(图6a)。植入前扫描电镜结果可见钛钉具有自攻性螺纹,螺纹间距约200 μm,通过阳极氧化法及油水两相法在螺纹钉表面可成功制备出TNT 和TNT@AHMS 形貌,与圆钛片基本一致。在不备洞情况下攻入钛螺纹钉后24 h 取出,可见螺纹钉表面覆盖大量血凝块,给予清理后进一步观察可见TNT 组出现明显剥脱,而TNT@AHMS 仍可保留较完整的形貌结构(图6b),这与体外检测结果基本一致。钛钉植入4 周后,Micro-CT 及三维重建结果显示:TNT@AHMS 表面骨组织覆盖面积最大(图6c,黄色部分),TNT 次之,Ti 最少,骨体积分数计算结果也同样显示,AHMS 的存在进一步提高了TNT 的骨体积分数(TNT@AHMSvsTi:P<0.01;TNT@AHMSvsTNT:P<0.05,图6d)。VG(Van Gieson)染色结果可见TNT@AHMS 表面新骨形成更为明显(图6e 深红色部分),与Micro-CT 结果基本一致。
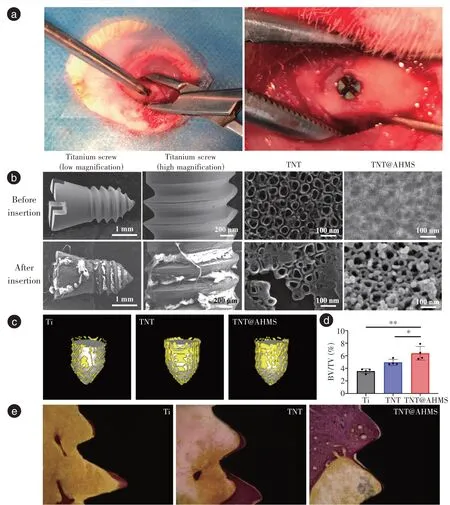
Figure 6 Morphological observation before and after implantation in rats and Micro-CT and VG staining results of osseointegration after 4 weeks图6 大鼠体内植入试样前后形貌观察及4 周后Micro-CT、VG 染色成骨检测
3 讨 论
纳米形貌的成骨诱导作用及机制已得到广泛研究[15],然而纳米形貌是否具有可靠的机械强度以保证植入时可以维持自身结构尚存争议,这也阻碍了纳米形貌修饰钛种植体的临床应用。虽然无扭力植入理念已被少量种植系统采用并获得了良好的临床效果[16],将形貌制备在该类种植体上或许可以避免剥脱问题,但该策略并不满足临床日益增长的对即刻种植、即刻负重的需求。也有学者提出零维纳米形貌的替代方案[17],但该方法并未从根本上解决上述问题。
天然贝壳具有高强高韧表面,这源于其内部有机质-无机质有序排列而成的“砖泥”结构。鉴于钛表面纳米形貌同样为无机TiO2,理论上若能在结构间原位生长出可降解的有机间质,则有望提升纳米形貌的机械强度,但目前尚无研究可以借鉴。本实验通过油水两相法成功在TNT 表面原位沉积出AHMS(TNT@AHMS),介孔孔径约4 nm,涂层均匀连续,重要的是实现了自下而上的全层沉积效果,纳米管间、管周及外表面均被完整覆盖。该结构与课题组先前在TNT 表面沉积的无机介孔硅薄膜 基 本 一 致[12]。TNT 表 面 存 在 的 游 离 羟 基(-OH),可以与硅胶束表面的羟基基团(-SiOH)发生氢键作用,这是合成成功的关键。此外,硅胶束尺寸极小,可以进入纳米管内部,这可能是实现全层沉积的主要原因[18]。XPS结果显示N1s峰的存在,再次证明TNT 表面的介孔涂层为氨基杂化介孔硅。
钛种植体植入体内通常需要耐受较大扭力,本研究首先通过体外超声震荡法初步证实了TNT@AHMS 的机械稳定性。在体内试验中,为了模拟高扭力环境,在不备洞的条件下植入了钛螺纹钉,其结果与体外一致,即AHMS 起到了预期的纳米形貌保护作用。在植入24 h 后AHMS 完全降解并重新暴露出TNT 阵列结构,这与体外降解实验结果一致。AHMS 的高速降解性源于其内部多孔结构。有研究表明,水分子进入到介孔孔洞会攻击内部Si-O-Si 骨架引发水解,此外环境中的离子成分也会加速这一过程[19]。AHMS 的快速降解巧妙地避免了对TNT 结构及后续生物活性的影响,同时AHMS 的掺入不仅未发现明显的细胞毒性,相反,还对MC3T3-E1 细胞的黏附、增殖、分化能力起到显著的上调作用。这可能与AHMS 高比表面积、亲水性等物理特性,以及APTES 的引入和低剂量的硅离子释放(10 ppm)等化学因素有关[20]。
本研究仍存在一定局限性,例如TNT@AHMS虽然在体内外实验中表现出可靠的稳定性,但其弹性模量、机械强度、韧度具体是多少仍需进一步测定,因为材料表面的上述性质对细胞的生物学行为同样具有显著影响;此外,APTES 和硅元素协同发挥促成骨功效的内在机制亟待进一步探索;最后,未来研究中仍需要采用大动物模型植入标准种植体以验证纳米形貌保护效果和成骨性能。综上,本实验受天然贝壳高强高韧表面特性启发,通过在钛纳米管表面原位沉积氨基杂化介孔硅,实现了钛表面无毒、可降解、促成骨、结合稳固的纳米形貌保护涂层的构建,为最终纳米形貌修饰种植体的研发提供新的思路。
【Author contributions】Du SM performed the experiments and wrote the article.Liu YX, Chang XF performed the experiments, revised the article.Li Z designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.

