载银sod基纳米分子筛的合成及抗菌性能
孙瑜颢 董庆喆 赵 蕾 姜晓丹 郭海玲*, 孟祥龙 郭永梅
(1青岛大学附属医院,耳鼻咽喉科,青岛 266555)
(2中国石油大学(华东)化学工程学院,重质油国家重点实验室,青岛 266580)
(3青岛大学附属医院,医学研究中心,青岛 266555)
(4闽江学院,新型功能性纺织纤维及材料重点实验室,福州 350108)
有害细菌一直是人类健康和寿命的重大威胁。研发高效抗菌材料以阻断细菌传播是应对这一威胁最为直接且有效的手段。锌、铜、银等金属是广谱型抗菌物,其中,银的抗菌特性自古希腊以来就广为人知,是迄今为止最高效的杀菌材料[1-3]。载银多孔基质抗菌剂可解决银类抗菌剂成本高和环境污染的难题,是制备长寿命抗菌材料的重要途径。目前,国内外已研发出多种含银抗菌剂,如载银分子筛抗菌剂、载银膦酸复盐抗菌剂[4]、载银氧化铝抗菌剂[5-7]、载银硅酸盐玻璃抗菌剂[8]、载银蒙脱石、膨润土、硅胶和活性炭抗菌剂等[9-12]。其中,分子筛因具有丰富的孔道结构、大比表面积和高离子交换量,同时兼备优异的耐热、耐酸、耐碱等性能,作为无机抗菌剂的载体[13-15]得到了高度的关注。
分子筛是一类具有四面体骨架结构的硅铝酸盐晶体,因其具有丰富的孔道结构而被认为是一种优良的抗菌剂载体。研究发现Y型分子筛银载量最大[16]。Y 型分子筛中具有代表性的FAU、EMT 与SOD 分子筛因由相同的sod笼状结构组成,故统称为sod基分子筛,但由于三者sod笼的排列方式不同,其结构有显著的差异。在FAU 分子筛中,sod笼的排列类似于金刚石中的碳原子,相邻的sod笼通过六方柱(D6R)相互连接,进而构成一个超笼结构和三维孔道体系;在EMT分子筛中,扭曲的sod笼层按照ABAB 的顺序堆积,层层之间呈现出镜像关系。这种排列方式导致形成了一个具有3 个12 元环的笼和一个具有5 个12 元环的大笼。相比之下,SOD分子筛中的sod笼通过共面连接形成,因此不具备超笼结构(图1)。
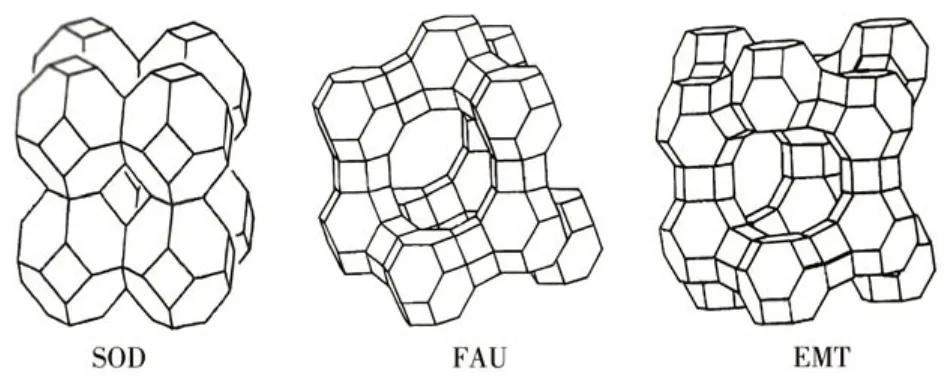
图1 sod基分子筛结构图Fig.1 Structure diagrams of sod-based zeolites
微米分子筛载体因颗粒尺寸较大、比表面积较小、扩散路径长、扩散阻力大等局限性使其抗菌效率受到限制[17]。纳米分子筛(小于100 nm,一类介于原子簇和宏观物体之间的介观物质)与微米级分子筛相比有如下的优势:更短的孔道扩散路径,更大的外比表面积,更有利于抗菌活性物的扩散和接触病原菌,更长的使用寿命。同时,纳米分子筛所拥有的空间效应、表面效应和量子尺寸效应,使其具有更多的抗菌活性位,大大提高了其抗菌性能[18-19]。此外,纳米分子筛表面大量的活性羟基易于结合并稳定银离子。值得一提的是纳米尺度的载银分子筛与有机基质材料有较好的相容性与分散性,更容易嵌入其中,例如纤维素和高效微粒空气(HEPA)过滤器(图2)。因此,高负载量、高稳定性、高效的载银纳米分子筛抗菌材料的研发更值得关注。
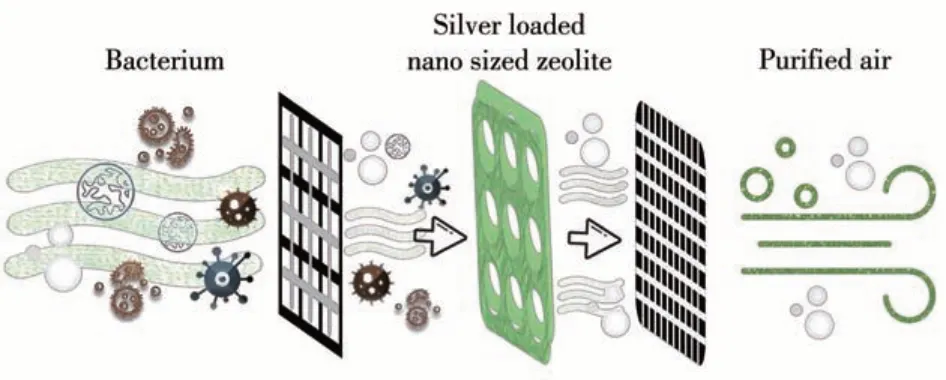
图2 载银纳米分子筛的抗菌过程示意图Fig.2 Schematic diagram of the antibacterial process of silver-loaded nanosized zeolites
我们从分子筛材料本征性质出发,考察了载银前后纳米分子筛的骨架结构和形貌变化以及抗菌性能,并对载银纳米分子筛的抗菌性能进行考察和优化:(1)通过对比无笼状结构的SOD 型、笼状结构FAU 型以及EMT 型载银纳米分子筛的抗菌性能,探究多孔材料中笼状结构对抗菌性能的贡献,筛选出载银纳米分子筛Ag-FAU 为最佳抗菌剂;(2)对比3种不同尺寸FAU 型分子筛的抗菌性能,探究FAU 型分子筛内外比表面积对抗菌所需浓度与抗菌速率的影响,并筛选出最佳抗菌尺寸及其工艺合成条件。
1 实验部分
1.1 试剂与仪器
使用铝粉(Al,325目,99.5%,Alfa Aesar)、氢氧化钠(NaOH,97%,国药集团)与硅溶胶(30% SiO2,Ludox-HS-30,pH=9.8,Aldrich)制备无定形前驱体与不同种类分子筛。使用硝酸银(AgNO3,AR,Aladdin)进行离子交换。大肠杆菌(ATCC 25922)与金黄色葡萄球菌(ATCC 29213)在营养肉汤培养基(nutrient broth,BR,Solarbio)中培养,实验所需的琼脂粉(agar powder,BR)与磷酸盐缓冲液(PBS)购自Solarbio,以上药品均无需处理直接使用。
使用Bruker D8 Advance 型X 射线衍射仪(XRD,Bruker,德国)进行物相结构测试,测试条件:CuKα射线(λ=0.154 056 nm),扫描范围为3°~80°,工作电压为40 kV,工作电流为200 mA;使用JSM-7900F 型扫描电子显微镜(SEM,JEOL,日本)进行样品微观形貌的表征;使用ASAP 2020 Micro-meritics 型比表面积及孔隙分析仪(Micromeritics,美国)进行样品的N2吸附-脱附实验,并计算比表面积;使用NEXUS FTIR 型傅里叶变换红外光谱仪(FTIR,Thermo Fisher,美国)对比离子交换前后分子筛的结构变化;使用QMS 403C 型热重分析仪(NETZSCH,德国)对比离子交换前后分子筛的热稳定性;使用ContrAA 700型原子吸收光谱仪(德国Analytik Jena AG 公司)测量样品的银离子释放速率;使用ZQTY-90S型恒温培养摇床(上海知楚仪器)、LRH-70型生化培养箱(上海一恒仪器)、NanoDrop One型分光光度计(ThermoFisher,美国)、Safire 型酶标仪(Tecan,瑞士)和HCB-900V 型超净工作台(Haier,中国)进行抗菌性能的测试。
1.2 分子筛的合成
1.2.1 无定形前驱体的制备
用A 和B 表示2 种初始反应溶液。先将10 g NaOH 充分溶解在20 g 蒸馏水中,然后缓慢加入0.9 g 铝粉,记为A 溶液。将50 g 硅溶胶滴加入8 g NaOH 和17 g蒸馏水混合溶液中,记为B 溶液。A 和B 溶液在室温下搅拌4 h,然后在剧烈搅拌下将A 溶液缓慢滴加到B 溶液中,在混合过程中,A 与B 溶液均保持在冰水浴中。将所得澄清悬浮液在室温下搅拌24 h 后冷冻成固相,然后放入冷冻干燥器中除去46~48 g水。最后,通过离心洗涤至pH=7~8,冷冻干燥,得到的白色粉末即为无定形铝硅酸盐前驱体。
1.2.2 不同类型纳米分子筛的制备
称取500 mg无定形铝硅酸盐前驱体加入10 mL质量分数17%的NaOH 溶液中,在50 ℃下晶化36 h得到EMT分子筛,命名为EMT。称取500 mg无定形铝硅酸盐前驱体加入10 mL 质量分数7%的NaOH溶液中,在50 ℃下晶化24 h 得到FAU 分子筛,命名为FAU。称取500 mg 无定形铝硅酸盐前驱体加入10 mL 质量分数23%的NaOH 溶液中,在50 ℃晶化15 h得到SOD分子筛,命名为SOD。
1.2.3 不同尺寸FAU分子筛的制备
称取500 mg无定形铝硅酸盐前驱体加入10 mL质量分数2%的NaOH 溶液中,在100 ℃下晶化48 h,得到晶粒尺寸为1~1.5 μm的FAU 分子筛,命名为FAU-Micro-1。称取500 mg 无定形铝硅酸盐前驱体加入10 mL 质量分数7%的NaOH 溶液中,在100 ℃下晶化15 h,得到晶粒尺寸为100~150 nm 的FAU 分子筛,命名为FAU-Nano-1。称取500 mg无定形铝硅酸盐前驱体加入10 mL 质量分数8%的NaOH 溶液中,在50 ℃下晶化24 h 得到晶粒尺寸为10~20 nm的FAU分子筛,命名为FAU-Nano-2。
1.2.4 分子筛离子交换
称取500 mg 分子筛样品,加入10 mL 0.05 mol·L-1的AgNO3溶液中,在室温下搅拌24 h,使分子筛样品与溶液发生充分的离子交换反应。反应结束后,通过离心洗涤数次(至离心溶液中Ag+浓度小于原子吸收光谱仪的检测下限)得到白色固体,最后通过低温冷冻干燥24 h即得载银分子筛。EMT、FAU、SOD、FAU-Micro-1、FAU-Nano-1、FAU-Nano-2 负载Ag 后制得的样品分别命名为Ag-EMT、Ag-FAU、Ag-SOD、Ag-FAU-Micro-1、Ag-FAU-Nano-1、Ag-FAUNano-2。
1.3 载银分子筛抗菌性能考察
1.3.1 细菌培养
从培养平板上挑取细菌单克隆至5 mL 营养肉汤培养基中。使用恒温培养摇床在37 ℃、220 r·min-1的条件下振荡培养过夜。将培养过夜菌液按体积比1∶1 000 接种至新的5 mL 营养肉汤培养基中,在37 ℃、220 r·min-1的条件下振荡培养。使用分光光度计测量光密度值(optical density,OD)至对数生长期(OD≈0.6),使用PBS 稀释菌液至OD=0.1,备用。
1.3.2 最小抑菌浓度(MIC)及最小杀菌浓度(MBC)
取50 μL的菌液及50 μL 0.02~0.5 mg·mL-1的载银纳米分子筛液体加入96孔板相应孔中,使细菌终浓度为105cfu·mL-1,在100 r·min-1、37 ℃培养16 h,使用酶标仪测试相应OD 数值。能抑制培养基内病原菌生长的最小载银纳米分子筛浓度即为其MIC。然后从相应培养物中取10 μL 混合液,滴加至营养琼脂平板上,在37 ℃培养过夜。能够杀灭培养基内细菌的最小载银纳米分子筛浓度即为MBC。
1.3.3 抗菌时间曲线
取50 μL 菌液(OD=0.1)加入10 mL 0.02~0.5 mg·mL-1的载银纳米分子筛中,上下颠倒混匀,分别在不同时间点吸取100 μL 液体涂在平板上。将平板放入生化培养箱中37 ℃条件下培养过夜,菌落计数。计算不同作用时间下材料的抗菌效果。
1.4 载银分子筛的Ag+释放速率
在去离子水与细菌培养液2种不同液体介质中进行Ag+释放速率考察,具体实验步骤如下:称取0.4 g 载银分子筛加入10 mL 去离子水(或细菌培养液)中,在50 ℃水浴下搅拌2 h 使分子筛在去离子水(或细菌培养液)中均匀分散,接着在常温下静置22 h,离心取上清液5 mL,并加入5 mL 去离子水(或细菌培养液),重复上述过程5 次。上述过程均在避光环境中进行。
2 结果与讨论
2.1 载银分子筛的表征
图3为不同种类与不同晶粒尺寸载银分子筛的XRD 图。载银分子筛样品均具有对应晶体的布拉格特征峰[20-21],使用Scherrer 公式计算各载银分子筛的晶粒尺寸,如表1 所示,Ag-EMT、Ag-FAU、Ag-SOD、Ag-FAU-Nano-2 的晶粒尺寸均在10~20 nm 以内,Ag-FAU-Nano-1 的晶粒尺寸为90 nm,属于纳米分子筛,而Ag-FAU-Micro-1 的晶粒尺寸较大,不满足Scherrer 公式的适用条件。以结晶完全的Ag-FAU-Nano-1 分子筛为标准计算了分子筛的相对结晶度,如表1所示,所有样品结晶度良好。
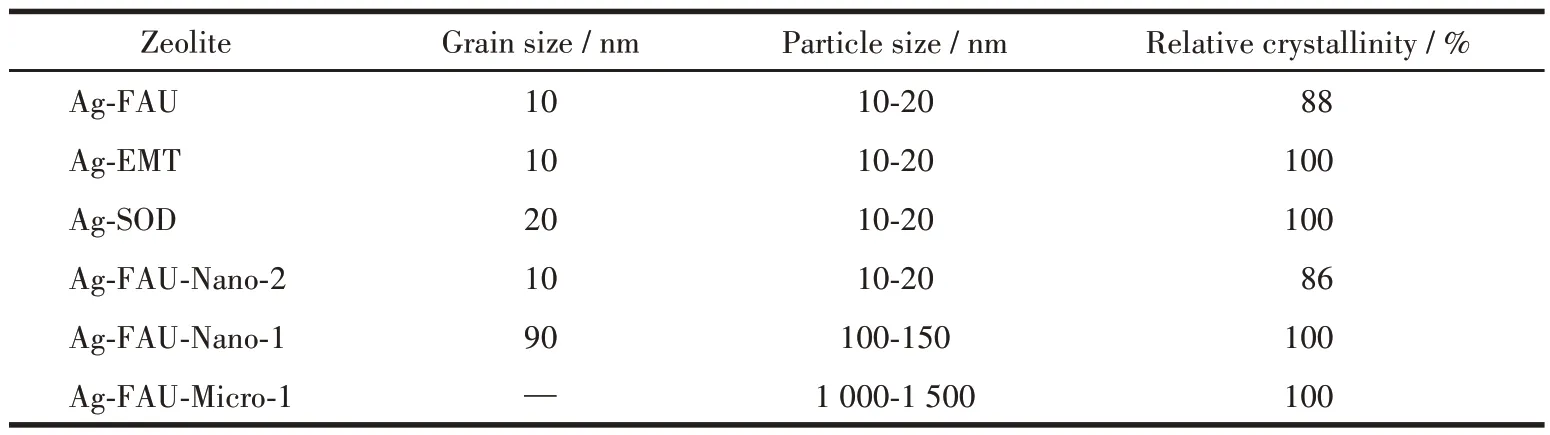
表1 不同载银分子筛的晶粒尺寸与相对结晶度Table 1 Grain sizes and relative crystallinities of the different silver-loaded zeolites
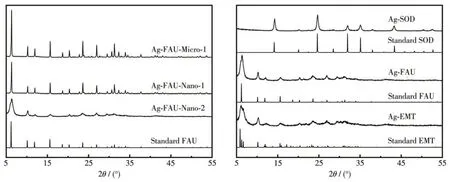
图3 载银分子筛的XRD图Fig.3 XRD patterns of the silver-loaded zeolites
图4为载银分子筛晶体的SEM照片,由图可知,分子筛的颗粒边缘清晰,分散良好,尺寸均一。Ag-EMT、Ag-FAU、Ag-SOD、Ag-FAU-Nano-2 分子筛的尺寸为10~20 nm。以上4 种分子筛呈球形,而Ag-FAU-Nano-1分子筛尺寸为100~150 nm,Ag-FAUMicro-1分子筛的尺寸为1~1.5 μm。
如表1 所示,Ag-EMT、Ag-FAU、Ag-SOD 均属于纳米分子筛且晶粒尺寸均在10~20 nm 之间,保证了实验变量的单一性,Ag-FAU-Nano-1、Ag-FAU-Nano-2、Ag-FAU-Micro-1 的晶粒尺寸均符合实验设计预期值。
如图5所示,纳米FAU、EMT和SOD分子筛中处于750 cm-1左右的吸收峰归属为T—O—T 键的非对称伸缩振动,985 cm-1左右的吸收峰为T—O—T 的对称伸缩振动;纳米FAU 和EMT 分子筛在566 cm-1左右出现双六元环的特征吸收峰。负载Ag+后的3种纳米分子筛的红外振动吸收峰没有发生变化,说明离子交换过程没有破坏或者改变分子筛的骨架结构。

图5 载银前后不同种类分子筛的FTIR谱图Fig.5 FTIR spectra of different kinds of zeolites prior and after silver ion exchanged
在空气气氛下对不同晶粒尺寸的载银FAU 分子筛进行TG测试,如图6所示,3种晶粒尺寸不同的分子筛在载银前后均仅在130 ℃左右出现质量损失,对应分子筛中结合水的去除,800 ℃下仍可保持骨架的完整性,说明负载Ag+后FAU 分子筛依然具有优异的热稳定性。载银分子筛在130 ℃下的质量损失减小,这是因为离子交换过程中负载在分子筛上的银离子与分子筛中原有的结合水竞争,导致分子筛中的结合水质量减少。
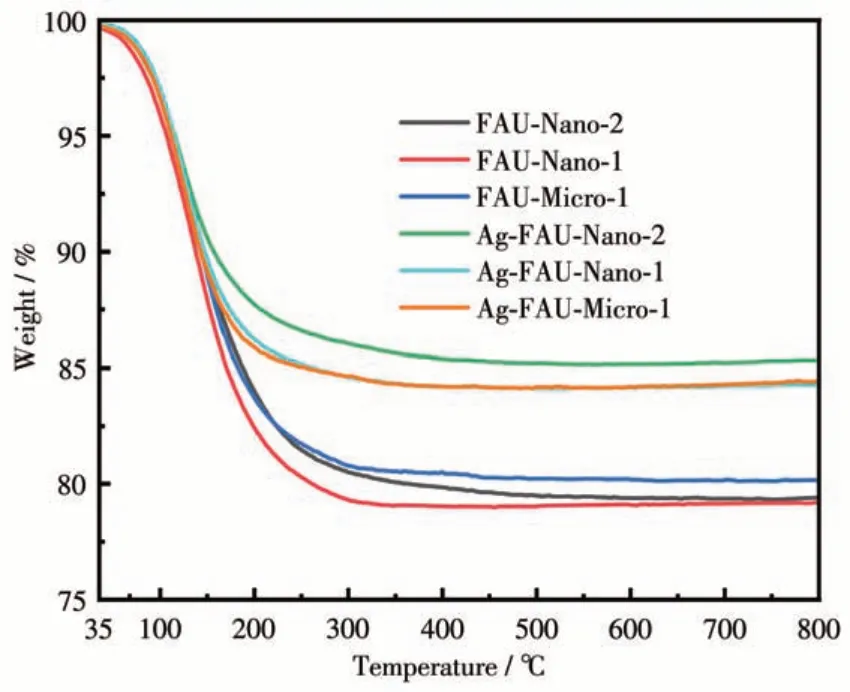
图6 载银前后不同晶粒尺寸FAU分子筛的TG曲线Fig.6 TG curves of FAU zeolites with different grainsizes prior and after silver ion exchanged
2.2 分子筛抗菌性能
载银纳米分子筛对大肠杆菌和金黄色葡萄球菌的抗菌测试性能测试结果归纳于表2。Ag-FAU与Ag-EMT 的抗菌性能相近,均远高于Ag-SOD,而对比不同晶粒尺寸的FAU 分子筛的抗菌性能可知,晶粒尺寸为100~150 nm 的Ag-FAU-Nano-1 抗菌性能最佳,其对大肠杆菌的MIC、MBC 分别为2、4 mg·mL-1,而对金黄色葡萄球菌的MIC、MBC 分别为8、10 mg·mL-1。

表2 载银分子筛对大肠杆菌与金黄色葡萄球菌的MIC与MBCTable 2 MIC and MBC of zeolites for Escherichia coli and Staphylococcus aureus
考察了Ag-FAU-Nano-2在不同杀菌时间内对大肠杆菌的杀菌率。从图7 可知,随着反应时间的延长,大肠杆菌菌种的活菌数量明显减少,在Ag-FAUNano-2 浓度为0.2 mg·mL-1时,反应仅5 min 后杀菌率达到97.6%,反应25 min后,活菌数量为0,杀菌率达100%。Ag-FAU-2 浓度增加至0.5 mg·mL-1后,杀菌5 min 的杀菌率增加至98.6%,反应20 min 后杀菌率为100%。经对比,Ag-FAU-Nano-2 的杀菌时间短于紫外线杀菌与80 ℃高温杀菌所需的杀菌时间,证明晶粒尺寸小的Ag-FAU-Nano-2 抗菌作用时间短,抗菌速率快。
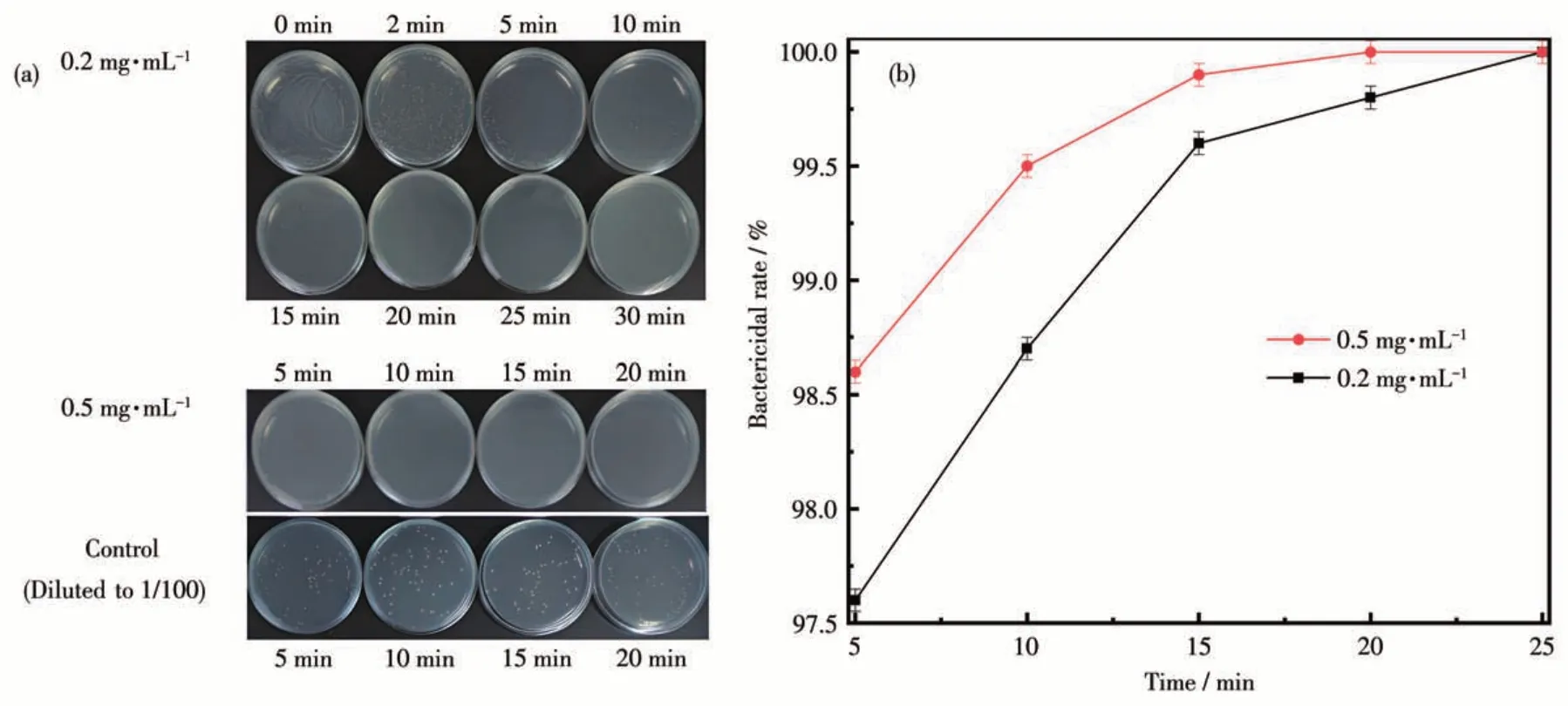
图7 Ag-FAU-Nano-2对大肠杆菌的杀菌实验结果图(a)及杀菌率随时间变化图(b)Fig.7 Diagrams of bactericidal experiment results(a)and curves of bactericidal rate changed over time(b)of Ag-FAU-Nano-2 against Escherichia coli
对Ag-FAU-Nano-1 分子筛同样进行了上述考察。如图8 所示,在Ag-FAU-Nano-1 浓度为0.2 mg·mL-1时,杀菌5 min 时的杀菌率为95%,杀菌30 min时杀菌率才可大于99%,与Ag-FAU-Nano-2 相比,Ag-FAU-Nano-1 因晶粒尺寸较大,杀菌速率较慢。当Ag-FAU-Nano-1 分子筛浓度降低为0.02 mg·mL-1时,其仍可在30 min 内基本完成杀菌任务,说明即使在极小浓度下Ag-FAU-Nano-1分子筛仍具有优秀的抗菌能力。

图8 Ag-FAU-Nano-1对大肠杆菌杀菌实验结果图(a)及杀菌率随时间的变化图(b)Fig.8 Diagrams of bactericidal experiment results(a)and curves of bactericidal rate changed over time(b)of Ag-FAU-Nano-1 against Escherichia coli
选择Ag-FAU-Nano-1对金黄色葡萄球菌进行抗菌实验,结果如图9所示,因金黄色葡萄球菌为革兰氏阳性菌,细胞壁较厚,银离子较难渗入,故杀菌时间需要延长。0.2 mg·mL-1Ag-FAU-Nano-1对金黄色葡萄球菌2 h 的杀菌率约为80%,3 h 的杀菌率约为97%,4 h 的杀菌率大于99%。说明所制备的抗菌材料对金黄色葡萄球菌等革兰氏阳性菌也具有很强的抗菌杀菌能力。
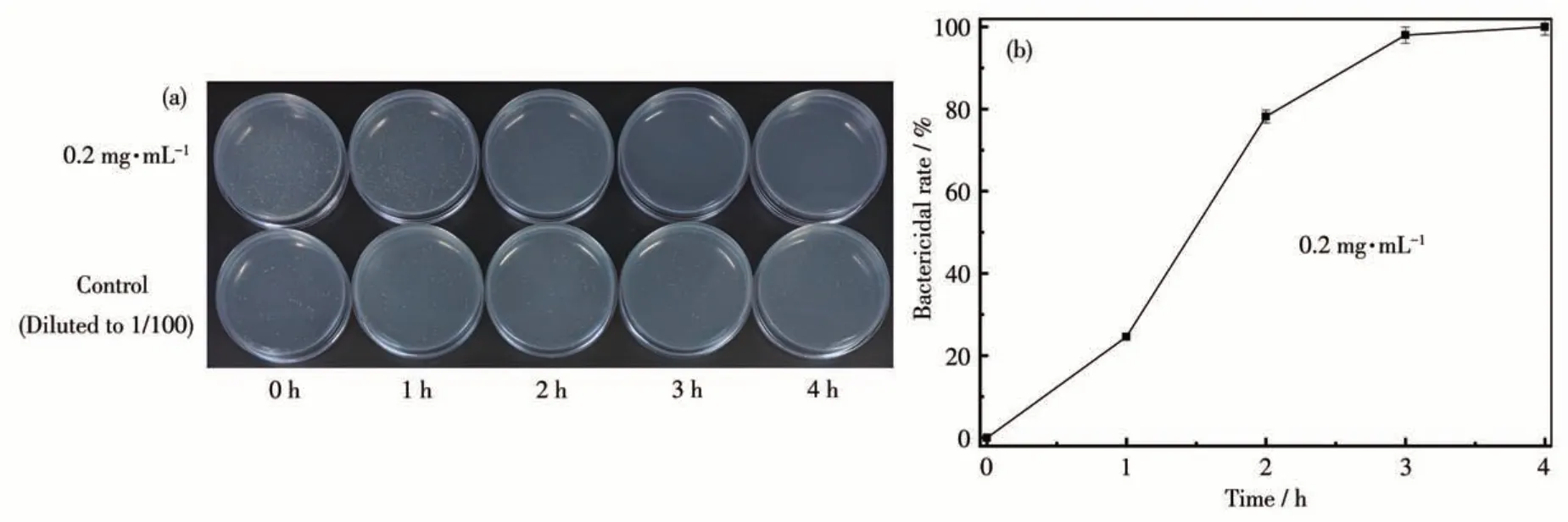
图9 Ag-FAU-Nano-1对金黄色葡萄球菌的杀菌实验结果图(a)及杀菌率随时间的变化图(b)Fig.9 Diagram of bactericidal experiment results(a)and curves of bactericidal rate changed over time(b)of Ag-FAU-Nano-1 against Staphylococcus aureus
根据中国人民共和国化工行业标准(HG/T 3794—2005)[22],无机抗菌剂对大肠杆菌和金黄色葡萄球菌的MIC 小于800 mg·L-1时,即为合格的抗菌材料。我们中制备的载银分子筛材料性能远超于行业标准,是性能良好的无机抗菌材料。
2.3 载银分子筛抗菌性能的影响因素
在低温(-196 ℃)下通过N2吸附-脱附测试所得到分子筛的孔结构性质,BET(Brunauer-Emmett-Teller)比表面积(SBET)、外比表面积(Sext)与内比表面积(Smic)如图10 和表3 所示。Ag-FAU、Ag-EMT、Ag-SOD、Ag-FAU-Nano-2 分子筛晶体是Ⅰ和Ⅳ型混合吸附等温线,同时具有H1 型回滞环,说明样品是微介复合材料。而Ag-FAU-Nano-1、Ag-FAU-Micro-1表现出典型的Ⅰ型吸附等温线,表明样品是同类型的微孔材料。纳米SOD 分子筛的等温线是具有H1型回滞环的Ⅳ型等温线,在低压区没有N2吸附量,只体现出晶间介孔的吸附特征。因为SOD 分子筛的微孔孔径(0.28 nm)远小于N2分子的动力学直径(0.36 nm),所以N2分子筛无法进入SOD 笼。Ag-FAU、Ag-EMT 和Ag-SOD 分子筛的比表面积分别为287、410 和60 m2·g-1,外比表面积分别为204、287、55 m2·g-1。Ag-FAU 和Ag-EMT 展现出较高的比表面积,3 种纳米分子筛均具有较大的外比表面积。而Ag-FAU-Nano-2、Ag-FAU-Nano-1、Ag-FAU-Micro-1分子筛的比表面积分别为259、703、842 m2·g-1,外比表面积分别为211、47、3 m2·g-1,随着FAU 分子筛的晶粒尺寸的增大,分子筛的外比表面积比例逐渐减小,介孔结构比例也逐渐减小。
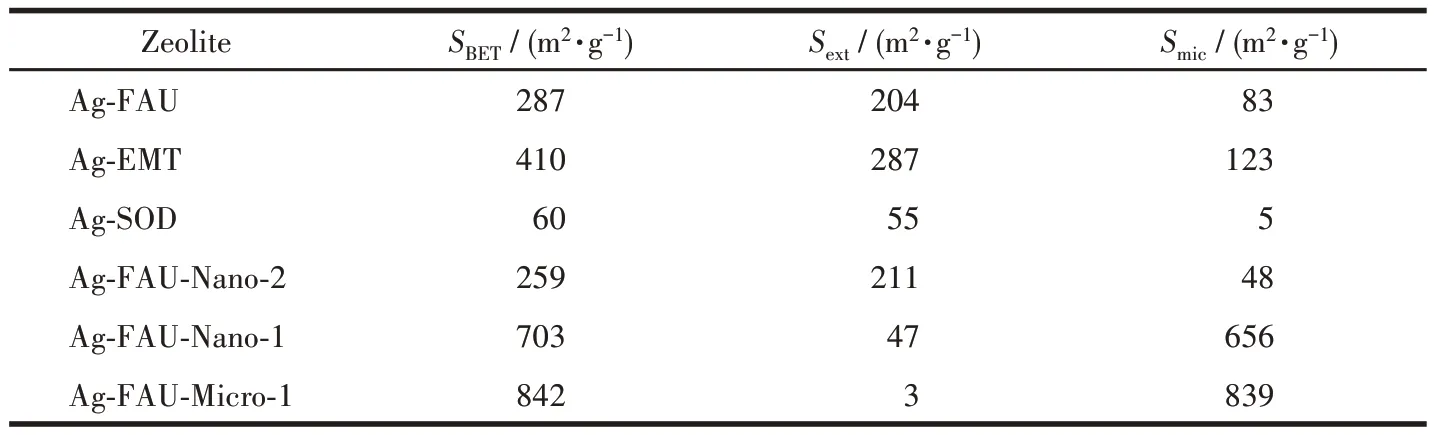
表3 N2吸附-脱附测定分子筛的部分物理性质Table 3 Some physical properties of zeolites determined by N2 adsorption-desorption test
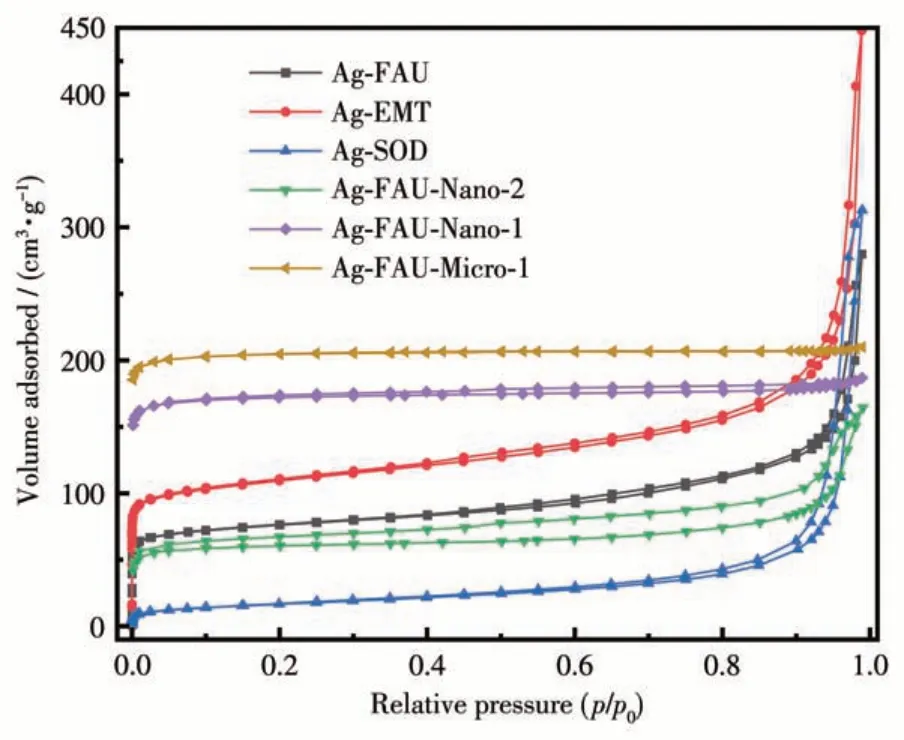
图10 不同载银分子筛的N2吸附-脱附等温线Fig.10 N2 adsorption-desorption isotherms of the silver-loaded zeolites
使用X 射线能谱仪(EDS)对载银分子筛进行Al与Ag 含量(原子分数)表征,如图11 所示,各载银分子筛的Al 原子分数均在12%左右。对比不同种类的分子筛,Ag-SOD 分子筛的载银量较低,仅为4.1%,这可能是因为Ag-FAU 与Ag-EMT 分子筛结构中均存在笼状结构,提高了银离子的储存量,而具有超笼结构的FAU 分子筛载银量略高于EMT 分子筛,证明超笼结构可以提高银离子载量。对比不同晶粒尺寸的载银FAU 分子筛,晶粒尺寸为1 μm 的Ag-FAU-Micro-1 的载银量最低,仅为3%,这可能是因为该载银分子筛的结构非常完整,介孔比例下降,导致外比表面积下降,外表面的羟基与Ag+的结合作用减弱,最终使离子载量下降。因此可以推测载银分子筛的银载量由外表面的羟基数量与内部是否具有笼状结构共同决定。
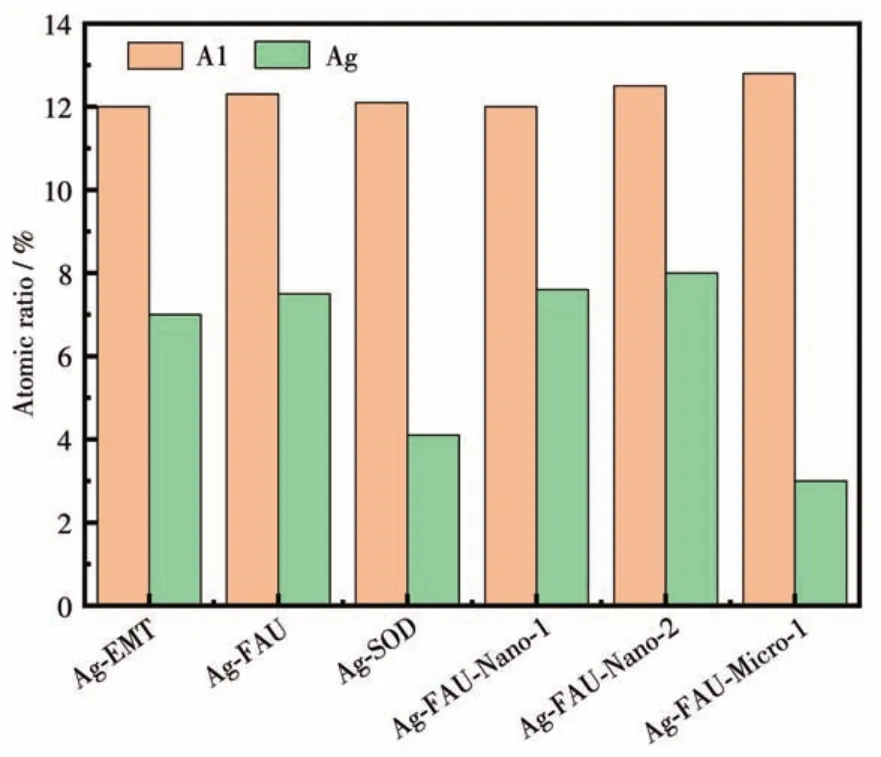
图11 不同载银分子筛的Al与Ag含量对比图Fig.11 Comparison diagram of Al and Ag contents in zeolites with different silver loadings
样品的Ag+释放实验结果如图12 所示,在较短时间(0~2 d)的Ag+的释放后,外比表面积最大的Ag-FAU-Nano-2 在介质中的Ag+浓度最高,而外比表面积最小的Ag-FAU-Micro-1 分子筛的Ag+浓度最低,这说明较大的外比表面积加快了Ag+的释放速率,同时提供了更多的抗菌接触位点,这与抗菌速率的实验结果吻合。在较长时间(4~5 d)的释放后,Ag-FAU-Nano-1 仍可以保持介质中Ag+浓度基本不变,这可能是因为其在载银量较高的同时拥有较大的内比表面积,分子筛笼状结构内负载的Ag+较多,这有助于延长载银分子筛的有效抗菌寿命。虽然在释放实验的过程中介质中的Ag+浓度有所降低。但介质中的Ag+浓度均保持在有效抗菌浓度以上,这可以证明制得的抗菌分子筛均具有较好的理论抗菌能力与应用价值。
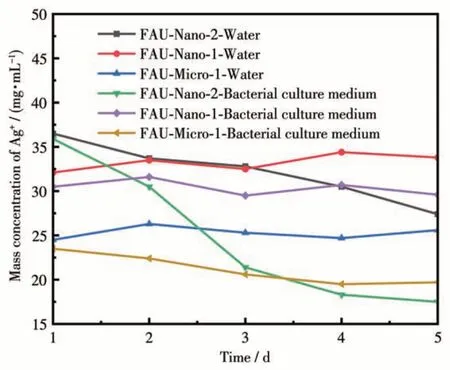
图12 不同载银FAU分子筛的Ag+释放速率对比图Fig.12 Comparison curves of Ag+release rates of FAU zeolites with different silver loadings
表4 总结了本实验所得的各载银分子筛的数据,经过对比可知影响载银抗菌分子筛抗菌性能的因素如下:(1)分子筛内部的笼状结构与外比表面积共同决定分子筛载银量的大小,而超笼结构具有更高的银离子载量;(2)较大的外比表面积在快速释放Ag+的同时提供了较多的杀菌活性位点,加快了载银分子筛的抗菌速率;(3)较大的内比表面积可以提高分子筛笼状结构内的Ag+数量,有效延长载银分子筛的抗菌寿命。

表4 各载银分子筛的实验数据汇总Table 4 Summary of experimental data of silver-loaded zeolites
3 结 论
详细研究了载银分子筛的抗菌性能,证实了负载银离子前后分子筛的相态、形貌与骨架不会发生明显变化,且具有良好的稳定性。探究了分子筛种类、分子筛晶粒尺寸2 种影响因素对负载型分子筛抗菌性能的影响,证实了载银分子筛的载银量由分子筛内部的笼状结构与外比表面积共同决定,较大的分子筛外比表面积可以快速释放Ag+并提供更多的可接触杀菌活性位点,较大的内比表面积则可有效延长载银分子筛的抗菌寿命。晶粒尺寸为100 nm 的FAU 分子筛具有较大的内外比表面积,抗菌性能最优。晶粒尺寸为10~20 nm 的FAU 分子筛由于具有低的内比表面积,抗菌性能次之,但由于其尺寸较小,有利于Ag+快速扩散,其具有最短的杀菌时间和最快的抗菌速率。总之,制备的载银纳米分子筛对大肠杆菌和金黄色葡萄球菌的抗菌性能远超过行业标准,这为设计新型载银分子筛无机抗菌材料提供了借鉴和思路。

