丹参-莪术药对治疗癌性厌食的作用机制*
张甜,宋萌萌,贾文文,乔元勋
1 山东中医药大学 山东济南 250014
2 山东省泰安市中医医院 山东泰安 271000
癌性厌食(cancer-related anorexia,CA)是指与癌症或抗癌治疗相关的食欲减少甚至丧失,伴或不伴体重下降[1]。CA按照病因分为原发性和继发性两类。原发性厌食的具体临床机制尚不清晰。继发性厌食多由于抑郁、便秘、疼痛和接受抗肿瘤治疗等导致[2]。现代医学治疗,尚存在一定的不良反应[3-4],而CA是癌症患者不容忽视的一大症状。
丹参性苦,微寒,归心、肝二经,具有活血祛瘀、通经止痛、清心除烦、凉血消痈的作用。莪术辛苦温,入肝、脾经,具有破血行气、消积止痛之功。大量临床研究表明丹参[5-7]、莪术[8-9]具有抗肿瘤的作用。同时丹参[10]、莪术[11-13]作为复方药物的组成之一,具有改善进食情况的作用,但机制尚不明确。本研究旨在通过网络药理学和分子对接预测丹参与莪术治疗CA的靶点,明确其作用机制,了解其作用原理,为进一步研究丹参—莪术治疗CA提供具体的理论依据。
资料与方法
1 药物成分获取
以“丹参、莪术”为关键词,检索中药系统药理学数据库(TCMSP,http://tcmspw.com/tcmsp.php),按照ADME参数设置化合物分子的口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug likeness,DL)≥0.18进行筛选,获得丹参、莪术的化合物分子,结合文献[14-17]对莪术的化学成分进行补充。
2 药物基因靶点获取
通过TCMSP数据库对获得的丹参、莪术的化合物进行靶点蛋白获取,结合Uniprot数据库(https://www.uniprot.org/)获取对应的基因。文献中获取得到的莪术成分使用PharmMapper数据库(http://lilab-ecust.cn/pharmmapper/index.html),设定条件为物种Human Protein、Norm Fit>0.9,筛选得出对应靶点基因。
3 药物基因可视化分析
去重后利用cytoscape3.8.2软件实施网络可视化分析。
4 疾病基因靶点的获取
以“cancer-related anorexia”为关键词,分别在GeneCards数据库(https: //www.genecards.org/)和OMIM数据库(https: //omim.org/)中筛选,合并去重后得到CA相关的基因靶点。
5 疾病和药物交集基因获取
将疾病基因与药物交集基因输入“微生信”(http://www.bioinformatics.com.cn/),获取韦恩图。
6 疾病—药物蛋白相互作用网络构建(PPI)及可视化分析
将疾病和药物交集基因导出到String数据库(https://cn.string-db.org/),并设定物种为“Homo spanies”,将最低相互作用评分(minimum required interaction score)设置为medium confidence(0.400),并勾选隐藏游离的蛋白质。将结果导出到cytoscape3.8.2软件进行调整。
7 GO富集分析与KEGG富集通路分析
将潜在的基因靶点上传至Metascape数据库(https://metascape.org/)中,选择物种为“H.sapiens”,进行custom analysis。分别得到GO富集分析及KEGG富集通路分析结果。KEGG富集通路分析按照P值进行升序排列;GO分析按logP值进行升序排列,结果利用“微生信”(http://www.bioinformatics.com.cn/)进行可视化展示。
8 核心活性成分-靶点分子对接分析
利用PDB数据库下载关键靶蛋白,从TCMSP数据库中下载核心活性成分的mol2结构,利用Autodock Tools进行去水、加氢、设置旋转键、盲对接等操作,再进行分子对接,最终结果通过pymol进行可视化处理。
结果
1 丹参、莪术化学成分的筛选结果
通过TCMSP数据库,经ADME筛选(OB≥30%,DL≥0.18)、文献补充、筛选后共得到丹参58个有效成分,莪术8个有效成分。见表1。
2 丹参、莪术化学物预测靶点
通过Uniprot数据库、PharmMaper数据库检索对应的基因,丹参58个化合物共有833个基因,莪术8个化合物共有90个基因,利用cytoscape3.8.2软件建立基因靶点与化合物的网络关系图,见图1。
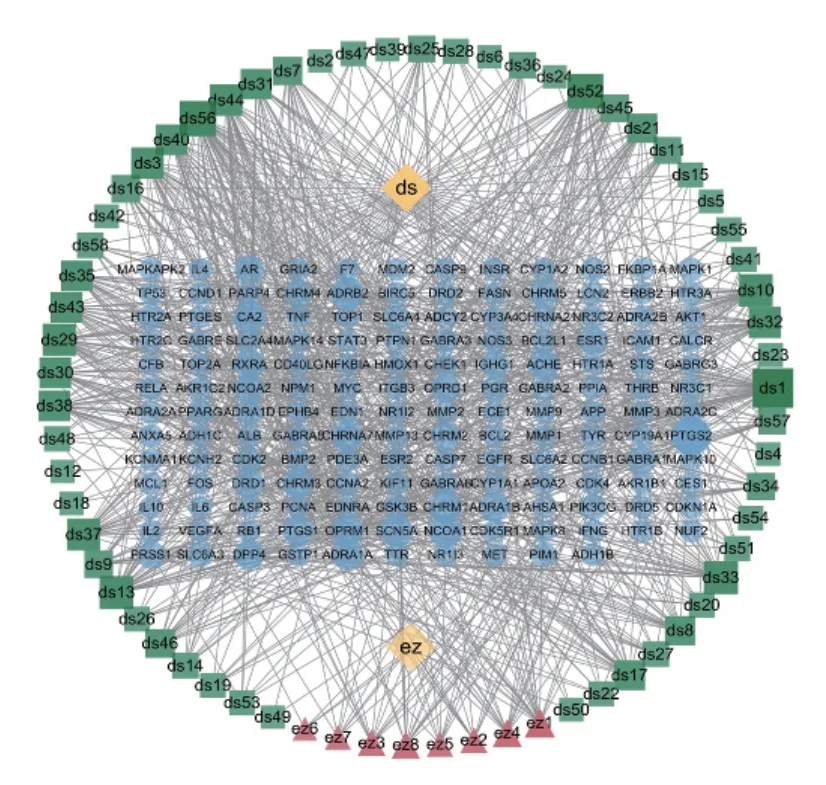
图1 丹参—莪术基因靶点—化合物
3 疾病-药物交集基因
将丹参、莪术的基因靶点去重后得到丹参126个基因,莪术54个基因,并将疾病基因输入微生信网站得到交集基因,丹参-莪术交集基因为25个,CA与丹参-莪术的交集基因为14个。见图2。
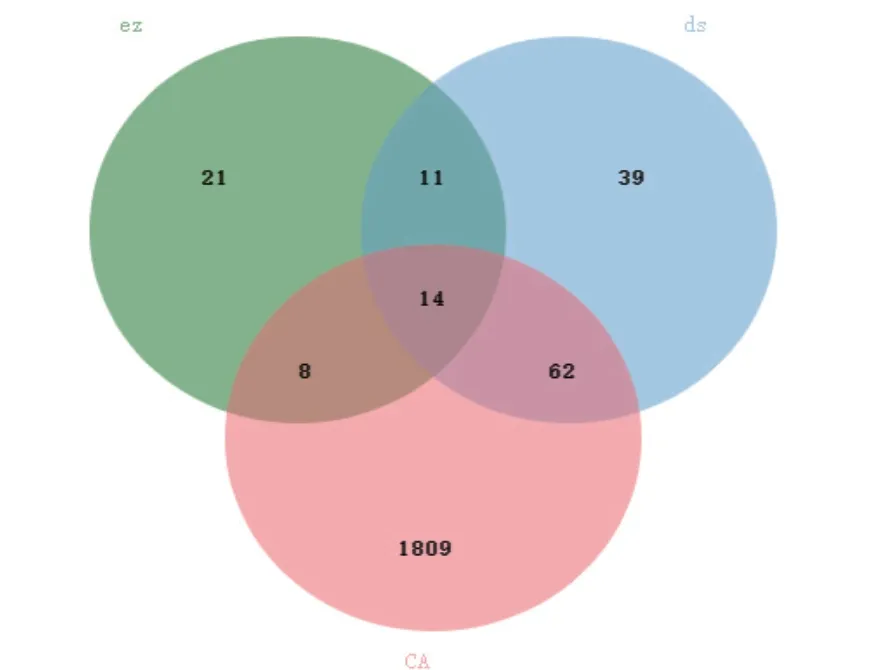
图2 药物-疾病交集基因
4 蛋白互作图
基于String数据库分析“丹参-莪术”与CA靶点之间的交互作用,使用cytoscape3.8.2软件进行数据可视化分析,一个节点代表一个蛋白质,边则代表蛋白相互之间的作用关系,其中1个游离的蛋白质被舍弃,共13个点,22条边。利用Analyse network进行度的分析,度值越大则节点越大,颜色越红,表示“丹参-莪术”通过此靶点治疗CA的可能性越大。边按照combined score进行颜色、粗细调节,颜色越红,线条越粗,表示得分越高,蛋白互作关系越强。见图3、图4。

图3 string原图
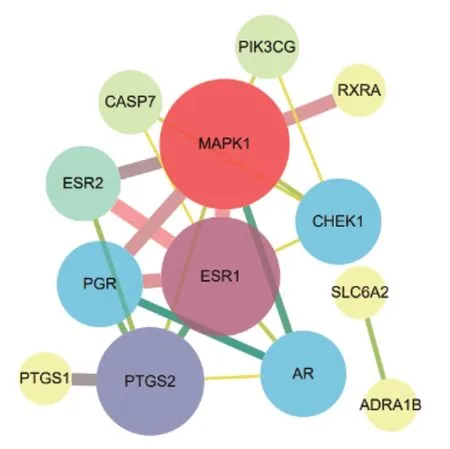
图4 可视化后的PPI网络图
5 GO富集分析
GO分析中按logP值进行升序排列,结果显示生物过程(BP)有83个条目,细胞组分(CC)有4个条目,分子功能(MF)有18个条目。其中BP、MF展示前10个条目,CC展示全部条目。BP主要涉及细胞对有机环状化合物的反应、类固醇激素介导的信号通路、类固醇激素反应等;CC主要涉及膜小凹、膜微区、膜筏、质膜筏;MF主要涉及核受体活性、配体激活的转录因子活性、核类固醇受体活性、类固醇结合等。见图5。

图5 GO富集分析结果
6 KEGG富集通路分析
KEGG富集通路分析结果共得到20条信号通路,包括化学致癌-受体激活通路、癌症信号通路、雌激素信号通路、乳腺癌信号通路、催乳素信号通路、内分泌耐药的信号通路、肿瘤坏死因子信号通路等,按照P值进行升序排列,并将该结果通过微生信网站进行可视化分析。见图6。
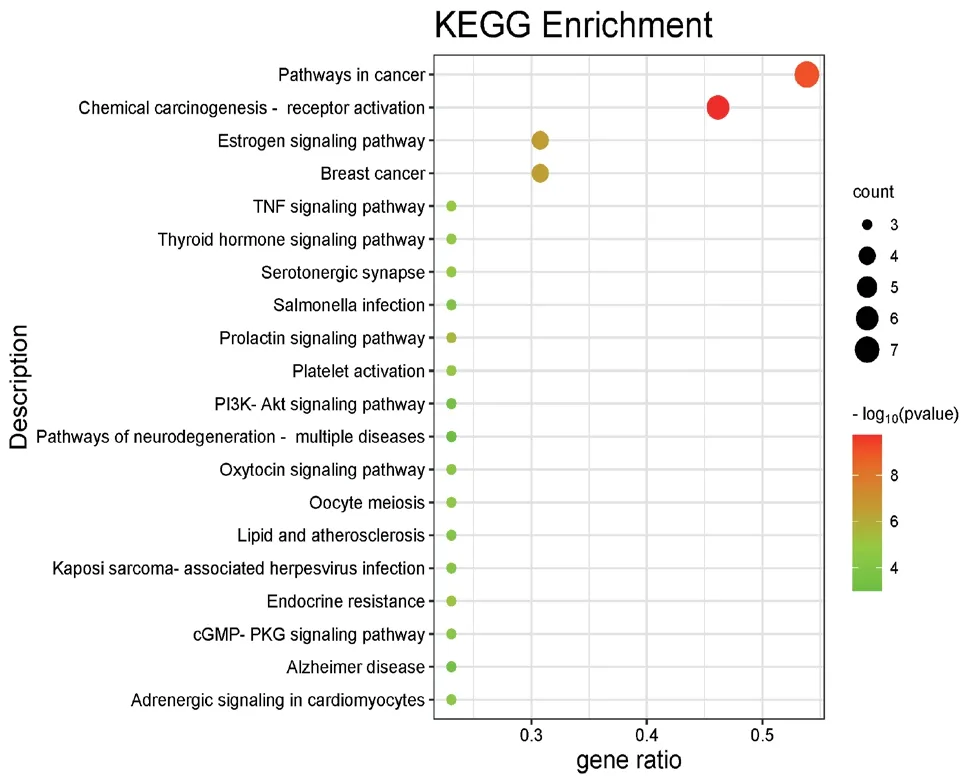
图6 KEGG富集通路分析结果
7 分子对接
通过cytoscape3.8.2软件进行degree筛选,将PPI得出的前2个核心靶点(MAPK1、ESR1)通过PDB数据库转换为受体(3SA0、1XPC),分别与前3个核心成分丹参新醌(dan-shexinkum d,MOL007093)、二氢丹参内酯(dihydrotanshinlactone,MOL007100)、2-异丙基-8-甲基菲-3,4-二酮(2-isopropyl-8-methylphenanthrene-3,4-dione,MOL007041)进行分子对接,对接次数设置为50次。通常认为当结合能<-5kcal/mol时,靶点与药物成分结合较好,具体结合能见表2,其中MOL007100与3SA0、 MOL007093与1XPC、MOL007093与3SA0可见氢键连接。见图7-图9。
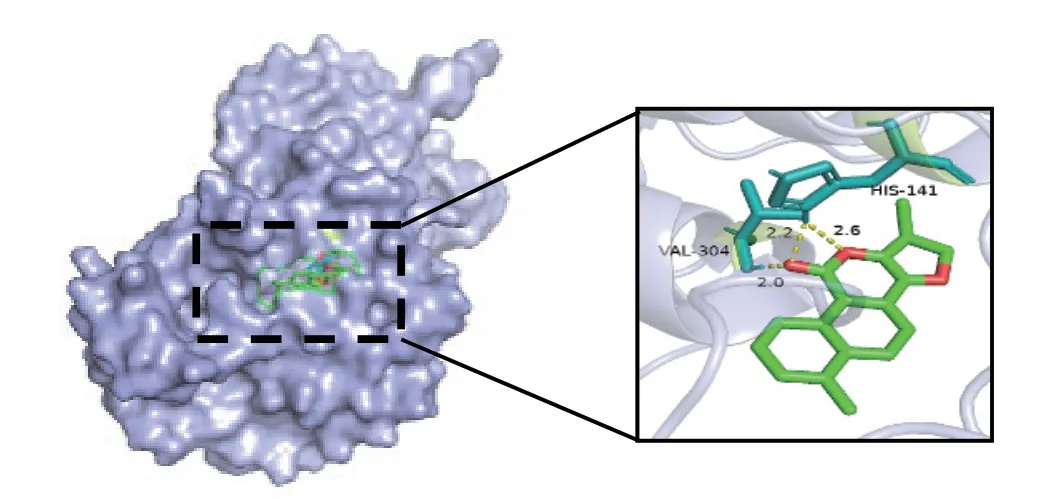
图7 MOL007100-3SA0
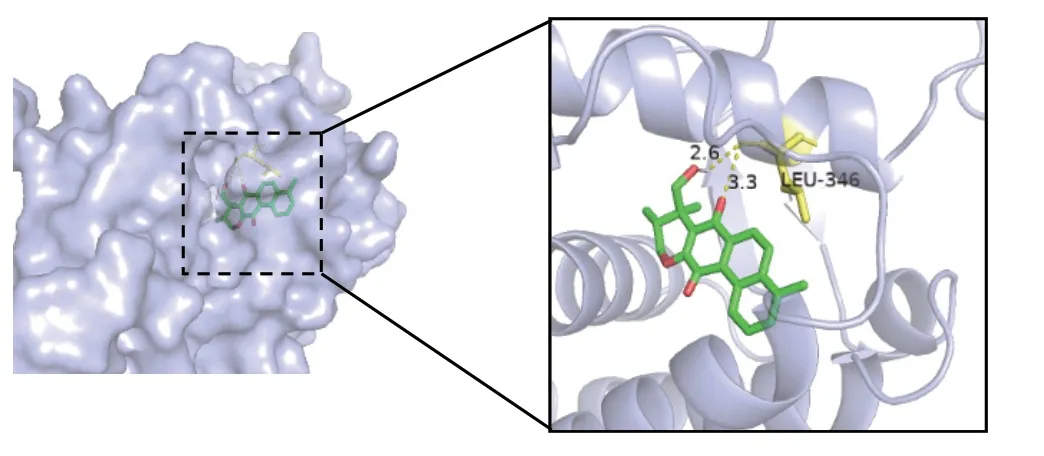
图8 MOL007093-1XPC
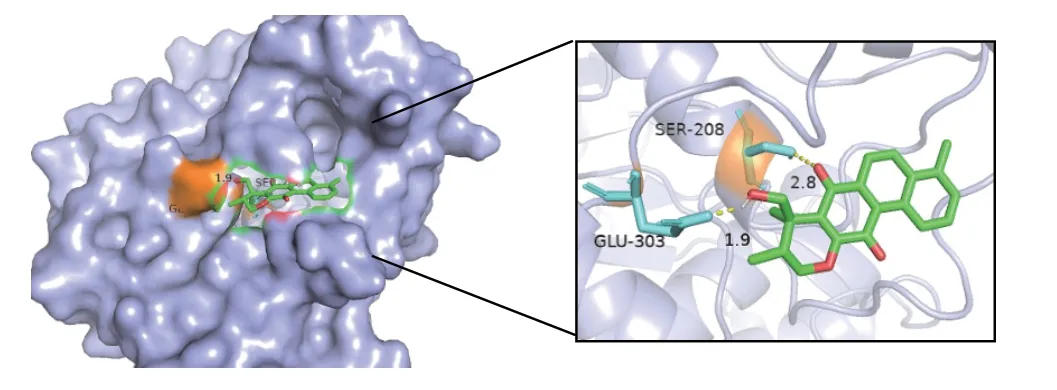
图9 MOL007093-3SA0
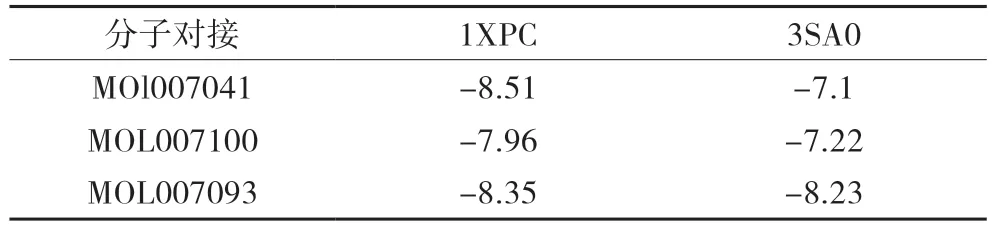
表2 分子对接结合能(kcal/mol)
讨论
CA具有发病率高的特点,是癌症患者常见的伴发症状。但其出现的机制尚不明了,影响因素较多。针对CA,现代医学可采用糖皮质激素、大麻素、醋酸甲地孕酮等药物[18]。而目前中医治疗上主要应用经方、验方、中成药注射剂及中医外治法[19],但缺少指南统一标准。
本研究通过TCMSP数据库及相关文献补充,筛选得出丹参—莪术的活性成分,再由GeneCards、OMIM数据库中得到CA的疾病靶点,后利用String数据库进行蛋白互作分析,并通过cytoscape3.8.2软件进行可视化分析,筛选得到核心靶点,最终进行富集分析及分子对接。结果表明丹参新醌、二氢丹参内酯、2-异丙基-8-甲基菲-3,4-二酮与MAPK1、ESR1有较强的结合能力,在丹参、莪术治疗CA过程中具有重要作用。
MAPK是丝裂原活化蛋白激酶,也是CXC趋化因子的靶标之一[20],趋化因子可结合相应受体,参与肿瘤形成、免疫反应等过程[21],CXCL14作为趋化因子家族成员,参与了体重控制过程,并且可能在中枢神经系统调控摄食行为活动中起到重要作用[22]。胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是由肠道L细胞所产生的激素,具有刺激胰岛素分泌、利尿、减少胃排空、减少炎症和细胞凋亡等作用[23],研究表明GLP-1受体激活能够增加MAPK磷酸化达到抑制食物摄入的目的[24]。同时MAPK1是GATA3转录因子的转录靶标,去泛素化酶USP21可以通过与GATA3结合来调节MAPK1的表达[25]。当血管紧张素Ⅱ1型受体与血管紧张素Ⅱ结合后可激活细胞内MAPK途径以触发钠摄入[26]。另外,通过果蝇实验证明Dop1R2/Raf/MAPK通路是多巴胺信号在食欲嗅觉记忆稳定过程中的关键下游效应子[27],能够以此来稳定食欲和嗅觉的记忆。
ESR1作为编码雌激素受体α(estrogen receptor,ERα)的基因,对于乳腺癌[28]、子宫内膜癌[29]、肝内胆管癌[30]等具有临床意义。ERα作为重要的雌激素受体之一,是调节正常摄食行为、维持正常的能量消耗和脂肪分布必不可少的[31]。ESR1能够调节SLC2A4基因的表达,改变组织胰岛素敏感型葡萄糖转运蛋白4(GLUT4)含量,最终调节血糖[32]。也有研究表明ESR1与限制性神经性厌食有关,但相关的单核苷酸多态性还没有已知的功能,仍需要进一步实验[33]。
KEGG通路富集分析表明丹参、莪术治疗CA可能与雌激素信号通路(Estrogen signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)等有关。雌激素信号通路有助于对抗肿瘤免疫的异常调节,还可能逆转出现免疫抑制的肿瘤微环境[34]。雌激素可以与GLP-1结合形成GLP-1-雌激素偶联物,其存在可以将雌激素特异性递送到表达胰高血糖素样肽-1受体(GLP-1R)的区域[35],而SIM1神经元中的ERα可以部分介导GLP-1-雌激素偶联物,从而发挥减重作用[36]。此外,在已被切除卵巢的大鼠中进行实验,证实雌二醇(E2)具有抑制食物摄入的效力[37]。癌症患者的免疫系统会释放细胞因子,TNF-α作为其中之一,可通过血脑屏障,与大脑内皮细胞管腔表面相互作用,进而导致影响食欲下降的物质的释放[13]。在肿瘤恶病质患者中,血液TNF-α水平也出现显著增高,且与体重稳定组的肿瘤患者相比,肿瘤恶病质患者的皮下脂肪组织中TNF-αmRNA呈现高表达状态[38]。
综上所述,本研究针对丹参、莪术治疗CA的机制、作用靶点、通路进行预测,并运用分子对接进行验证,可知丹参、莪术的前3个核心成分为丹参新醌、二氢丹参内酯、2-异丙基-8-甲基菲-3,4-二酮并通过MAPK1、ESR1核心靶点入手,调节Estrogen signaling pathway、TNF signaling pathway等信号通路,达到改善患者食欲的目的。后续可继续进行实验验证,为进一步研究丹参、莪术治疗CA的临床效果,提供一定的指导意义。

