枸杞多糖的降血糖活性研究
郭峰,董晓婷
锦州医科大学附属第一医院(锦州 121000)
糖尿病(Diabetes mellitus,DM)是一种严重威胁人类健康的慢性代谢疾病,临床表现为无法维持机体正常的血糖水平。“三多一少”,即多食、多饮、多尿和体重减轻。据统计,2017年全球有超过4.25亿人患糖尿病,预计到2045年将达到6.93亿人患病[1]。我国现有糖尿病患者众多,在3 000万人以上。糖尿病主要分为三种类型,即1型糖尿病(T1DM)、2型糖尿病(T2DM)以及其他特殊类型糖尿病(如妊娠糖尿病),其中T2MD最为常见,占糖尿病患者的90%~95%[2]。T2MD的主要病理机制是由于胰岛素抵抗,胰腺β细胞调节的葡萄糖代谢紊乱以及胰岛素受体功能降低所导致[3]。长期处于高血糖会导致氧化应激系统异常,从而引起一系列并发症,如肾脏病变、视网膜病变及心脑血管病变等[4]。目前,已有一些临床药物能起到降糖作用,主要是通过提升外周血胰岛素水平或改善胰岛素抵抗,但长期使用会有严重的副作用,如酸中毒、低血糖及肝脏疾病等[5-6]。因此,从天然药物中筛选出具有降糖功能的活性成分成为了研究热点。近年来,国内外研究者发现多糖具有广泛的生物活性,在抗氧化、抗肿瘤、降血糖、抗炎、免疫调节和降血脂等活性方面取得了重大进展。
枸杞子(Lycium barbarumL.)是一种名贵的药食同源中药,性甘平,具有补肾养阴、耐寒暑、治虚劳消渴之功效。其中含有多糖、黄酮、类胡萝卜素、氨基酸、维生素和微量元素等多种活性成分,常作为补益方剂中的常用药味[7-8]。枸杞多糖(Lycium barbarumpolysaccharides,LBP)是有效的生物活性成分之一,富含多种单糖成分,作用靶点多,具有降血糖的潜在优势[9]。因此,此研究从宁夏枸杞中提取LBP,并探讨LBP的体外降糖活性以及对T2MD大鼠模型在降血糖方面的作用及其机制,旨在为治疗糖尿病的药物和预防糖尿病的保健食品开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料与试剂
50只SPF级健康Wister大鼠(沈阳艾科赛斯生物科技有限公司);宁夏枸杞(宁夏,经锦州医科大学附属第一医院鉴定为茄科植物宁夏枸杞的干燥成熟果实);高脂饲料(沈阳茂华生物科技有限公司);链脲佐菌素(STZ,美国Sigma公司);α-淀粉酶、α-葡萄糖苷酶(上海酶联生物科技有限公司);超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)、过氧化氢酶(CAT)和胰岛素检测试剂盒:合肥莱尔生物科技有限公司。
1.1.2 主要仪器与设备
3000FA酶标仪(上海闪谱科技有限公司);ACCU-CHEK血糖仪(中国罗氏制药有限公司);LD-Y300A高速万能粉碎机(上海顶帅电器有限公司);CT14RD高速冷冻离心机(北京时代离心机有限公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);LRHS-101B-L高低温试验箱(广东宏展科技有限公司)。
1.2 方法
1.2.1 LBP的制备
将枸杞置于65 ℃烘箱中干燥12 h后用粉碎机磨成粉末,过0.180 mm筛。称取30 g干粉,按1∶3(g/mL)加入蒸馏水,于80 ℃提取3 h,重复提取3次,合并提取液,按5 000 r/min离心20 min后取上清液。于50 ℃旋转蒸发至原体积的1/3,采用Sevage法除去提取液蛋白,重复操作直至中间层无白色。然后加入3倍体积无水乙醇,于4 ℃静置沉淀12 h,按5 000 r/min离心30 min后弃去上清液,取沉淀冷冻干燥得到LBP[10]。
1.2.2 体外降血糖活性的测定
α-淀粉酶抑制活性的测定:参考石越等[11]的方法并稍作改动。取LBP,用0.1 mol/L的PBS缓冲溶液配制成质量浓度为0.25,0.5,1.0,2.0,4.0和6.0 mg/mL的样品稀释液,取30 μL。再称取相同体积的1 U/mL的α-淀粉酶溶液置于酶标板中,于37 ℃反应10 min。再加入同体积的1%淀粉溶液混匀,于37 ℃水浴15 min后迅速加入50 μL的DNS溶液终止反应,沸水浴5 min,显色后冰水浴15 min。以阿卡波糖为阳性对照,测定溶液在波长540 nm处的吸光度并计算LBP对α-淀粉酶的抑制率。
α-葡萄糖苷酶抑制活性的测定:参考Xu等[12]的方法并稍作改动。取LBP,用0.1 mol/L的PBS缓冲溶液配制成质量浓度为0.25,0.5,1.0,2.0,4.0和6.0 mg/mL的样品稀释液,取40 μL。再称取相同体积的1 U/mL的α-葡萄糖苷酶溶液置于酶标板中,于37 ℃反应10 min。再加入同体积的5 mmol/L的PNPG溶液混匀,于37 ℃ 水浴5 min后加入100 mL Na2CO3溶液(0.1 mol/L)振摇1 min终止反应。以阿卡波糖为阳性对照,测定溶液在波长405 nm处的吸光度并计算LBP对α-葡萄糖苷酶的抑制率。
1.2.3 建立T2MD大鼠模型
50只Wistar大鼠适应性饲养1周后,将10只大鼠作为正常对照组,喂普通饲料,其余40只大鼠作为T2MD模型组,喂高脂饲料。喂养4周后,将大鼠禁食16 h。模型组大鼠腹腔注射STZ溶液,对照组大鼠注射同等体积的柠檬酸钠缓冲液,连续注射3 d。最后1次注射STZ 72 h后测其空腹血糖值(FBG),考察T2MD大鼠建造模型是否成功。
1.2.4 分组与给药
T2MD大鼠建造模型成功后,将40只T2MD大鼠随机分为四组,分别为模型组、LBP低剂量组(20 mg/kg)、LBP中剂量组(40 mg/kg)、LBP高剂量组(80 mg/kg),并给予对应剂量干预。正常对照组和模型组给予生理盐水干预。各组每日灌胃给药一次,连续干预8周。
1.2.5 大鼠饮水量、体质量(BW)和空腹血糖值(FBG)的测定
灌胃期间,每间隔2周测定1次大鼠的饮水量和体质量。FBG从尾静脉取血进行测定,禁食过夜后进行测定。
1.2.6 口服葡萄糖耐量(OGTT)的测定
在最后一次测定血糖值后,按2 g/kg的剂量给予大鼠葡萄糖溶液,测定服糖后0,30,60和120 min的血糖并计算血糖曲线下的面积(AUC),按式(1)计算。
式中:Gi为各时间点的血糖值[13]。
1.2.7 血清中氧化应激指标的测定
使用SOD、CAT、GSH和MDA检测试剂盒分别测定各含量。
1.2.8 血清中胰岛素释放试验(Ins水平)的测定
使用胰岛素检测试剂盒测定Ins水平。
1.2.9 数据统计与分析
试验数据使用“平均值±标准差”进行表示,选用SPSS 26.0软件进行差异显著性分析(P<0.05)和极显著性分析(P<0.01)处理,Origin 2021绘制图表。
2 结果与分析
2.1 LBP的体外降血糖活性
2.1.1 LBP对α-淀粉酶活性的抑制
LBP可以显著抑制α-淀粉酶的活性,其活性被抑制后可以使碳水化合物的消化过程变缓,进而使餐后血糖浓度的升高变缓[14]。由图1可知,虽然LBP对α-淀粉酶的抑制活性显著低于阿卡波糖,但当LBP浓度大于4 mg/mL时,抑制率超过了90%。当浓度为6 mg/mL时,抑制率达到了92.59%±0.47%。鉴于阿卡波糖是生物合成药物,具有一定的副作用,而天然活性成分LBP对α-淀粉酶活性具有积极的抑制效果,具有作为α-淀粉酶抑制剂成分的潜力。

图1 LBP对α-淀粉酶活性的抑制
2.1.2 LBP对α-葡萄糖苷酶活性的抑制
LBP对α-葡萄糖苷酶活性的抑制机理与α-淀粉酶相似,通过抑制α-葡萄糖苷酶的活性可以使碳水化合物转变为可吸收单糖的速度变慢,从而有效控制餐后血糖水平[15]。由图2可知,随着LBP浓度的增加,其对α-葡萄糖苷酶的抑制率显著增加,但整体抑制率低于阿卡波糖。当阿卡波糖浓度为6 mg/mL时,抑制率为98.44%±0.43%。此时,LBP对α-葡萄糖苷酶的抑制率为92.09%±0.21%,表明LBP对α-葡萄糖苷酶具有较好的抑制能力。
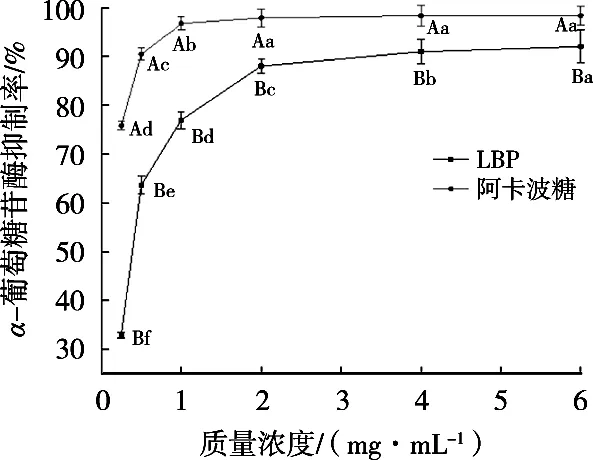
图2 LBP对α-葡萄糖苷酶活性的抑制
2.2 LBP的体内降血糖活性
2.2.1 T2MD大鼠造模情况
对于此次试验建造的T2MD大鼠,注射STZ后测其FBG,测得结果为大鼠的FBG值均在11.1~25 mmol/L之间,视为造模成功。
2.2.2 LBP对T2MD大鼠饮水量的影响
由表1可知,0周时,即未进行LBP干预时,与对照组相比,其他四组的大鼠饮水量均极显著高于对照组(P<0.01)。模型组大鼠的饮水量随着时间的增加而增加,且极显著于对照组(P<0.01)。而LBP三组大鼠的饮水量都逐渐减少,当LBP干预4周时LBP三组大鼠饮水量均显著低于模型组(P<0.05或P<0.01),并逐渐趋于正常。这表明,T2MD大鼠会出现典型的多饮症状,LBP可以明显改善这一症状。
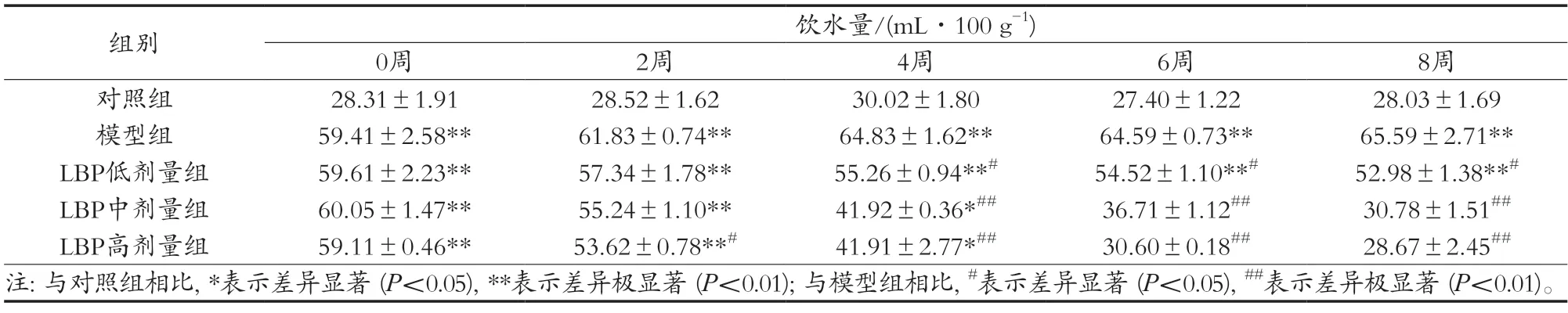
表1 LBP对T2MD大鼠饮水量的影响
2.2.3 LBP对T2MD大鼠BW的影响
由表2可知,在0周时,即T2MD大鼠在被LBP干预前,与对照组相比,其他组的大鼠BW均极显著高于对照组(P<0.01),由于这四组大鼠喂食高脂饲料。在LBP干预过程中,三组大鼠BW均逐渐增加。当LBP干预8周时,LBP中剂量组和高剂量组大鼠的BW显著高于模型组(P<0.05或P<0.01),并且趋于正常,这表明T2MD大鼠会出现体重减轻的症状,LBP对此消瘦症状有一定的改善作用。
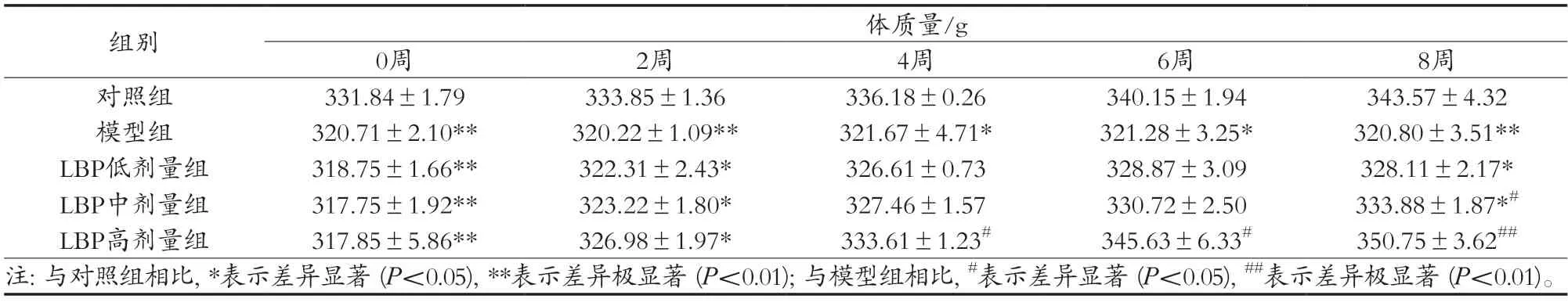
表2 LBP对T2MD大鼠BW的影响
2.2.4 LBP对T2MD大鼠FBG的影响
由表3可知,0周时,即未进行LBP干预时,与对照组相比,其他四组的大鼠血糖值均极显著高于对照组(P<0.01)。模型组大鼠的血糖值均极显著高于对照组(P<0.01),LBP低剂量组在6周时,大鼠血糖显著低于模型组。当LBP干预2周时,LBP中剂量组和高剂量组大鼠血糖显著低于模型组(P<0.05或P<0.01)。当LBP干预8周时。LBP三组大鼠血糖值均极显著低于模型组(P<0.01)。这表明LBP能较好地改善T2MD大鼠的血糖值。

表3 LBP对T2MD大鼠FBG的影响
2.2.5 LBP对T2MD大鼠口服葡萄糖耐量的影响
口服葡萄糖耐量试验(OGTT)是一种用来评估胰岛β细胞功能的葡萄糖负荷试验,被广泛应用于临床确诊T2MD[16]。由图3可知,5组大鼠给予葡萄糖30 min时,血糖值均为最高。T2MD模型组大鼠血糖值极显著高于对照组(P<0.01),表明OGTT异常。LBP高剂量组大鼠的血糖值极显著低于模型组(P<0.01),并且在120 min时恢复正常水平。这表明LBP可极显著抑制大鼠OGTT造成的血糖值的升高(P<0.01)。由图4可知,模型组AUC极显著高于对照组(P<0.01),LBP三组的AUC显著低于模型组(P<0.05或P<0.01),表明LBP能明显改善T2MD大鼠的葡萄糖耐受,并且可以快速降低餐后血糖。

图3 LBP对T2MD大鼠口服糖耐量的影响

图4 LBP对T2MD大鼠AUC的影响
2.2.6 LBP对T2MD大鼠血清中氧化应激水平的影响
由图5可知:与对照组相比,T2MD模型组大鼠血清中的SOD、CAT、GSH水平极显著降低(P<0.01),MDA水平极显著升高(P<0.01),说明模型组大鼠出现了氧化应激状态。与模型组相比,LBP低剂量组大鼠的SOD活性显著升高(P<0.05),LBP中剂量和高剂量组极显著升高(P<0.01),LBP低、中、高剂量组大鼠的CAT和GSH水平均极显著升高(P<0.01),LBP中剂量组和高剂量组极显著降低了MDA水平(P<0.01)。结果表明,LBP可以较好地改善T2MD大鼠的氧化应激反应。

图5 LBP对T2MD大鼠血清氧化应激水平的影响
2.2.7 LBP对T2MD大鼠Ins水平的影响
由图6可知,与对照组相比,模型组大鼠的Ins水平极显著降低(P<0.01),表明大鼠胰岛β细胞功能被破坏,产生了胰岛素抵抗[17]。与模型组相比,LBP三组大鼠的Ins水平显著升高(P<0.05或P<0.01),其中LBP高剂量组大鼠的Ins水平为模型组大鼠的1.54倍,接近对照组水平,恢复了胰岛的功能水平。
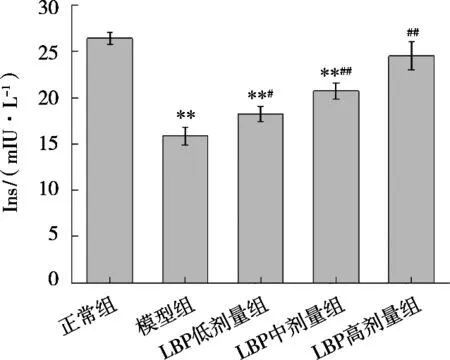
图6 LBP对T2MD大鼠Ins水平的影响
3 结论
在此LBP体外降血糖活性研究中,LBP可以降低α-淀粉酶和α-葡萄糖苷酶活性,对其有一定的抑制作用,在LBP浓度为6 mg/mL时,其对α-淀粉酶和α-葡萄糖苷酶活性的抑制率分别达到92.59%±0.47%和92.09%±0.21%,具有良好的降血糖活性。在动物试验中,与模型组相比,LBP组T2MD大鼠的体质量和饮水量有明显的改善。经LBP干预,LBP组大鼠的空腹血糖值明显低于模型组,120 min后FBG趋于正常,Ins水平明显升高,表明LBP对T2MD大鼠有明显的降血糖活性。LBP干预后的大鼠血清中SOD、CAT和GSH水平均明显高于模型组,有效改善了T2MD大鼠的氧化应激水平,使其能够有效避免胰岛β细胞受损,进而防止T2MD的发生。综上,LBP具有预防或改善T2MD的作用。

