鹿心肽对小鼠急性酒精性肝肾损伤的干预作用
林麒,张群,张继一,贾新傲,唐玉娇
1.长春科技学院生命科学学院(长春 130600);2.吉林农业大学食品科学与工程学院(长春 130118)
过多饮酒会增加相关肝[1]、肾[2]疾病产生的可能。人体通过肝和肾将酒精代谢[3],在代谢过程中,乙醇所产生的代谢反应及醇反应为醛进一步代谢过程中所产生的氧化应激反应及炎症与炎症因子等多因素相互作用,最终可令肝肾产生炎症[4-7]、脏器纤维化[8-10]等一系列问题。西医在治疗酒精引起的肝肾疾病时,常用的治疗药物多伴随其他不良反应及影响,而近来利用小分子活性物质尝试治疗的趋势逐渐增大,其可通过加快影响活性氧及炎症水平的速度,从而减少肝肾疾病的产生或是减缓疾病的恶化[11-15]。对此国内学者尝试利用中草药提取物质,对酒精造成的损伤进行防治工作的建立[16]。梅花鹿作为国内中医长期使用的珍贵药用动物[17],其功能药效在历代医学典籍与现代药典中均有详细记载,而鹿心也已证实具有一定抗氧化的功能药效[18-20]。借助小分子肽具有易转化吸收、活性高、易直接进入细胞等一系列特殊生物学特性,通过提取鹿心小分子物质能加速人类启动自我修复的过程,更利于人体吸收、转化和利用[21],使鹿心的有效物质更有效地预防并作用于酒精对肝肾的损伤。鹿心提取物对急性酒精损伤是否有保护及预防作用尚未有文献报道,因此试验采取由鹿心中提取的小分子肽对酒精造成的肝肾疾病进行干预,并基于对服用鹿心肽的试验动物进行急性酒精肝肾损伤模型的建立[22],检测小鼠肝肾脏生化指标及血液中分子水平,以讨论鹿心肽对小鼠急性酒精性肝肾损伤的干预作用及预防机制。
1 材料与方法
1.1 试剂
乙醛脱氢酶(ALDH)试剂盒(A075-1-1)、超氧化物歧化酶(SOD)试剂盒(A001-3-2)、丙二醛(MDA)试剂盒(A003-1-2),均购自南京建成生物工程研究所有限公司;鹿心(吉林省东鳌鹿业科技开发有限公司);木瓜蛋白酶(P64463-100 g,上海阿拉丁生物科技公司);红星二锅头56°(北京红星股份有限公司);Universal qPCR Master Mix M3003L(10193699,上海金畔生物科技有限公司);Cycle-Script RT Premix(dT20),2204211J,Bioneer。
1.2 仪器与设备
漩涡混合器(XH-C,金坛市白塔新宝仪器厂);恒温振荡器(THZ-98AB,上海一恒科学仪器有限公司);立式压力蒸汽灭菌器(YXQ-LS-50A,上海博讯实业有限公司);冷冻干燥机(17-0618,宁波新芝生物科技股份有限公司);高速离心机(JIDI-20D,广州吉迪仪器有限公司);-80 ℃低温冰箱(DW-SGL388A,青岛海尔特种电器有限公司);Thermal Cycler Dice TP850(Takarabio Inc.,Shiga,Japan);数显恒温四孔水浴锅(BHS-4,宁波市鄞州群安实验仪器有限公司);电子天平[AL204,梅特勒-托利多仪器(上海)有限公司]。
1.3 动物
试验采用C57BL/6J健康昆明种小鼠(SPF级)20只,雄性,体重25~30 g,由吉林大学实验动物中心提供,在GB 14925—2010《实验动物环境及设施》饲养条件下饲养,室温25±1 ℃,相对湿度50%~60%。动物试验在长春科技学院动物伦理福利委员会监督下开展,遵守国家及长春科技学院对于试验动物伦理福利的要求,CKARI202302。
1.4 基因序列(表1)

表1 qRT-PCR引物序列
1.5 方法
1.5.1 鹿心肽提取方法
将鹿心和已对比最适用分解蛋白的酶(木瓜蛋白酶)混合[23],调制成pH 7的溶液,放入温度调至55 ℃恒温培养箱酶解。待酶解7 h后,取出反应物并将其放入100 ℃水浴锅中灭活10 min,在冷却后混合物调pH 7[24],离心、抽滤、旋转蒸发、冷冻干燥至粉末状[25],再通过透析将小分子的鹿心肽成功提取,并再次进行旋转蒸发和冷冻干燥,将鹿心肽以固体的形式储存。
1.5.2 动物模型的建立
小鼠适应性饲喂1周后,将其随机分为4组,即空白组、对照组、鹿心肽低剂量、高剂量组,在13~14 d对对照组及鹿心肽高低剂量组建立急性酒精肝肾损伤模型[26]。其间每组小鼠分别记录当日采食量、饮水量并定期记录排便量。鹿心肽高低剂量组1~13 d每日固定时间灌胃组内小鼠相应浓度的鹿心肽水溶剂(鹿心肽低剂量采用鹿心肽100 mg/kg,鹿心肽高剂量采用鹿心肽200 mg/kg),空白组和对照组1~13 d灌胃对应量双蒸水。对照组、鹿心肽高低剂量组从13~14 d开始灌胃白酒酒精(56°二锅头12 mL/kg),连续2 d。具体给药情况如表2所示。末次给酒后24 h(需禁食12 h)称取体重,注射0.7~0.8 mL麻醉剂,采用心脏采血[27]并在采血后将其处死。

表2 急性酒精性肝肾损伤模型建造
1.5.3 指数计算
在末次给酒后24 h(需禁食12 h)称取小鼠体重,对小鼠进行麻醉,通过心脏采血获取血清,随后处死。取出小鼠肝脏、肾脏,用冰生理盐水冲尽残血,称量器官湿重,计算小鼠的肝脏指数[28](肝脏质量/小鼠体重×100%)及肾脏指数[29-30](肾脏质量/小鼠体重×100%),肝脏指数(hepatosomatic index,HIS)按式(1)计算,肾脏指数(Kidney index)按式(2)计算。
式中:WL为小鼠肝脏湿重,g;WK为小鼠肾脏湿重,g;Wt为小鼠终末体重,g。
1.5.4 鹿心肽对小鼠MDA、ALDH、SOD含量影响检测
解剖前获取血清;解剖后获取肝、肾匀浆,并通过血清检测过氧化脂质降解产物MDA、ALDH、SOD等含量。以上检测盒及检测方法皆由南京建成生物制品工程公司提供。
1.5.5 qPCR检测IL-1β、IL-6和TNF-αmRNA水平
利用Trizol从小鼠冷冻肝肾脏中分离出总RNA。通过制造商提供的说明进行常规定量后反转录得到cDNA,并根据金畔生物科技有限公司提供的基因序列,对目标基因进行定量PCR检测。最终将基因表达标准化为GAPDH,对mRNA的相对定量分析。
1.5.6 统计学处理
试验数据均通过SPSS 25.0统计软件进行统计学处理,所有数据均以“”表示,组间差异比较分析采用单因素方差分析,P<0.01或P<0.05时具有统计学意义。
2 结果与分析
2.1 肝脏指数及肾脏指数
如表3所示,各组小鼠的肝脏指数较空白组小鼠的肝脏指数皆有显著变化,在鹿心肽不同剂量药物注入小鼠体内后,小鼠的肝脏指数对比对照组有显著下降。依据4组小鼠的肝脏指数,推测小鼠在酒精刺激后除生理食欲等影响外,肝脏质量本身也受到酒精的一定影响,可能出现肿大或炎症等症状的发生。结果说明小鼠在经过鹿心肽药物的提前保护后对酒精性肝损伤有一定保护与缓解作用。
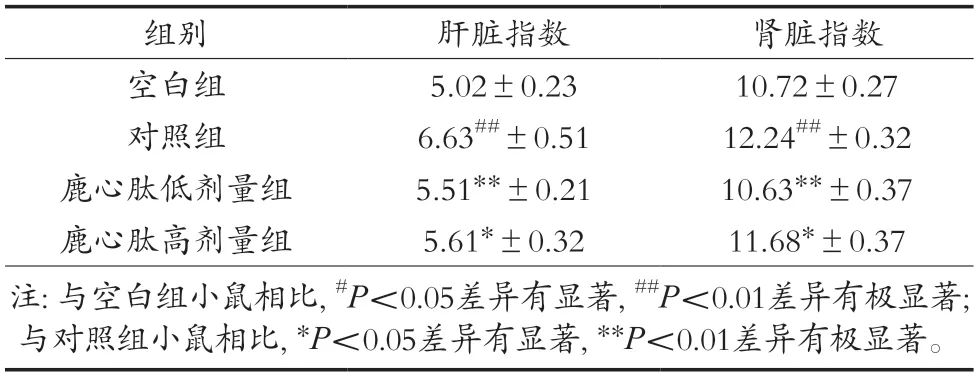
表3 肝肾指数
在肾脏指数的数据方面显示,对照组与空白组和加入鹿心肽药物的2组均有显著差异,而与鹿心肽低剂量组有着极显著差异,表明低剂量的鹿心肽在与降低酒精损伤效果上比高剂量的更佳。
2.2 鹿心肽对酒精损伤后小鼠的SOD含量和MDA含量影响
为探究小鼠在灌胃酒精后体内的氧化应激水平,试验通过测量小鼠血清中SOD和MDA的含量予以对比分析。如图1所示,经酒精灌胃后,对照组小鼠血清中SOD含量与空白组相比有极显著的降低,而获得鹿心肽药物的2组小鼠相对于空白组的表现水平虽有不同程度的降低,但于对照组都更为接近健康水平。同时经过试验得出的数据发现,在酒精的损伤后对照组的MDA含量有显著上升。此外,试验发现高剂量灌胃鹿心肽后的小鼠在MDA含量上与对照组相比,更接近空白组的含量。通过这两项数据表明鹿心肽具有提高酒精性损伤后的抗氧化能力,并减少其他氧化产物的产生。

图1 鹿心肽对酒精性损伤小鼠SOD、MDA的检测结果
2.3 ALDH活性的测定
酒精在进入人体后主要通过血液循环进入脏器,而乙醇代谢主要发生在肝脏中,而乙醇脱氢酶和乙醛脱氢酶作为关键酶,因此两个酶的活性在乙醇代谢途径中起着重要作用,很大程度上表示着肝脏分解酒精的能力。试验通过血清检测(图2)发现,对照组的ALDH活性是显著低于其他组的,而鹿心肽高低剂量组的ALDH活性也与空白组相对接近。说明鹿心肽在一定程度上能够帮助使用者解酒水平在酒后依然更接近正常值。

图2 ALDH活性的测定
2.4 鹿心肽对酒精性肝肾损伤小鼠炎症因子表达的影响
图3和图4显示,对照组的肝肾匀浆中TNF-α、IL-1β、IL-6的mRNA表达水平相对于空白组有显著升高,在小鼠进行鹿心肽灌胃后TNF-α、IL-1β、IL-6的mRNA表达水平对于对照组有显著下降。综上,鹿心肽可能通过调控TNF-α、IL-1β、IL-6的mRNA表达水平影响急性酒精对小鼠肝肾脏的损伤、减轻炎症反应的程度,长期食用鹿心肽能够对酒精性损伤起到一定的预防及保护作用。

图3 小鼠肝脏IL-1β、IL-6和TNF-α mRNA表达水平
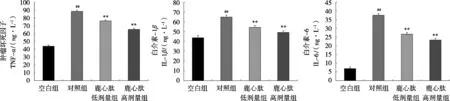
图4 小鼠肾脏IL-1β、IL-6和TNF-α mRNA表达水平
3 结论与讨论
鹿心具有抑制炎症并减轻氧化应激反应的作用,而酒精性肝肾损伤主要是由酒精分解产生的代谢产物引起的代谢紊乱所造成[31],并且刺激肝细胞上游NF-κB通路激活,通过诱导 TNF-α、IL-1β、IL-6等炎症因子的表达进一步引起炎症而造成肝肾的损伤[32]。故试验主要围绕利用鹿心功能以减少氧化应激及炎症的目的,探究并验证鹿心对酒精性肝肾损伤的预防及保护作用功效。采用建造动物急性酒精损伤模型,并在处死小鼠后采得血清及肝肾匀浆,通过血清检测SOD及MDA有关氧化应激的标志物的含量[33-36],利用肝肾匀浆测得炎症因子TNF-α、IL-1β、IL-6表达水平[37-40],并检测ALDH活性值以便确保鹿心的针对性作用及验证模型是否成功建立。
在动物情况观察方面,研究发现在动物行为上鹿心肽高低剂量组的小鼠在给酒后的醒酒时间及酒后所出现的类似于精神萎靡及饮食量减少的情况都显著优于对照组。通过大致比对四组小鼠的建模期间的体重变化发现,鹿心肽低剂量组与空白组的体重变化曲线最为接近,而鹿心肽高剂量组及对照组都受到不同程度的饮食欲望影响。试验在脏器外观上,观察比对肝肾的生理解剖外观图,结果发现对照组的肝脏在酒精的危害下已出现轻微的胶原、糖蛋白堆积和轻微的纤维化及脂肪肝前期症状,颜色发暗等。脏器指数方面,试验通过测量肝脏和肾脏两个脏器指数,结果发现在酒精作用下,对照组在肝肾指数上显著大于其他3组,预测该组发生肿胀或者炎症反应导致指数升高。在指数上,鹿心肽高低剂量组也有一定差异,鹿心肽低剂量组更接近于空白组。试验数据说明鹿心肽具有预防及保护肝肾的作用,但其作用及效果与药物剂量有着联系。
在抗氧化及炎症因子表达的指标中,通过对小鼠进行的血清检测显示,鹿心肽对酒精性损伤小鼠的SOD含量及MDA含量上有明显影响。在SOD含量上的表现空白组优于鹿心肽高剂量组、鹿心肽低剂量组、对照组3组,呈现阶梯式的表现,且在统计方面也具有极显著性。而在MDA的表现水平上鹿心肽高剂量组同样作为其他3组中最好的1组,更接近于健康水平,数据再次表明鹿心肽具有提高酒精性损伤的抗氧化能力,发现药物的剂量也与预防及保护的作用有着极大的关联。对照组中急性酒精建模的小鼠相较于空白组在TNF-α、IL-1β、IL-6水平上表达更加显著,鹿心肽高低剂量小鼠在TNF-α、IL-1β、IL-6的表达水平上皆有极显著性降低。同时此次试验关于ALDH活性的结果显示,对照组ALDH活性显著低于空白组,且鹿心肽高低剂量组在ALDH活性数值上皆于对照组及空白组之间,通过这样的结果不仅代表整个试验建模的成功,且再次表明鹿心肽存在抗氧化作用,对酒精性肝肾损伤具有一定的预防及保护作用。
综上所述,证明鹿心肽对酒精性小鼠肝肾损伤具有一定的预防及保护作用,其主要机制可能是通过在减少炎症和抗氧化等方面发挥作用。然而,鹿心肽作用于酒精的详细机制以及剂量对其影响的确切确定还需要进一步研究加以阐明。

