毛兰素调节Slit2/Robo1信号通路对糖尿病肾病模型大鼠肾小球内皮细胞血管生成的影响
张菊云,陈绵雄,华炳红,蒙绪标
(中南大学湘雅医学院附属海口医院,海南海口 570208)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的常见并发症,其患病率逐年上升,严重影响人类生命和健康,也是终末期肾病的重要因素[1],临床上表现为持续存在白蛋白尿和肾小球滤过率进行性下降[2]。肾小球是由内皮细胞、足细胞和系膜细胞组成的紧密毛细血管簇[3],其中在DN 中肾小球内皮细胞表现为细胞增殖增加、内皮完整性破坏、血管生成不成熟和内皮-间充质转化增加等[4-5]。有研究表明,肾小球内皮细胞增殖和血管生成在DN 早期促进肾小球肥大。此外,一些抗血管生成药物可改善肾小球肥大和高滤过以及DN 早期的白蛋白尿排泄,提示肾小球血管生成可能是DN 早期病理事件的原因[6-7],因此抑制肾小球内皮细胞血管生成将可能成为治疗DN的有效途径。
石斛(Dendrobii Caulis)是中医常用的滋补药材,用于益胃生津、润肺补肾和改善视力等[8]。毛兰素(erianin)是石斛中主要存在的联苄基化合物,可抑制癌细胞侵袭、迁移和血管生成,发挥抗肿瘤作用[9]。研究表明,毛兰素可通过抑制活性氧/丝裂原活化蛋白激酶/NF-κB(reactive oxygen species/mitogen-activated protein kinases/NF-κB,ROS/MAPK/NF-κB)信号通路来阻止高糖诱导的肾小管上皮细胞功能障碍[10],肾小管上皮细胞和肾小球内皮细胞均为构成肾单位的重要细胞类型,但毛兰素对DN中肾小球内皮细胞血管生成的影响尚未阐明。
slit 同源蛋白2(slit homolog 2 protein,Slit2)主要表达于血管内皮细胞和平滑肌细胞,通过与不同的轴突导向受体蛋白(roundabout homolog,Robo)受体结合发挥其生物学功能。Robo1 是Robo 家族成员之一[11-12]。研究报道,抑制Robo1 表达可通过抑制肾小球内皮细胞血管内皮生长因子表达而抑制血管生成,其可能是抑制早期DN 异常血管生成的有效靶点[13]。Slit2/Robo1 信号通路参与血管新生的调控,该通路激活可促进肾小球血管形成和肾单位发育[14],促进早期DN 肾小球血管新生[15]。因此提示,抑制Slit2/Robo1 信号通路可能减轻DN 模型大鼠肾小球内皮细胞血管生成。本研究制备DN模型大鼠,研究毛兰素对DN 模型大鼠肾小球内皮细胞血管生成的影响以及Slit2/Robo1 信号通路的作用,为DN 治疗提供新靶点,并为毛兰素作为DN的候选治疗药物提供实验依据。
1 材料与方法
1.1 药物、试剂和主要仪器
毛兰素(批号:HY-N0517),美国MCE 公司,用0.5%羧甲基纤维素钠配成混悬液;链脲佐菌素(streptozotocin,STZ)(批号:S0130),美国Sigma公司;尿蛋白定量试剂盒(批号:C035-2-1),南京建成生物工程研究所;过碘酸雪夫氏(periodic acidsciff,PAS)染色试剂盒(批号:C0142S)和RIPA 裂解液(批号:R0010),北京索莱宝科技公司;小鼠抗人血小板内皮细胞黏附分子31(platelet endothelial cell adhesion molecule-31,CD31)抗体(批号:3528S)、兔抗人Slit2 单克隆抗体(批号:47600S)、兔抗人3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体(批号:5174S)、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔lgG 抗体(批号:7074S)和HRP 标记的马抗小鼠lgG 抗体(批号:7076S),美国CST公司;兔抗人Robo1多克隆抗体(批号:ab7279),英国Abcam 公司;小鼠抗人足细胞标志蛋白(podocalyxin,PCX)抗体(批号:39-3800),美国Thermo Fisher 公司。Catalyst One®全自动生化分析仪,美国IDEXX 公司;DM2500 荧光显微镜,上海徕卡显微系统有限公司。
1.2 动物、模型制备和分组
55 只雄性SPF 级SD 大鼠,体重180~200 g,购自浙江维通利华实验动物技术有限公司桐乡分公司,动物许可证号:SCXK(浙)2021-0006。大鼠饲养温度23~25 ℃,湿度50%~70%,并在12 h/12 h光暗循环的房间中自由摄食饮水。本研究经海口市人民医院动物伦理委员会批准,伦理审批号:2021034。
大鼠适应性饲喂7 d 后,随机分为正常对照组10 只和模型组45 只。模型组每天饲喂高糖高脂饲料(由10%猪油、10%蔗糖、5%蛋白粉、1%胆固醇和10%普通饲料组成)持续56 d(8周),正常对照组饲喂正常饲料。8周后,模型大鼠禁食12 h,ip给予由枸橼酸缓冲液稀释的1%STZ注射液(35 mg·kg-1),正常对照组ip 给予等体积枸橼酸缓冲液。7 d 后测空腹血糖(fasting plasma glucose,FPG)和24 h尿蛋白,FPG≥16.7 mmol·L-1且24 h 尿蛋白>20 mg,视为DN 大鼠模型制备成功[16]。将造模成功的40只大鼠随机分为模型组、模型+毛兰素10,20 和40 mg·kg-1(ig,持续8 周)[17],每组10 只。正常对照组和模型组每日ig 给予0.5%羧甲基纤维素钠溶液,持续8周。
1.3 样本制备
给药8 周后,留取大鼠24 h 尿液,1000×g离心5 min 取上清,用于尿蛋白检测。大鼠尾静脉采血,4 ℃,1500×g离心10 min 获得血清,置于-80 ℃冰箱备用。采血结束后,处死大鼠,取肾。一部分肾组织用4%多聚甲醛固定;另一部分暂存于-80 ℃,用于Western 印迹实验。
1.4 尿蛋白定量试剂盒检测大鼠24 h尿蛋白水平
取1.3 制备的24 h 尿液上清,按照尿蛋白定量试剂盒说明操作,检测24 h尿蛋白。
1.5 全自动生化分析仪检测大鼠血清FPG 和血肌酐(serum creatinine,Scr)水平
取1.3 制备的血清样本,全自动生化分析仪测定各组大鼠血清FPG和Scr水平。
1.6 PAS染色观察大鼠肾组织病理变化
取1.3制备的经4%多聚甲醛固定的肾组织,固定48 h 后依次进行脱水、包埋、制备4 μm 厚切片。根据PAS 染色试剂盒说明将切片进行染色,光学显微镜下观察各组大鼠肾组织病理变化。
1.7 免疫荧光法检测大鼠肾组织CD31 和PCX 蛋白表达
取1.6 制备的石蜡切片,进行抗原修复,放入3%双氧水溶液,血清封闭,加入一抗(1∶800)(抗CD31 或抗PCX 抗体),4 ℃过夜孵育,加入HRP 标记二抗(1∶4000),37 ℃孵育1 h,3,3′-二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色,复染,封片,荧光显微镜下观察和拍照。红色表示CD31表达,绿色表示PCX 表达。每组选3 张切片使用Image J软件分析荧光强度,用荧光强度表示CD31和PCX蛋白相对表达水平。
1.8 Western印迹法检测大鼠肾组织Slit2和Robo1蛋白表达
取1.3 中暂存于-70 ℃的肾组织,剪成小碎块加入RIPA 裂解液,提取蛋白,BCA 法定量蛋白,电泳,转膜,5%脱脂乳封闭2 h,一抗(Slit2,1∶1000;Robo1,1∶1000;GAPDH,1∶1000)4 ℃孵育过夜,室温孵育二抗(1∶1000)1 h,ECL 曝光。用Image Lab™软件分析蛋白条带积分吸光度值,以目标蛋白与内参蛋白积分吸光度值比值表示目标蛋白相对表达水平。
1.9 统计学分析
实验结果数据用±s表示,用Graphpad Prism7.0 软件进行统计学分析。多组间比较用单因素方差分析,两两比较采用LSDt检验。P<0.05为差异具有统计学意义。
2 结果
2.1 毛兰素对糖尿病肾病模型大鼠血清FPG 和Scr水平及尿液中24 h尿蛋白水平的影响
表1 结果显示,与正常对照组相比,模型组大鼠FPG、Scr和24 h尿蛋白水平显著升高(P<0.01);与模型组比较,模型+毛兰素10,20和40 mg·kg-1组大鼠FPG、Scr和24 h尿蛋白水平明显降低(P<0.01)。

Tab.1 Effect of erianin on fasting plasma glucose(FPG),serum creatinine(Scr)and 24 h urine protein levels in urine of diabetic nephropathy(DN)model rats
2.2 毛兰素对糖尿病肾病模型大鼠肾组织病理变化的影响
图1 结果显示,正常对照组大鼠肾小球结构清晰,形态正常;模型组可见许多新生肾小球毛细血管,并出现肾小球肥大和系膜面积扩张;模型+毛兰素10,20 和40 mg·kg-1组大鼠新增肾小球毛细血管、肾小球肥大和系膜面积扩张现象减轻。
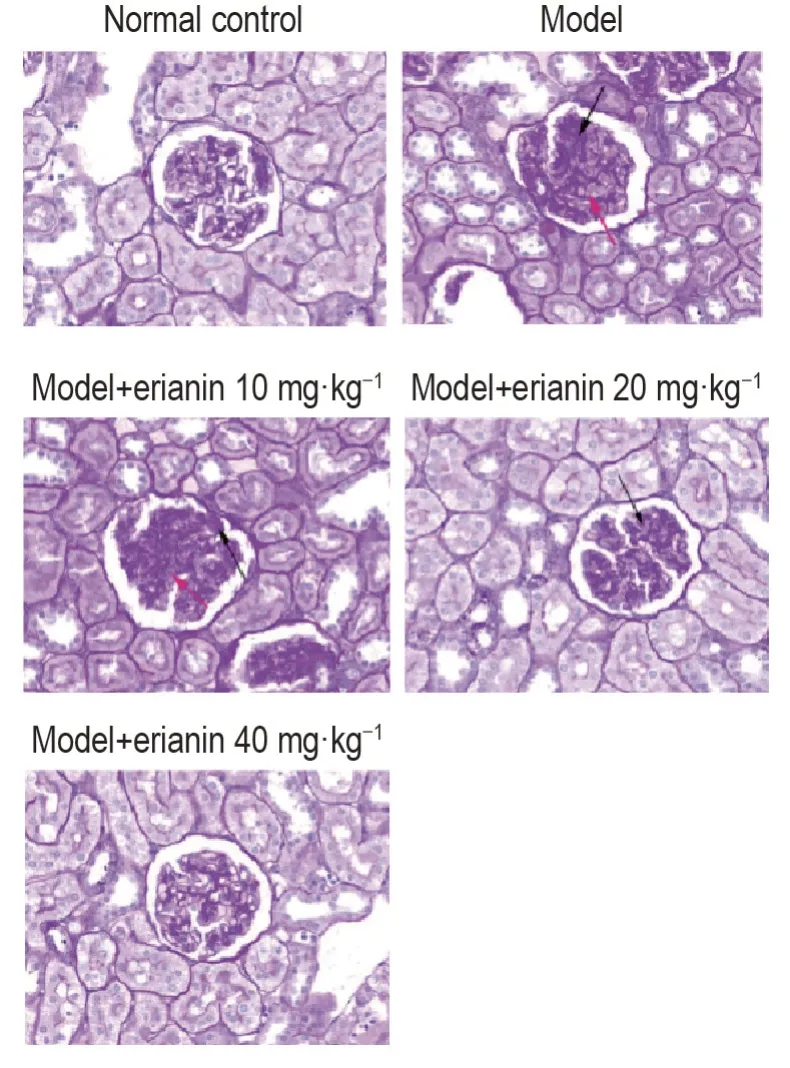
Fig.1 Effect of erianin on pathological changes in renal tissue of DN model rats(HE staining,×400). See Tab.1 for the rat treatment. Black arrows show neoplastic glomerular capillaries while red ones show glomerular hypertrophy and expansion of the tethered membrane area.
2.3 毛兰素对糖尿病肾病模型大鼠肾组织中CD31表达的影响
图2结果显示,与正常对照组比较,模型组大鼠CD31 在肾小球内皮中表达增加(P<0.01);与模型组比较,模型+毛兰素10,20 和40 mg·kg-1组大鼠CD31在肾小球内皮中表达减少(P<0.05,P<0.01)。
2.4 毛兰素对糖尿病肾病模型大鼠肾组织中CD31和PCX共表达的影响
图3 结果显示,正常对照组CD31 染色管状区域和相邻的PCX 染色程度相当;模型组大鼠存在非管状CD31 染色,缺少相邻PCX 染色,以及部分CD31 管状区域染色也缺乏相邻的PCX 染色;模型+毛兰素10,20 和40 mg·kg-1组大鼠CD31 管状区域染色与PCX足细胞区域染色基本相邻。

Fig.3 Effect of erianin on CD31 and podocalyxin(PCX)co-expression in renal tissue of DN model rats(×1000).See Tab.1 for the rat treatment.Cells stained red were CD31 positive and cells stained green were PCX positive.
2.5 毛兰素对糖尿病肾病模型大鼠肾组织Slit2 和Robo1蛋白表达的影响
图4结果显示,与正常对照组比较,模型组大鼠肾组织Slit2和Robo1蛋白表达明显升高(P<0.01);与模型组相比,模型+毛兰素10,20 和40 mg·kg-1组大鼠肾组织Slit2 和Robo1 蛋白表达明显降低(P<0.05,P<0.01)。

Fig.4 Effect of erianin on expressions of slit homolog 2 protein(Slit2)and roundabout homolog1(Robo1)proteins in renal tissue of DN model rats by Western blotting. See Tab.1 for the rat treatment.B was the semi-quantitative result of A.IA:integrated absorbance.±s,n=10.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
3 讨论
本研究结果表明,DN 模型大鼠出现早期DN 的特征性变化,如多食多尿、白蛋白尿排泄增加和肾小球肥大;毛兰素可显著抑制DN 模型大鼠FPG、Scr 和24 h 尿蛋白水平,减轻肾小球肥大和系膜面积扩张,表明毛兰素在DN 中具有肾保护作用。免疫荧光染色结果显示,DN 模型大鼠肾小球内皮CD31 显著增加,毛兰素可下调CD31 表达。内皮细胞CD31 染色和足细胞PCX 染色的双重标记结果显示,DN 模型大鼠存在非管状CD31 染色,缺少相邻PCX 染色,一些CD31 管状区域也缺乏相邻的PCX 染色,这2 种类型的肾小球血管在结构上显示出肾小球血管发育不成熟;毛兰素可显著改善该现象,表现为大多数CD31 内皮区域染色与PCX 足细胞区域染色相邻,提示毛兰素可抑制DN 模型大鼠肾小球内皮细胞血管生成,减少不成熟血管的生成,从而减少蛋白尿产生。
研究报道,Slit2/Robo1信号通路在血管生成中发挥作用[18]。Slit2 通过Robo1 和Robo2 介导促进内皮细胞迁移,在小鼠出生后视网膜和眼部新生血管疾病模型中有选择地促进血管生成,推测抑制Slit2 可能用于抑制眼部新生血管疾病患者的血管生成[19]。另有研究报道,Slit2/Robo1信号通路参与暴露于糖尿病样环境的肾小球内皮细胞的血管生成[10],从而推测毛兰素可能通过抑制Slit2/Robo1信号通路而抑制肾小球内皮细胞血管生成。本研究结果表明,DN 模型大鼠肾组织中Slit2 和Robo1蛋白表达显著升高,毛兰素显著降低DN 模型大鼠肾组织中Slit2和Robo1蛋白表达,提示毛兰素可能通过抑制Slit2/Robo1 信号通路从而抑制DN 模型大鼠肾小球内皮细胞血管生成。
综上所述,本研究表明,DN 早期出现过度的肾小球内皮细胞增殖和血管生成,这种现象导致新形成的肾小球毛细血管可能是有缺陷的未成熟血管,结构缺陷导致这些血管的通透性增加,并可能导致白蛋白尿。毛兰素可能通过抑制Slit2/Robo1 信号通路而抑制DN 模型大鼠肾小球内皮细胞血管生成,推测毛兰素对DN 肾小球内皮细胞增殖和新生血管形成有治疗作用。但本研究尚存在不足之处,仅探究信号通路中Slit2 和Robo1 蛋白表达,未进一步检测该通路上下游相关蛋白表达。后续将通过检测该通路上下游蛋白表达,并增加功能实验进一步研究Slit2/Robo1信号通路在毛兰素抑制肾小球内皮细胞血管生成中的作用,以阐明毛兰素的作用机制。

