MRI 影像组学预测非特殊型浸润性乳腺癌分子分型的价值
张丁懿,黄小华,沈梦伊,张丽,何欣
0 引言
乳腺癌是目前女性最常见的恶性肿瘤,其发病率呈每年递增的趋势,且是女性死亡的主要原因之一[1]。非特殊型浸润性乳腺癌是乳腺癌中最常见的类型,约占乳腺癌的70%~80%[2],是高度异质性肿瘤,其预后效果更差。非特殊型浸润性乳腺癌治疗方式主要由分子分型决定,Luminal 型是乳腺癌数量占比最大的分子分型,以内分泌治疗为主,预后相对较好;非Luminal型对内分泌治疗不敏感且肿瘤分化级别高、总体预后差,治疗方式需根据情况采用靶向治疗、化疗或放疗[3-5]。Luminal 型和非Luminal 型的分子分型取决组织病理结果的免疫组化[6-7],但该方法有创,且有假阴性结果的干扰[8-9]。因此寻求一种准确、无创预测分子分型的方法至关重要。目前乳腺肿瘤磁共振成像研究较多[10-12],但多聚焦在乳腺癌的定性及治疗预后价值评估,关于乳腺癌分子分型的研究相对较少,且多基于单一序列预测分子分型,鲜有探讨双序列的预测价值[13-14],其中未见有关基于动态对比增强(dynamic contrast-enhanced, DCE)-MRI 和扩散加权成像(diffusion weighted imaging,DWI)联合影像组学预测非特殊型浸润性乳腺癌Luminal型和非Luminal分型的研究。本文回顾性分析149例非特殊型浸润性乳腺癌患者的DCE-MRI和DWI 的影像资料,旨在探讨基于MRI 影像组学在非特殊型浸润性乳腺癌中Luminal型和非Luminal型分类的预测价值,为临床对乳腺癌患者的分子分型的确定以及治疗方案的选择提供一定的帮助。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,经川北医学院附属医院医学伦理委员会批准,免除受试者知情同意,批准文号:2023ER149-1。回顾性分析2021 年4 月至2022 年12 月在本院经病理证实的261 例乳腺癌患者的临床及MRI影像资料。
纳入标准:(1)经手术或穿刺病理证实为非特殊型浸润性乳腺癌的患者;(2)肿瘤病灶原发于乳腺;(3)具有完整的病理及免疫组化结果;(4)MRI 检查前未进行过穿刺活检、手术切除、放疗或化疗等治疗;(5)进行了DCE-MRI 序列、DWI 序列扫描。排除标准:(1)图像质量差,无法达到分析要求;(2)临床资料不全。
经纳入、排除标准筛选后,最终纳入149 例乳腺癌患者,其中Luminal 型90 例,非Luminal 型59 例。年龄24~84(中位数为52)岁。患者筛选流程如图1所示。
1.2 设备与方法
联影UMR790 3.0 T MR 扫描仪,10 通道乳腺专用相控阵线圈。俯卧位,头先进,双侧乳腺自然悬垂于乳腺线圈内,定位中心对准线圈中心及两侧乳头连线。扫描范围包括双侧乳腺、腋窝。所有患者均进行横断面T1WI多期DCE-MRI(TE 2.17 ms,TR 5.15 ms,层厚1.0 mm,视野340 mm×340 mm,矩阵336×100,层数128层)和横断面DWI(TE 66 ms,TR 4 000 ms,层厚4.0 mm,视野350 mm×190 mm,矩阵192×100,层数24 层,b 值分别取50 s/mm2和800 s/mm2)。注射对比剂前先扫描一期蒙片像,然后高压注射器经肘正中静脉注射Gd-DTPA(佳迪显,江苏恒瑞医药股份有限公司),剂量0.2 mmol/kg,流率为2.5 mL/s,之后以相同速率团注生理盐水20 mL,注射后开始连续扫描8期,每期69 s,总扫描时间为9 min 36 s。
1.3 免疫组化及分子分型标准
根据美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)和美国病理学家学会(College of American Pathologists, CAP)发布的乳腺癌雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)免疫组化检测指南[15],将ER、PR 阳性定义为肿瘤细胞核着色数量≥1%;ER、PR 阴性定义为在有阳性内对照的情况下,肿瘤细胞核着色的数量<1%。
以《中国抗癌协会乳腺癌诊治指南与规范》(2021 年版)为参考标准[16],根据ER/PR 表达状态,将所有病例分为2 种类型:(1)Luminal 型,ER、PR 均为阳性;(2)非Luminal型,ER、PR均为阴性。
1.4 图像分割及影像组学特征提取
使用3D slicer( (version 5.0.3,https://www.slicer.org/)对感兴趣区(region of interest, ROI)进行勾画及特征提取(图2)。由两名具有7 年以上乳腺MRI 诊断工作经验的影像科医师(主治医师)在不知晓患者分子分型的前提下,在DCE-MRI 序列中增强后的第二期相和DWI 序列中的高b 值(b=800 s/mm2)DWI图像上对乳腺肿瘤进行逐层勾画,得到感兴趣体积(volume of interest, VOI)。同一患者多灶或多中心肿瘤仅纳入直径最大的病变。使用基于Python 的radiomics 从ROI 中提取7 个常见特征组,共计1 223个特征被提取。

图2 女,57岁,Luminal型乳腺癌,ER 阳性(约90%),PR 阳性(约60%)。2A~2B 为DWI序列的原始图像以及感兴趣区勾画示意图;2C~2D 为DCE序列的原始图像以及感兴趣区勾画示意图。ER:雌激素受体;PR:孕激素受体;DWI:扩散加权成像,DCE:动态对比增强。Fig.2 A 57-year-old female with Luminal breast cancer is ER positive (about 90%) and PR positive (about 60%).2A-2B are the original images of DWI sequence and sketches of the region of interest; 2C-2D are the original images of DCE sequence and the sketch of the region of interest.ER: estrogen receptor; PR:progesterone receptor; DWI: diffusion weighted imaging; DCE: dynamic contrast-enhanced.
1.5 观察者间的一致性检验
从全部对象中随机抽取DCE 序列图像和DWI序列图像各约1/3,再由两名医师同时勾画ROI 并提取影像组学特征,勾画后提取的数据采用组间相关系数(inter-class correlation coefficient, ICC)检验观察者间的一致性,剔除ICC 值≤0.75 的特征,保留ICC值>0.75,被认为具有较好一致性和稳定性的特征数据。最终DCE-MRI 序列保留1 023 个特征,DWI 序列保留1 094个特征,其余被排除。
1.6 特征选择及模型建立
采用联影uAI Research Portal(V730)软件进行特征筛选、模型建立及内部测试。将数据Z分数归一化后,使用方差阈值法(variance threshold, VT),保留方差值大于0.8的特征;使用K 最佳(selectKBest)、最小绝对收缩与选择算子(least absolute shrinkage and selection operator, LASSO)进行特征筛选(图3、图4)。DCE 序列共筛选出6 个特征,分别是2 个灰度区域大小矩阵特征,4个一阶特征。DWI序列共筛选出6 个特征,分别是1 个灰度区域大小矩阵特征,1 个灰度依赖矩阵特征,2个邻域灰度差矩阵特征,1个灰度共生矩阵特征,1个一阶特征。

图3 DWI 序列LASSO 特征筛选图。图4 DCE 序列LASSO 特征筛选图。DWI:扩散加权成像;DCE:动态对比增强;LASSO:最小绝对收缩与选择算子。Fig.3 LASSO feature screening diagram of DWI sequence.Fig.4 LASSO feature screening diagram of DCE sequence.DWI: diffusion weighted imaging; DCE: dynamic contrast-enhanced; LASSO: least absolute shrinkage and selection operator.
用随机森林法将这些影像特征建立起三个模型,分别是DCE 序列的6 个特征模型、DWI 序列的6 个特征模型以及联合序列模型。绘制出各模型的ROC曲线、校正曲线以及决策曲线。
将149 例患者按7∶3 比例随机分为训练组和测试组,训练组104 例(Luminal 型41 例,非Luminal 型63 例),测试组45 例(Luminal 型27 例,非Luminal 型18 例)。在训练组中进行模型的训练,并在测试组中进行模型性能验证。
1.7 统计学分析
采用SPSS(V26.0,IBM,美国)软件和R 语言对数据结果进行统计分析。计量资料中满足正态分布的以xˉ±s表示,采用两独立样本t检验进行两组间比较;计量资料中不满足正态分布的以中位数(Q25,Q75)表示,采用两独立样本曼-惠特尼秩和检验进行两组间比较;计数资料采用例数表示,使用χ2检验进行两组间比较。通过绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算ROC 曲线下面积(area under the curve, AUC)、敏感度、特异度、准确度并评价各模型预测非特殊型浸润性乳腺癌Luminal型和非Luminal型的效能,利用DeLong 检验分析各模型AUC差异是否具有统计学意义。使用校正曲线评估模型的拟合优度,利用决策曲线分析模型的临床净收益。双侧P<0.05 被认为差异具有统计学意义。
2 结果
2.1 Luminal型和非Luminal型患者间临床资料比较
两组间患者在年龄、绝经状态、淋巴结转移情况的差异均无统计学意义(P>0.05)(表1)。根据病理组织活检结果判定是否淋巴结转移。

表1 Luminal型和非Luminal型患者间临床资料比较Tab.1 Comparison of clinical data between patients with Luminal and non-Luminal subtype
2.2 训练组和测试组患者间临床资料比较
两组间患者在年龄、ER、PR、绝经状态、淋巴结转移情况的差异均无统计学意义(P>0.05)(表2)。

表2 训练组和测试组患者间临床资料比较Tab.2 Comparison of clinical data between training group and test group
2.3 三种影像组学模型预测效能的评估
以训练组104 例,测试组45 例,共149 例患者为样本建立模型。三个模型训练组、测试组的AUC、敏感度、特异度、准确度评分见表3。在训练组中,DWI、DCE、联合序列的AUC 值分别为0.859、0.839、0.903,在测试组中,DWI、DCE、联合序列的AUC 值分别为0.722、0.798、0.821(图5、图6)。DeLong 检验显示训练组的DCE模型和联合模型之间的预测效能有统计学意义(P=0.03),除此之外三个模型两两比较预测效能差异均无统计学意义(P>0.05)。

表3 三种影像组学模型效能比较Tab.3 Comparison of three radiomics models
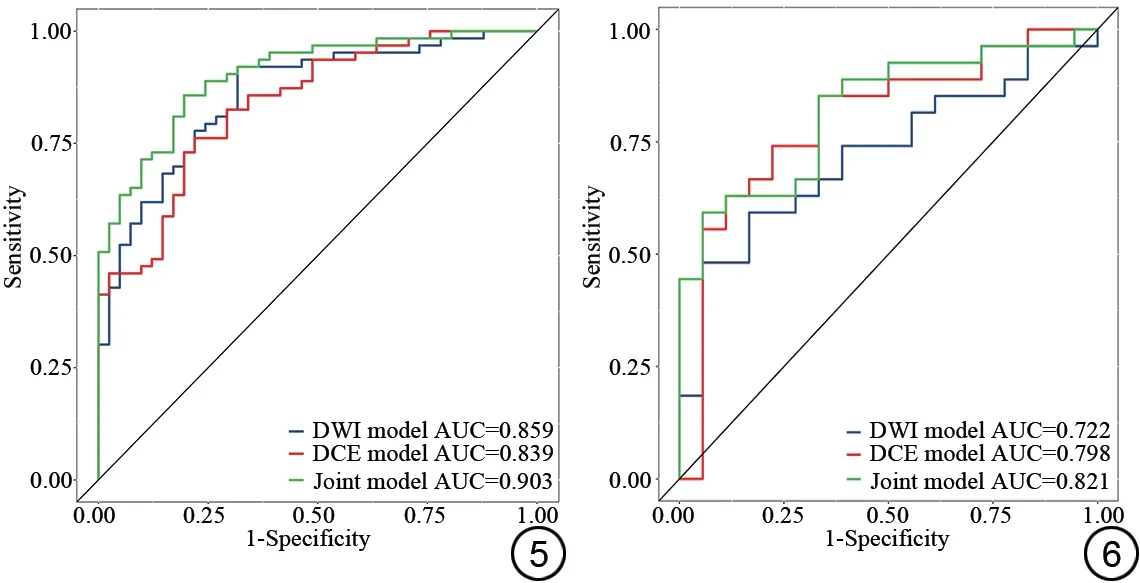
图5 三种模型训练组的受试者工作特征(ROC)曲线以及曲线下面积(AUC)值。 图6 三种模型测试组的受试者工作特征(ROC)曲线以及曲线下面积(AUC)值。DWI:扩散加权成像;DCE:动态对比增强。Fig.5 Receiver operating characteristic (ROC) curve and area under the curve (AUC) values of training groups in the three model.Fig.6 Receiver operating characteristic (ROC) curve and area under the curve (AUC) values of test groups in the three model.DWI: diffusion weighted imaging; DCE:dynamic contrast-enhanced.
校正曲线(图7)显示,DWI 模型、DCE 模型以及联合模型的Brier 系数在训练组中分别为0.165,0.173,0.148,在测试组中分别为0.216,0.185,0.185。Brier 系数值越接近于0,模型的预测校准性能越好,验证了模型预测值和实际观察值拟合度良好。从决策曲线分析可看出,当训练组阈值概率大于0.20、测试组阈值概率大于0.35时,DWI模型、DCE模型以及联合模型的临床净收益均较高(图8)。

图7 模型的校正曲线。7A~7C 分别为DWI模型、DCE模型、联合模型训练组的校正曲线;7D~7F 分别为DWI 模型、DCE 模型、联合模型测试组的校正曲线。DWI:扩散加权成像;DCE:动态对比增强。Fig.7 Calibration curve of the models.7A-7C are the calibration curves of DWI model, DCE model and joint model training group respectively;7D-7F are the calibration curves of DWI model, DCE model and joint model test group respectively.DWI:diffusion weighted imaging; DCE:dynamic contrast-enhanced.
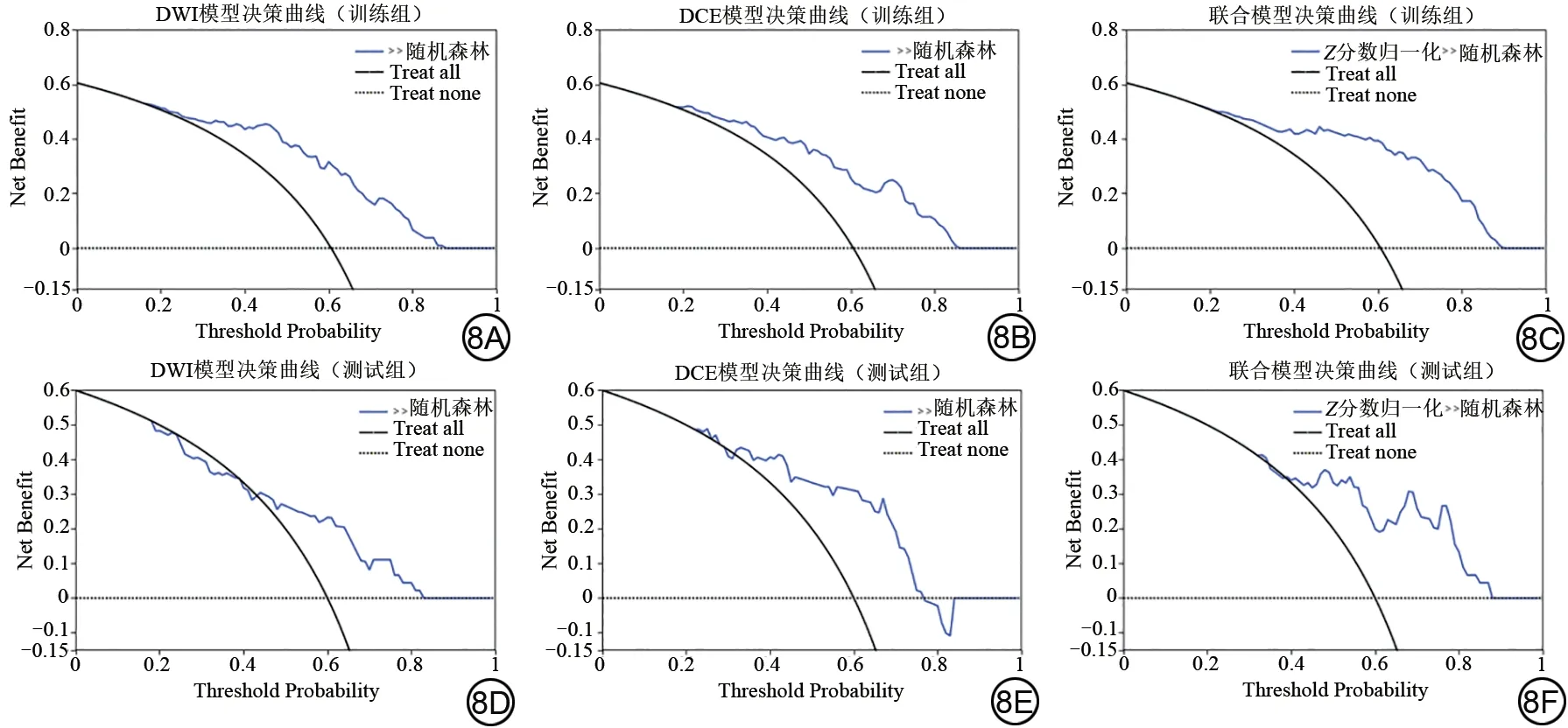
图8 模型的决策曲线。8A~8C 分别为DWI模型、DCE模型、联合模型训练组的决策曲线;8D~8F 分别为DWI 模型、DCE 模型、联合模型测试组的决策曲线。DCE:动态对比增强;DWI:扩散加权成像。Fig.8 Decision curves of the models.8A-8C are the decision curves of DWI model, DCE model and joint model training group respectively;8D-8F are the decision curves of DWI model, DCE model and joint model test group respectively.DCE: dynamic contrast-enhanced; DWI: diffusion weighted imaging.
3 讨论
乳腺癌的分子分型是选择患者临床治疗方式的重要依据,同时也是肿瘤的重要预后因子,具有较高的临床应用价值。乳腺癌的分子分型主要依赖于有创的病理方法获得,既往影像组学预测多基于单序列研究,其预测效能不高,鲜有探讨不同序列间的互补价值。因此本研究基于DWI 与DCE 双序列影像组学建立预测模型,旨在无创性地分析非特殊型浸润性乳腺癌的分子分型。研究发现上述序列均能较好地预测非特殊型浸润性乳腺癌Luminal 型和非Luminal 型,为临床分子分型的确定与治疗方案的选择提供了参考。
3.1 分子分型现有研究分析
Luminal 型乳腺癌对内分泌治疗敏感,复发风险较低,预后较好;非Luminal型乳腺癌对化疗敏感,肿瘤易发生远处转移,复发风险高,预后较差[17]。目前,乳腺癌的分子分型需要用有创的病理方法获得,MRI影像组学有无创地预测分子分型的潜力,且检查过程无电离辐射伤害,对患者临床诊断、个体化治疗方式的选择及预后评估有一定的价值。目前已有部分研究[18-19]表明MRI 影像组学预测乳腺癌分子分型具有可行性及临床意义,但使用DCE 序列联合DWI 序列预测乳腺癌Luminal 型和非Luminal 型的研究较少,因此本研究目的是讨论DCE 联合DWI 序列预测非特殊型浸润性乳腺癌Luminal型和非Luminal型的临床价值。
既往研究[20-21]多采用数字乳腺X 线摄影的影像组学预测乳腺癌的分子分型,但具有部分缺点:数字乳腺X 线摄影获取的是二维的图像,乳腺组织过多的重叠将导致细小的病变结构易被掩盖,且无法提供肿瘤血供情况,只能反映病灶形态学的改变[22],另外,检查时需要压迫乳房组织,使患者产生不适感,检查时产生的电离辐射也对人体有不同程度的损害。目前,MRI 检查具有无辐射、软组织分辨力高及多参数成像等特点,已成为乳腺癌常用且对病灶检出较灵敏的影像检查方法。有研究[23-27]认为DCE 影像组学模型、DWI 影像组学模型对预测乳腺癌分型具有重要价值,但鲜少有研究对这两种影像组学模型进行系统比较。
3.2 DWI序列、DCE序列在预测分子分型中的作用
DWI 序列具有表明组织中水分子扩散状态的能力,若水分子扩散受限,将会在图像上出现高信号。DWI 对水分子受限组织敏感,能较好地反映病变组织水分子受限的状态。b 值又称扩散敏感因子,指MRI 中各序列对扩散运动的敏感程度,是扩散运动能力检测的指标。b 值越大对水分子的弥散越敏感,于是本研究选择在高b 值图像上进行影像组学特征提取,与GAO等[24]采用的方法一致。
由于乳腺癌特有的异常血管分布,DCE序列对灌注变化很敏感[28]。DCE图像增强后第二期为动脉期,即注射对比剂后69~138 s 左右,且有研究表明,乳腺肿瘤在注射对比剂后第二期会出现信号高峰值时段,肿瘤与背景乳腺信号强度差异较大,对比信噪比最高[29]。因此本研究采用勾画增强后第二期相预测乳腺癌分子分型,与代婷等[30]学者采用的方法一致。两者研究结果均得到了较高的准确性,原因可能在于动脉期病灶与周围组织分界更清晰,勾画病灶时误差更小,且本研究对肿瘤采用逐层勾画提取病灶特征,更加能反映乳腺肿瘤的整体性和高度异质性[31]。
DWI 序列可以反映乳腺癌病灶水分子扩散受限的状态,DCE 序列能反映乳腺肿瘤的血供灌注情况,综合两个序列能更准确地确定肿瘤的病变范围、采集更多的肿瘤信息,在一定程度上弥补单一序列包含肿瘤信息量有限的局限性,这也可能是联合模型预测性能有所提升的原因。
3.3 主要研究结果分析
本研究纳入的患者中,Luminal 型占60.4%,非Luminal型占39.6%,与研究[32-34]报道类似。本研究结果显示基于随机森林法建立的三个模型在训练组的预测效能表现均较好(AUC>0.8),测试组的预测效能虽稍有下降,但都保持在一个较理想的范围内(AUC>0.7)。DeLong检验结果显示在测试组中三个模型的预测效能两两比较差异均无统计学意义,表明在本研究中DWI 序列、DCE 序列和联合序列均能较好地预测非特殊型浸润性乳腺癌Luminal 型和非Luminal 型。校正曲线和决策曲线也分别展示出本研究有较好的拟合情况和较高的临床净收益。
此外,本研究进行了Luminal型和非Luminal型、训练组和测试组间的临床及病理资料的比较,结果显示Luminal 型和非Luminal 型之间的年龄、绝经状态、淋巴结转移状态等临床及病理资料差异均无统计学意义(P>0.05)。李薇等[35]的研究与本文研究结果同样得出年龄、绝经状态、淋巴结转移状态在Luminal 型和非Luminal 型之间差异无统计学意义。陈永升等[36]的研究发现不同分子分型的乳腺癌患者绝经状态间的差异无统计学意义,但淋巴结转移状态在组间差异有统计学意义(P<0.05)。上述文献和本研究结果的差异可能与本研究纳入样本量偏小、分子分型方法不同等因素有关,有待进一步探讨。
3.4 局限性
本研究还存在一定的局限性:(1)本研究是一项回顾性的单中心研究,未引入外部测试,可能会导致研究结果不具有普适性;(2)样本量相对较少;对分子分型只进行了二分类,其结果无法为患者提供更加精准的治疗方式选择。因此,未来需要进一步扩大样本量,进行多中心、更详细分类的研究。
4 结论
综上,本研究基于MRI 影像组学构建的模型可以较好地预测非特殊型浸润性乳腺癌Luminal 型和非Luminal型,有助于乳腺癌个体化治疗方案的合理选择。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:黄小华参与设计本研究的方案,对稿件重要内容进行了修改,获得了南充市市校合作项目的资助;张丁懿参与研究方案的设计,起草和撰写稿件,获取、分析并解释本研究的数据;沈梦伊、张丽、何欣获取、分析或解释本研究的数据,对稿件的部分内容进行了修改。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

