组蛋白甲基转移酶2在常见肿瘤中的机制及临床研究进展
王 宇,郭彩瑶,王 莹,刘圣兰,戴 伟
(1. 赣南医科大学康复学院;2. 赣南医科大学药学院,江西 赣州 341000)
肿瘤是严重危害人类健康的恶性疾病,一直是医学研究的热点。虽然目前对肿瘤的治疗已取得较大进展,但仍有很大一部分恶性肿瘤无法治疗或治愈,主要原因是恶性肿瘤的发病机制不清楚,缺乏有效的治疗靶点。目前对于肿瘤的治疗手段主要为手术、放化疗等,治疗手段单一且机体易产生耐药性,患者生存率低。因此,寻找全新的针对恶性肿瘤的有效治疗靶点成为临床研究的热点。近年来,组蛋白甲基转移酶2(SET and MYND domaincontaining proteins 2, SMYD2)在肿瘤中的作用受到了学者的广泛关注,SMYD2也被确定为一种有前景的新的小分子肿瘤治疗靶点,其调控肿瘤的机制及其新型抑制剂在肿瘤中的活性评价也时有报道,现就SMYD2 在部分常见肿瘤中的作用及其部分抑制剂的临床研究进行综述。
1 表观遗传与SMYD2概述
1.1 表观遗传与组蛋白修饰表观遗传是指在没有DNA 序列改变的情况下发生在染色体上的基因表达的可遗传改变[1],表观遗传包括DNA 甲基化、组蛋白修饰、染色质重塑和非编码RNA 干扰。它提供了基因型和表型之间的联系,是多细胞生物体中细胞多样性和分化的基础[2],表观遗传修饰对于促进细胞过程至关重要[3]。其中赖氨酸甲基化不仅在基因表达的表观遗传调控中具有重要作用,还在细胞信号转导途径的调控和癌症中也具有重要作用[4]。组蛋白甲基化程度与基因转录或沉默相关,
组蛋白甲基化不改变染色质的电荷,但促进染色质相关复合物的募集,甲基化后会影响染色质的重塑[5]。组蛋白甲基转移酶的失调参与了包括癌症在内的许多疾病的发展[6],在SMYD 的家族里SMYD2与肿瘤相关性最强[7]。SMYD2 的失调会影响基因表达,可能导致肿瘤发生[8]。
1.2 SMYD2 的基本结构SMYD2 是SMYD 的家族成员,其家族蛋白具有相似的结构域,包括N-终端集域(N- terminal SET domain, N-SET)、髓样神经性DEAF1 (Myeloid-Nervy-DEAF1, MYND)、插入集域(Insertion SET domain, SET-1)、核心集域(Core SET domain, C-SET)、集合C-末端侧翼域(SET Cterminal flanking domain, post-SET)和C 端结构域(C-terminal Domain,CTD)6个蛋白结构域(图1)。
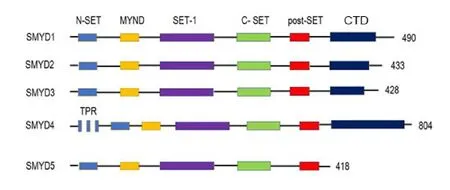
图1 SMYD基因结构示意图[9]
其中C-SET 和MYND 是SMYD 的重要结构域,MYND 结构域发挥蛋白质间的相互作用,参与调节蛋白质稳定[10]。C-SET 结构域含有大约130 个氨基酸的催化结构域,含有催化元件,其主要功能是调节基因活性[11]。SMYD2 的空间构象是由CTD 结构的空间构象决定的,CTD 结构的空间构象不同导致SMYD2 与不同的底物结合,使得SMYD2 具有底物选择性[9]。此外,CTD 控制SMYD2 的酶活性,可能成为增强或抑制SMYD2酶活性的潜在作用靶点[12]。
1.3 SMYD2 的基本功能SMYD2 可以使部分组蛋白和非组蛋白(如p53 和HSP90)甲基化,而且修饰的位置通常在组蛋白的尾部[13]。研究发现,组蛋白甲基化通过改变染色体结构促进或抑制转录[14]。组蛋白甲基化是一种普遍存在的细胞调控机制,其中,组蛋白赖氨酸的甲基化调控基因转录,组蛋白H3 第4 位赖氨酸(Lysine at position 4 of H3,H3K4)的甲基化是主动转录基因的重要标志[15]。组蛋白甲基化发生在组蛋白H2A、组蛋白H2B、组蛋白H3和组蛋白H4 末端赖氨酸和精氨酸残基的侧链上[16]。部分组蛋白和非组蛋白(如p53 和HSP90)甲基化和多种癌症有关联,在基因表达中起重要作用,甲基化与下游基因表达变化有关,且已被证实会导致下游蛋白的长期变化[17]。
1.4 SMYD2调控肿瘤相关蛋白的功能
1.4.1 SMYD2 甲基化与p53 蛋白活性调控
SMYD2 被确定为组蛋白H4 第20 位赖氨酸(Lysine at position 20 of H4,H4K20)单甲基化的关键酶,是组蛋白H4K20 甲基化的标志物[18]。SMYD2可以甲基化组蛋白H3K4 和组蛋白H3 第36 位赖氨酸(Lysine at position 36 of H3,H3K36)以及其他底物,如抑癌蛋白(Tumor suppressor protein,p53)和成视网膜母细胞瘤蛋白(Retinoblastoma protein,Rb)[19],肿瘤抑制因子p53的功能是在细胞应激条件下保护遗传完整性和抑制不受控制的增殖,并且p53 是细胞凋亡、DNA 损伤修复的重要调节因子。研究发现,SMYD2 的表达与p53 基因的表达呈负相关[20],CTD是p53功能的关键调节区[21],SMYD2通过直接甲基化p53的CTD 调控p53活性[20]。SMYD2在体内可以单甲基化赖氨酸残基370(K370)抑制p53活性,敲除SMYD2 增强p53 依赖的凋亡[22]。SMYD2对p53 K370 底物的优先识别表明了SMYD2 对部分非组蛋白和组蛋白底物结合作用具有差异性,SMYD2 对p53 K370 的甲基化降低了它与启动子的结合频率,抑制了p53 转录活性[21,23]。研究发现,SMYD2 对p53 K370 的甲基化可以通过小鼠抗SETD7 单克隆抗体(Anti-SETD7 mouse monoclonal antibody,Set7/9)阻止K370 的甲基化,p53 受SMYD2对K370 单甲基化的负调控;Set9 甲基化p53 蛋白K370 可以稳定p53 并增强其转录活性[24-25]。以上研究均表明赖氨酸甲基化可通过多种方式调节p53活性(表1)。

表1 SYMD2调控部分非组蛋白底物的分子机制
1.4.2 SMYD2 通过甲基化修饰调控HSP90 功能
SMYD2 与人热休克蛋白90(Human heat shock protein 90,HSP90)结合,SMYD2 的CTD 可能与HSP90 共伴侣的易位启动子区(Translocated promoter region,TPR)以钳制机制的方式和HSP90结合[26]。赖氨酸甲基化通过一些修饰位点提高HSP90 功能,主要是调节HSP90 的远端区域。研究发现,HSP90 K616 甲基化过程受SMYD2 辅伴侣调节[27](表1),促进SMYD2、甲基-HSP90 形成复合物。此外,SMYD2 还通过组蛋白H3 第36 位赖氨酸二甲基化和组蛋白H3 第4 位赖氨酸单甲基化,与HSP90在细胞核中发挥作用,影响HSP90 的转录活性[28]。HSP90 是癌细胞存活的重要促进剂,甲基化可以抑制HSP90降解,加速癌细胞增殖,增强致癌潜力[29]。
1.4.3 SMYD2 通过甲基化修饰调控其他蛋白功能甲基化是蛋白质翻译后修饰的重要类型,可以影响蛋白生物学功能[30],多聚ADP 核糖聚合酶1(Poly ADP ribose polymerase 1,PARP1)是细胞内最丰富的核蛋白之一,在多种肿瘤中过表达,可导致肿瘤细胞产生耐药性,抑制肿瘤细胞PARP酶活性有可能改善癌症化疗或放疗效果[31](表1)。磷酸酯酶与张力蛋白同源物(Phosphatase and tensin homolog,PTEN)是一种抑癌基因,其313 位赖氨酸可以被SMYD2 甲基化,使其丧失抑制肿瘤功能,促进肿瘤细胞生长[32](表1)。Rb是负责调控细胞周期进程和细胞凋亡的一种抑癌基因,是SMYD2的非组蛋白底物之一,其甲基化发生在赖氨酸860位点,甲基化修饰后的Rb 可通过不同的分子途径导致细胞周期进展缓慢[33-34](表1)。
2 SMYD2在部分肿瘤中的作用机制
肿瘤的发生发展是一个多步骤且复杂的生物学过程,一般需要获得包括维持增殖信号、逃避生长抑制因子、抵抗细胞死亡、使复制永生、诱导血管生成,并激活侵袭和转移等几种生物学能力[35]。研究表明,SMYD2 与肿瘤干细胞、肿瘤增殖与转移以及耐药的分子信号调控密切相关,现按肿瘤表型分类介绍如下。
2.1 SMYD2 与肿瘤干细胞肿瘤干细胞指的是具有干细胞性质的肿瘤细胞,这些肿瘤细胞具有自我复制和多细胞分化的能力。肿瘤干细胞通常被认为具有形成肿瘤及发展成肿瘤的潜力,特别是随着肿瘤转移之后会产生新的肿瘤。最近研究发现,SMYD2与部分肿瘤的干细胞相关。
急性淋巴细胞白血病是儿童时期最常见的恶性肿瘤,在核型和分子水平上都具有高度异质性[36]。SMYD2 在肿瘤性骨髓样本中的表达比正常样本表达高,其高表达与患者不良预后有关,SMYD2表达水平越高,患者生存率越低[36]。
急性髓系白血病是一种老年人易患的起源于造血干细胞的恶性肿瘤。研究发现,SMYD2在急性髓系白血病以及其他造血病变中过表达,SMYD2的缺失可通过β-catenin 信号通路调节白血病干细胞,导致白血病细胞发生凋亡[37],可能对白血病的治疗具有重要的参考意义。
黑色素瘤细胞黏附分子(Melanoma cell adhesion molecule ,MCAM)在多种恶性肿瘤中高表达,SMYD2 能够显著促进MCAM 的表达。在MCAM 基因敲除细胞中SMYD2 的过表达会增加MCAM 的表达,促进乳腺癌干细胞生长[38]。
2.2 SMYD2 与肿瘤的增殖和转移恶性肿瘤具有无限增殖的特性,容易发生转移和复发,破坏正常组织。研究发现,SMYD2与部分肿瘤的增殖和转移密切相关[39]。在常见的甲状腺乳头状癌(Thyroid nipple cancer,PTC)中,与相邻的正常甲状腺组织相比,甲状腺乳头状癌SMYD2 表达明显增加;且SMYD2高表达促进甲状腺癌乳头状癌细胞增殖,与患者肿瘤TNM 分期呈正相关[39]。在恶性程度极高的胰腺导管腺癌(Pancreatic adenocarcinoma,PDAC)中发现,PDAC 中SMYD2的表达水平升高,MAPK 激活蛋白酶 3(Mitogen-activated protein kinase activated protein kinase 3,MAPKAPK3)是胰腺导管腺癌细胞中SMYD2 的作用底物;抑制MAPKAPK3可抑制胰腺导管腺癌细胞增殖,SMYD2可能通过调节MAPKAPK3促进肿瘤细胞生长[40]。
2.2.1 SMYD2 与生殖系统肿瘤畸胎瘤是生殖细胞肿瘤的一种类型。畸胎瘤的进展与p53蛋白水平和活性呈负相关。高水平的p53可激活下游基因转录,抑制细胞周期进展,从而抑制肿瘤细胞增殖。目前畸胎瘤的治疗方式主要是联合化疗,内源性野生型p53 部分激活可有效提高治疗效果治愈率。SMYD2 在畸胎瘤中可调控p53 蛋白水平和活性,将SMYD2 抑制剂与化疗药物联合使用显示良好的治疗效果[41]。
2.2.2 SMYD2 与妇科肿瘤妇科肿瘤是女性患肿瘤死亡的主要原因,其中宫颈鳞状细胞癌和宫颈腺癌中的SMYD2 被确定为癌症发展的关键基因。卡普兰-迈耶(Kaplan-Meier,KM)生存曲线分析发现SMYD2 mRNA 表达与乳腺癌患者生存期呈负相关,SMYD2 可以为妇科肿瘤的预后生物标志物[42]。SMYD2可能是诊断乳腺癌的潜在生物标志物,并可作为乳腺癌转移复发患者的预后指标[43]。
2.2.3 SMYD2 与肝、肺肿瘤肝细胞癌是最常见的原发性恶性肿瘤,约占全球所有肝癌病例的80%。SMYD2 在人肝癌中的表达显著升高,且SMYD2 表达水平升高与肝癌患者不良临床特征相关[44]。SMYD2 通过特异性siRNA 调控肝癌细胞周期蛋白D1(G1/S-specific cyclin-D1,Cyclin D1)表达,促进细胞增殖和细胞周期进程,加快肝癌生长,SMYD2 可以作为肝癌的有效治疗靶点[44]。SMYD2在肺腺癌细胞中高表达,SMYD2过度表达后会提高细胞增殖、迁移和侵袭能力。核糖体蛋白S7(Ribosomal protein S7,RPS7)是核糖体小亚基单位的组成部分,在蛋白质翻译中发挥重要作用,SMYD2 可能通过转录激活RPS7 促进肺腺癌细胞癌变和转移[45],SMYD2可能是肺腺癌的治疗靶点。
2.2.4 SMYD2 与消化系统肿瘤胃癌是消化系统最常见的恶性肿瘤之一,研究发现,LINC00052在胃癌中高表达,RNA 免疫共沉淀分析显示LINC00052 可与β-catenin 和SMYD2 发生作用,激活Wnt/β-catenin 途径促进细胞增殖,增加胃癌生长和侵袭,原因在于其途径可以使β-catenin 甲基化维持其稳定,揭示了LINC00052调控胃癌的潜在机制[46]。
食管癌是最常见的恶性肿瘤之一,其中食管鳞状细胞癌约占90%。研究发现,食管鳞状细胞癌周围有2 个假定靶点,转录激活因子3(Recombinant activating transcription factor 3 ,ATF3)和着丝粒蛋白F(Recombinant centromere protein F,CENPF),SMYD2基因位于ATF3 和CENPF 之间,SMYD2 表达的下调抑制了食管鳞状细胞癌细胞增殖,诱导G0/G1 期阻滞,作为肿瘤启动子发挥促食管癌发生的作用[47]。
结直肠癌是全球第3 大恶性肿瘤,SMYD2 在结直肠癌中明显上调,并与不良预后有关。SMYD2的过度表达激活了Wnt/β-catenin 通路,然后在大肠癌中启动上皮-间质转化(Epithelial-mesenchymal transition,EMT)过程,SMYD2 可能通过DNA 修饰降低腺瘤性结肠息肉病蛋白2(Adenomatous colon polyposis protein-2,APC2)的表达,激活Wnt/β-catenin 通路促进EMT,从而促进肿瘤进展[48]。
2.3 SMYD2 与肿瘤耐药肿瘤一旦产生耐药性,将使药物不能发挥抗癌作用。胶质瘤是最常见的恶性原发脑瘤,低级别胶质瘤患者的生存结果差异较大。表观遗传改变现在被广泛认为是癌症的标志,SMYD2 对于胶质瘤细胞耐药是必不可少的[49]。SMYD2 高表达与低级别胶质瘤患者的不良预后显著相关,SMYD2 和Zeste 增强子同源物2(Zeste enhancer homolog 2,EZH2)相互作用是胶质瘤发展的关键因素,进一步突显了其在低级别胶质瘤中潜在的致癌作用[49]。奥沙利铂(Oxaliplatin,L-OHP)是结肠癌化疗的一线药物,但其耐药性限制了其疗效。研究发现SMYD2-OE 过表达在体外促进了结肠癌细胞对L-OHP 的耐药性[50]。肾透明细胞癌是一种肾癌亚型,晚期肾透明细胞癌患者存活率较低,原因在于肾癌细胞的多药耐药,是治疗肾癌的难点。miR-125b 是SMYD2 的下游靶点,在肾透明细胞癌的致癌性中起重要作用。miR-125b 在化疗中对肿瘤细胞发挥着重要的保护作用,在癌症的化疗耐药中起调节作用;SMYD2 过表达会促进miR-125b的表达,从而发挥促癌作用[51]。
非小细胞肺癌是一类肺恶性肿瘤性疾病,可以使间变性淋巴瘤激酶(Anaplastic lymphoma kinase,ALK)激活。由于单药治疗更易耐药,联合用药效果会更好,SMYD2抑制剂和ALK抑制剂的联合使用可抑制非小细胞肺癌细胞生长。由于EML4-ALK是赖氨酸甲基转移酶SMYD2的新底物,其甲基化可能在EML4-ALK 蛋白的磷酸化及肿瘤治疗中起重要作用[52]。因此SMYD2 介导的ALK 甲基化可能是新型肿瘤治疗的一个有前景的靶点。
3 SMYD2抑制剂在肿瘤临床治疗中的应用
大量研究证实表观遗传调控机制失调在癌症的形成和发展中发挥着关键作用[7],基于表观遗传调控机制设计的靶向表观遗传药物,在肿瘤的治疗中具有很好的应用前景。因此,基于SMYD2在肿瘤中的关键作用,以SMYD2为靶点设计抑制剂在肿瘤治疗的应用吸引了广大科研学者的关注。SMYD2开发的部分抑制剂包括LLY-507、BAY-598 和AZ-505[53]。
3.1 LLY-507SMYD2 在肝癌中表达上调,药物抑制组蛋白修饰的表观遗传途径可能成为一种新的治疗策略。研究发现,LLY-507 作为SMYD2 的抑制剂之一,可以降低肝癌的侵袭性。已经在肝癌患者Ⅰ/Ⅱ期临床试验中进行了测试,发现这些靶向治疗具有潜在的疗效[54]。SMYD2 抑制剂LLY-507 抑制卵巢透明细胞癌(Ovarian clear cell carcinoma,OCCC)细胞活力,提示SMYD2 可促进OCCC 活性,抑制SMYD2 可诱导OCCC 细胞凋亡。SMYD2 抑制剂LLY-507 可能是治疗OCCC 的一种有前景的分子靶向治疗方法。在美国,奥拉帕利已被临床应用于治疗与乳腺癌1/2 号基因(Breast cancer gene 1/2,BRCA1/2)突变相关的某些复发卵巢癌患者;在日本,已被用于治疗对铂敏感的复发性卵巢癌患者。小分子SMYD2 抑制剂如LLY-507 和奥拉帕利联合治疗高级别浆液性卵巢癌(High grade serous ovarian cancer,HGSOC)可能是一种可行的有效治疗策略[55]。
3.2 BAY-598BAY-598 是一种有效的选择性氨基吡唑啉类小分子抑制剂,该抑制剂可能为组蛋白甲基转移酶领域提供治疗方法[56]。阿帕替尼已获准临床应用,在结直肠癌治疗中发挥不错的疗效,用SMYD2 的功能性抑制剂BAY-598 治疗也可以与阿帕替尼协同作用[57],更好地治疗结直肠癌。
3.3 AZ-505AZ-505是从高通量化学筛选中发现的一种有效的选择性SMYD2 抑制剂,AZ-505 抑制SMYD2 介导的细胞甲基化[58]。AZ-505 抑制SMYD2可显著抑制肺腺癌细胞增殖、迁移和侵袭能力,SMYD2 可能是预测肺癌预后的候选生物标志物,并可作为肺癌治疗的潜在靶点改善临床预后[45]。AZ-505抑制SMYD2,可显著抑制体内三阴性乳腺癌(Triple negative breast cancer,TNBC)肿瘤的生长,SMYD2 在TNBC 中的作用和机制将使SMYD2 成为目前缺乏特定靶向治疗方案的TNBC 治疗的药物靶点[59]。AZ-505 促进了胶质瘤细胞对化疗药物的敏感性。顺铂处理后,SMYD2 表达显著降低,这可能是由重组STIP1 同源性和含U 盒蛋白1(Recombinant STIP1 homology and U-Box containing protein 1,STUB1)介导的。此外,STUB1基因敲除减弱了顺铂在胶质瘤中的抗肿瘤作用,为发展神经胶质瘤的治疗策略提供了潜在靶点[49]。
综上,SMYD2 抑制剂是治疗多种肿瘤和其他疾病潜在的有效治疗方法,其有效性及作用机制需要进一步的研究和临床试验的验证。
4 总结
SMYD2 作为表观修饰物,是肿瘤的关键信号调节因子,它提供了基因型和表型的联系。通过调节不同的底物,在不同的细胞、器官和癌症中发挥不同的作用。SMYD2作为组蛋白甲基转移酶,在多种肿瘤中过表达,在多种癌症中发挥着重要的作用,可能成为肿瘤治疗的广谱治疗靶点,并成为诊断和预后的有价值的生物标志物。目前,SMYD2在部分肿瘤中的具体作用机制尚不清楚,未来研究方向可能集中在阐明SMYD2 在不同生理和疾病条件下的功能,明确SMYD2与特定底物结合的特异性是如何调控的,以助于更有效和更特异的SMYD2抑制剂的开发,并有望用于治疗常见的肿瘤类型。

