580 例梅毒孕妇不良妊娠结局分析
季莹,华云晖
(南京市第二医院,江苏 南京 210003)
梅毒螺旋体可经胎盘传染胎儿,梅毒在妊娠全过程中均可能发生垂直传播,导致流产、死胎、早产、低出生体质量、先天性梅毒和死产等多种不良妊娠结局。妊娠期常规筛查、识别梅毒感染、规范治疗对预防先天性梅毒至关重要,可以有效减少不良妊娠结局[1-2]。本院妇产科接受来自南京市转诊的梅毒螺旋体明胶凝集试验(Treponema pallidum particle assay,TPPA)阳性孕妇,复查梅毒螺旋体抗原血清学和非梅毒螺旋体抗原血清学检测,经过本院皮肤性病科准确诊断、评估垂直传播风险,依据我国的规范治疗标准并给予治疗意见,对初次诊断的孕妇尽快、足量、规范治疗[3]。
本研究以2017 年6 月—2022 年6 月在南京市第二医院妇产科TPPA 阳性孕妇及其分娩的新生儿为研究对象,统计孕产妇孕期接受驱梅治疗信息与新生儿0~6 个月随访时取血化验记录,观察妊娠合并梅毒感染孕妇接受合理诊断、规范治疗对妊娠结局的影响。
1 资料与方法
1.1 一般资料
1.1.1 研究对象 研究对象为2017 年6 月—2022 年6 月期间,本院产科门诊收治的共580 例TPPA 或/和非快速血浆反应素试验(Rapid plasma reagin,RPR)阳性的孕妇,年龄17~42 岁,平均(29.7±6.8)岁。
1.1.2 纳入标准 TPPA 或(和)非RPR 阳性的孕妇。
1.1.3 排除标准 ①孕晚期急诊来院不能提供治疗过程及方案;②新生儿紧急转走同时无法获得新生儿结局信息;③有自身免疫性疾病;④同时合并人类免疫缺陷病毒(HIV)抗体阳性或丙型肝炎抗体阳性。所有孕妇均签署医学伦理知情同意书。
1.2 方法 对TPPA 阳性孕妇进行妇产科门诊定期产检。每个月1 次RPR 定量检测,观察滴度变化,判断有无复发或再感染。鉴于未经治疗的男性伴侣是孕妇再次感染的关键来源[4],对患者的性伴侣进行性病皮肤科转诊,给予相应的检查及必要的治疗。
接受规范治疗的孕妇A 组,使用苄星青霉素2 400 000 U,每周1 次,连续3 次为1 个疗程。治疗时期注意以下细节:①孕早期发现的梅毒感染孕妇(TPPA 和RPR 均为阳性,双阳患者),应于孕早期和孕晚期各进行1 个疗程的治疗,共2 个疗程;②孕中、晚期发现的感染孕妇(双阳患者),立刻给予2 个疗程的治疗,2 个治疗疗程之间需间隔4 周以上(最少间隔2 周),第2 个疗程应当在孕晚期开始,最好在分娩前1 个月完成;③临产时发现的感染孕产妇(双阳患者),要立即给予1 个疗程的治疗;④治疗过程中复发或重新感染者(双阳患者),追加1 个疗程的治疗。
孕期初次诊断未接受规范治疗是指初诊双阳孕妇未接受全程、足量的青霉素治疗。对于青霉素过敏者可用头孢曲松,每日1 g,肌内注射或静脉给药,连续10 d 为1 个疗程;青霉素、头孢类药物均过敏者可用红霉素治疗,红霉素每次500 mg,每日4 次,口服,连服15 d 为1 个疗程。
根据孕妇孕前既往感染、孕期初次诊断及孕期是否接受治疗分组为:进行规范驱梅治疗的A 组439 例(其中A1 组336 例、A2 组42 例、A3 组61例)、孕期初次诊断未接受规范治疗的B 组122 例和孕期初次诊断未接受治疗的C 组19 例。
此外,本研究的不良妊娠结局是指发生早产、低出生体质量、围产儿死亡、先天性梅毒中至少1 种不良结局。新生儿梅毒诊断依据中华人民共和国委实和计划生育委员会发布的《预防艾滋病、梅毒和乙肝母婴传播工作实施方案(2015 年版)》[3]。梅毒感染孕产妇的新生儿出生后给予苄星青霉素G,50 kU/kg 预防性注射,所有接受了标准化治疗的孕妇,分娩后非梅毒螺旋体抗原血清学检测滴度值在1∶4 阳性及以下,允许给予新生儿母乳喂养。
A 组转诊时的平均孕周15+周,其中依据梅毒诊断标准[5]孕期初次诊断(双阳患者)并接受苄星青霉素2 个及以上疗程治疗的336 例为A1 规范治疗组;既往感染、临床诊断达到了痊愈(单阳患者)或者血清固定双阳患者,经过医患沟通接受了1 个疗程的苄星青霉素治疗的42 例为A2 组;拒绝重复治疗者61 例为A3 组。接受不规范治疗纳入B 组(初治双阳患者),转诊时的平均孕周24+周,其中接受1 个疗程苄星青霉素治疗90 例;头孢(替代治疗)12 例、1 个疗程苄星青霉+头孢类药物18 例;对苄星青霉和头孢类药物均过敏口服红霉素2 例。纳入C 组孕妇(初治双阳患者)共19 例,未接受治疗,诊断时的平均孕周33+周。在580 例梅毒孕妇中,有561 例(A+B 组) 接受了梅毒治疗,治疗率为96.72%,439 例(A 组)接受了标准化梅毒治疗,平均标准化治疗率为75.69%,均高于国内相关省市[6]。3 组孕妇年龄(A 组29.5±7.2 岁,B 组30.1±4.9 岁,C组29.5±6.3 岁)、分娩方式(剖宫产率:A 组33.1%,B组34.5%,C 组35.2%)、所生婴儿性别(男婴占比:A组57.67%,B 组55.28%,C 组58.13%)比较差异无统计学意义(P>0.05)。A 组诊断和启动驱梅治疗时的平均孕周小于B 组和C 组治疗组[A 组(15.0±3.2)周,B 组(24.0±6.5)周,C 组(33.0±4.9)周],差异有统计学意义(P<0.05)。A 组诊断和启动驱梅治疗时的平均孕周小于B 组和C 组治疗组,差异有统计学意义(P<0.05)。
1.3 统计学分析 应用SPSS 20.0 统计软件进行数据分析,符合正态分布的计量资料以均数±标准差(±s)表示,并采用t 检验进行差异分析,3 组间采用方差分析;计数资料采用例(%)表示,并采用χ2检验进行差异分析。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组梅毒感染孕妇的不良妊娠结局比较 3 组组间孕妇总不良妊娠结局、早产、低出生体质量、围生儿死亡发生率和新生儿先天性梅毒差异有统计学意义(P<0.05),见表1。早产及小于胎龄儿发生率在A1~3 组的比较差异无统计学意义(P>0.05),见表2。
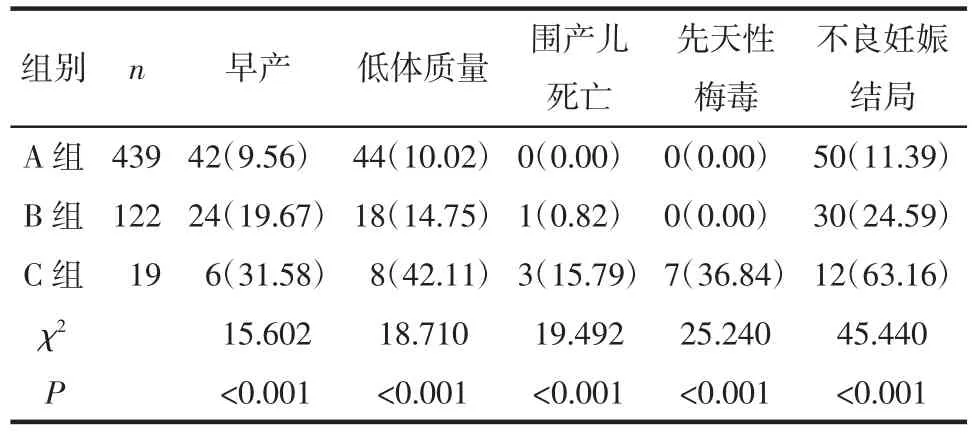
表1 3 组不良妊娠结局比较例(%)
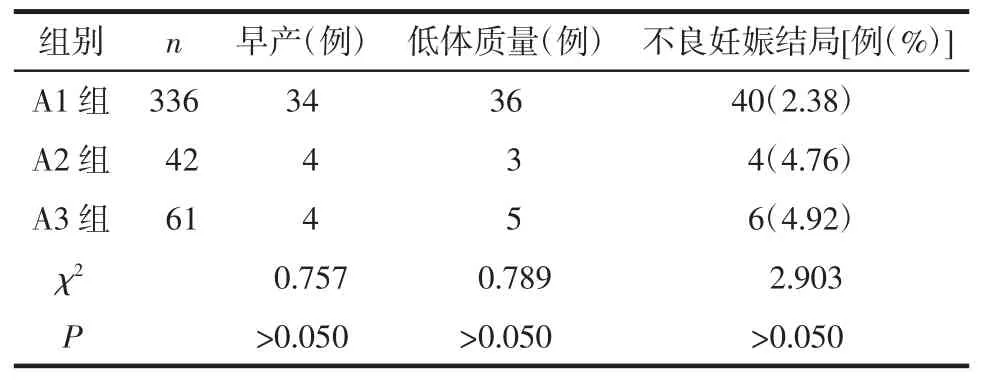
表2 A1~3 3 组内不良妊娠结局比较
2.2 母乳喂养安全性观察 在所有接受标准化梅毒治疗的孕妇,分娩正常新生儿,且分娩后产妇的非梅毒螺旋体抗原血清学检测滴度值在1∶4 阳性及以下,允许给予新生儿母乳喂养,其中76 例患者符合上述条件并完成随访,所有新生儿在18 个月龄内均转为血清梅毒抗体双阴。
3 讨论
对梅毒感染的孕妇进行驱梅治疗有双重目的,一方面治疗孕妇,另一方面可预防或减少先天梅毒的发生。在妊娠早期治疗可以避免胎儿感染,在妊娠中晚期治疗可能使受感染胎儿在分娩前治愈。经过治疗的二期梅毒孕妇先天梅毒的防治可达94.7%,而一期与晚期潜伏梅毒孕妇治疗后先天梅毒的防治率达100.0%[7]。A1 组是孕期初次诊断(双阳患者)并接受规范治疗的,这组病例是本院妇产科诊断治疗的重点目标人群,孕妇为了达到母婴阻断,接受了规范的2 个疗程苄星青霉素治疗。
A 组孕妇是治疗的最大获益者。对于RPR 滴度高于1∶16 的患者首次接受驱梅治疗前24 h,予以口服甲泼尼龙40~60 mg,每日1 次,连续3 d,预防发生吉海反应。然而,这组患者中仍有18 例孕妇发生吉海反应,出现发热、呕吐、宫缩发动症状,但无死胎发生。吉海反应发生率为5.35%,小于国内相关研究报告的结果[8]。A2 组孕妇包括单阳和血清固定孕妇,单阳孕妇为既往感染、已经接受正规治疗和完整随访,为临床治愈。有专家认为梅毒血清固定是人体的一种特定免疫状态,不是梅毒螺旋体的持续存在,已经经过正规驱梅治疗后、排除神经梅毒、再感染等,无需再治疗[9-10];但也有学者持不同意见,认为需要治疗[11-12]。该组患者的治疗是依据预防HIV感染、梅毒和乙型肝炎病毒母婴传播工作通知文件规定,予以苄星青霉素1 个疗程治疗。A3 组孕妇(单阳孕妇或者血清固定),孕期拒绝重复治疗者。对于这组患者,有专家认为没有证据表明血清固定的患者应该接受多次再治疗,经过充分沟通后,尊重患者选择,避免孕期滥用抗菌药物、减轻患者的精神负担[13-14]。本研究结果表明,A 组总体的新生儿预后最好,不良妊娠结局稍低于国内报告的16%[15],且无1 例死胎、死产和先天性梅毒,也体现了苄星青霉素对孕期梅毒母婴治疗的有效性及重要性。
B 组亦是妇产科妊娠期梅毒诊断、治疗的重点目标人群,但患者转诊时较晚,客观上或者主观上没有接受2 个疗程苄星青霉素的驱梅治疗。B 组发生1 例死胎死产,分析该例孕妇妊娠期RPR 1∶16,孕30 周初次诊断立即予以苄星青霉素治疗,32 周胎死宫内。梅毒感染孕妇应尽早进行驱梅治疗,最好不要晚于孕28 周,28 周后接受治疗,RPR>1∶8 的妇女中,不良妊娠结果更常见。B 组中头孢治疗的30 例孕妇,分为2 种情况:因为孕妇青霉素过敏,仅给予头孢类药物治疗12 例;因为初治孕周晚、滴度髙(RPR≥1∶16)给予1 个周期的苄星青霉素后立即增加10 d 头孢曲松1 g/d 静脉滴注共18 例。此30例孕妇治疗效果良好,无1 例死胎死产和先天性梅毒,是否可以说明三代头孢对梅毒感染孕妇的疗效等同于苄星青霉素2 个疗程,尚需积累病例数以进一步验证。
C 组孕妇妊娠期梅毒初次确诊的孕周为33+周,未接受治疗,是梅毒母婴传播的高危人群,发生不良妊娠结局明显高于其他2 组。C 组19 例发生3 例死胎死产和7 例先天性梅毒。妊娠合并早期梅毒,尤其是二期梅毒,孕期如未接受治疗胎儿几乎100%感染。
综上所述,在早期转诊的基础上,采用联合TPPA及RPR 等检测,通过青霉素规范治疗能够显著降低不良妊娠结局的发生率。

