青蒿油对银屑病小鼠模型的干预作用
黄虎,杨志波,万江波,陶侃,郭莉莉,秦紫嫣,何彰华,刘兴
(1.上海上美化妆品股份有限公司,上海 200065;2.湖南中医药大学第二附属医院,湖南 长沙 410005;3.昆药集团股份有限公司,云南 昆明 650106;4.湖南讴睿生物科技有限公司,湖南 长沙 410205)
银屑病是皮肤科常见的慢性、炎症性皮肤病[1-2],其特征为皮损部位形成鳞屑、丘疹、红斑斑块,并伴有剧烈的瘙痒,加之迁延不愈、易反复发作,严重影响了患者的日常生活和工作[3-4]。目前,临床上尚未有完全治愈银屑病的方法,因此,如何有效治疗银屑病,缓解银屑病严重程度已成为研究皮肤疾病的重中之重。
青蒿是中医治疗中常用的中草药[5],蒋岚等[6]研究表明,青蒿及其有效成分可通过抑制角质形成细胞增殖及表皮角化过程而治疗银屑病。青蒿油(Artemisia Naphta oil,AN)是青蒿素提取过程中的残余物质进一步提纯获得的活性成分。近年来,对于青蒿的研究重点主要集中于青蒿素及其衍生物,而针对AN 的研究鲜有报告,增加了青蒿的应用成本,影响了青蒿相关药物的广泛应用。因此,本研究拟通过使用不同浓度的AN 干预银屑病小鼠模型,以探讨AN 对银屑病小鼠模型的干预作用及对血清炎性因子的影响。
1 材料与方法
1.1 材料
1.1.1 动物 32 只6 周龄无特定病原体(SPF)级BALB/c 雌性小鼠购自湖南斯莱克景达公司。严格遵循国家动物饲养规则饲养1 周后进行实验。本研究经湖南中医药大学附属第二医院动物伦理委员会批准。
1.1.2 药物 咪喹莫特乳膏购自四川明欣药业有限公司,吐温购自国药集团,无菌无酶水购自北京索莱宝科技有限公司。
1.1.3 试剂与仪器 HE 染色试剂盒、多聚甲醛购于北京索莱宝科技有限公司;小鼠白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、IL-6 酶联免疫吸附测定(ELISA)检测试剂盒购于上海鑫乐生物科技有限公司;石蜡切片机购自德国莱卡公司;光学显微镜购于日本Olympus 公司;多功能酶标仪购自南京德铁实验设备有限公司。
1.2 方法
1.2.1 AN 的提取 将青蒿叶与石油醚共同加热,过滤获得含有AN 的溶液,将溶液加热,蒸发去除溶液内的石油醚,进一步在100~110 ℃下蒸馏,获得AN 的粗产物。将AN 的粗产物放入精炼罐中110 ℃加热30 min 后冷却。在AN 中加入硅胶,搅拌30 min后过滤以使AN 提取物脱色。分别配制0.5%、1.0%、1.5%、3.0%、5.0%AN(换算成人体使用浓度分别为0.06%、0.11%、0.16%、0.30%和0.55%):在400 μL吐温中分别加入50、100、150、300、500 μL AN,再加入无菌无酶水配置成10 mL 溶液。
1.2.2 构建动物模型 小鼠背部脱毛处理,面积约为2 cm×3 cm。涂抹5%咪喹莫特乳膏42 mg/次,1 次/d,连续7 d,构建银屑病小鼠模型。
1.2.3 药物干预方法 将小鼠按随机数字表法分为对照组、模型组、阴性对照(NC)组、0.5%AN 组、1.0% AN 组、1.5% AN 组、3.0% AN 组和5.0% AN组,每组4 只。对照组和模型组不进行任何干预措施;将配制成不同浓度的AN 放入18 mL 小喷壶中,其余各组按照相应浓度进行喷雾方式喷涂给药干预。连续干预2 周。
1.3 检测指标及方法
1.3.1 小鼠皮损状况 参照银屑病计分评定标准,实验结束后,根据银屑病面积和严重程度指数(Psoriasis area and severity index,PASI)进行评分:将小鼠皮损部位出现的红斑、浸润、脱屑情况分为无、轻、中、重、极重5 个程度(按照小鼠背部皮损最严重的程度计分),0~4 分,4 项指标的分数即该小鼠PASI 评分。评分越高,银屑病皮损程度越严重。
1.3.2 HE 染色观察小鼠病理情况 实验完成后将小鼠处死,取背部皮损程度最严重部位的组织,在多聚甲醛溶液中固定、脱水、石蜡包埋、制作切片、HE 染色,中性树胶封片,光镜下观察皮损组织病理改变并拍照。
1.3.3 ELISA 检测 采用ELISA 检测血清IL-1β、TNF-α 和IL-6 表达水平,按照试剂盒说明书进行操作。加入检测抗体并在室温孵育,加入亲和素过氧化物酶复合物温室孵育1 h,加入显色剂显色反应5~30 min,加入中止液。测定波长450 nm 处吸光度值,绘制标准曲线,根据标准曲线计算炎性因子的浓度。
1.4 统计学分析 本实验数据由GraphPad 处理,最终数据由3 次独立实验结果的均数±标准差(±s)表示。采用LSD-t 检验进行比较,P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠的皮损情况及PASI 评分 本研究通过背部涂抹咪喹莫特乳膏构建银屑病小鼠模型,分别使用0.5%、1.0%、1.5%、3.0%、5.0%等不同浓度的AN 干预,观察各组小鼠的皮损状况并进行评分,见图1~2,以探讨不同浓度AN 缓解银屑病严重程度的效果。与模型组比较,使用AN 干预的小鼠PASI评分均降低,其中5.0%AN 组小鼠PASI 评分降低最显著。与NC 组比较,使用3.0%、5.0%AN 干预的小鼠PASI 评分均降低。
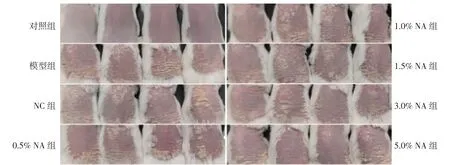
图1 各组小鼠的皮损情况
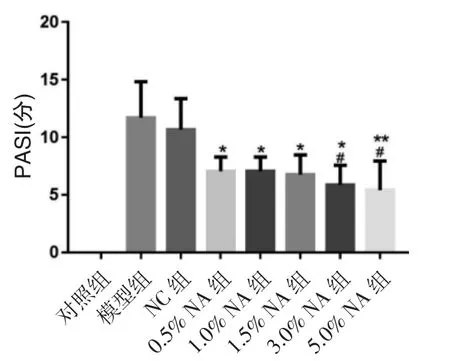
图2 各组小鼠PASI 评分比较
2.2 各组小鼠皮肤组织HE 染色结果 将各组小鼠皮损部位进行HE 染色,见图3。对照组小鼠组织无异常病理变化,其余各组小鼠病理可见表皮组织增厚,棘突增长并伴有大量炎性细胞浸润。使用不同浓度AN 干预后,与模型组和NC 组比较,上述病理损伤均有不同程度好转,其中5.0%AN 组小鼠病理损伤最轻微。
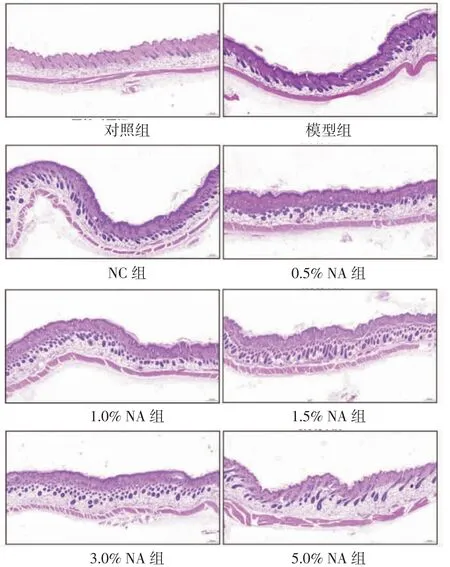
图3 各组小鼠皮肤组织病理情况(HE 染色×50)
2.3 ELISA 检测血清相关炎性因子的表达情况 银屑病是一种慢性、免疫介导的炎症性皮肤疾病。本研究通过ELISA 检测AN 干预后各组小鼠血清IL-1β、TNF-α、IL-6 的表达水平,见图4。与对照组比较,模型组小鼠血清中IL-1β、TNF-α、IL-6 表达水平均显著上调。使用不同浓度AN 干预后,与模型组或NC 组比较,IL-1β、TNF-α、IL-6 表达水平均有不同程度的下降,其中1.0%、5.0%AN 干预的小鼠,上述炎性因子均显著下降。
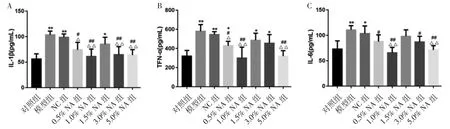
图4 ELISA 检测血清相关炎性因子的表达情况
3 讨论
青蒿是我国传统的中草药,有良好的药用价值[7]。青蒿及其有效成分在治疗银屑病中的作用也已被验证[8-9]。AN 是青蒿中重要的活性成分之一,由青蒿素产生过程中的残渣萃取提纯获得,是一种有止咳平喘、抗菌消炎、抗真菌、抗肿瘤的油性混合物[10-14]。目前,针对AN 干预银屑病及其作用的报告较少,为增加青蒿的应用效率,本研究进一步探索青蒿中的AN 是否在缓解银屑病中发挥作用。首先构建银屑病小鼠模型,分别使用0.5%、1.0%、1.5%、3.0%、5.0%的AN 进行干预,观察小鼠皮损情况、PASI 评分、病理情况,以探讨AN 干预银屑病小鼠模型的作用。结果显示,与模型组比较,使用AN 干预的小鼠PASI评分均降低,其中5.0%AN 组小鼠PASI 评分降低最显著。与NC 组比较,使用3.0%、5.0%AN 干预的小鼠PASI 评分均降低。结果表明,3.0%AN 即可有效缓解银屑病的皮损状况。对照组小鼠组织无异常病理变化,其余各组小鼠病理可见表皮组织增厚,棘突增长并伴有大量炎性细胞浸润。使用不同浓度AN 干预后,与模型组和NC 组比较,上述病理损伤均有好转,其中5.0%AN 组小鼠病理损伤最轻微。即AN 可有效缓解银屑病的皮损状况,5.0%AN 效果最为显著。
银屑病是由于角质形成细胞过度增殖的皮肤疾病,这一过程由一系列复杂的炎性反应介质驱动的,因此,银屑病的发生发展与炎性细胞因子的表达水平密切相关[15-16]。IL-1β、TNF-α、IL-6 等炎性因子已被广泛证实在皮肤炎性反应和银屑病发病机制中的关键作用[17-19]。Chen 等[20]研究表明,AN 可通过抑制胱天蛋白酶-1(Caspase-1)和IL-1β 加工和细胞焦亡,抑制NOD 样受体蛋白3(NLRP3)炎性体活化,进而起到抗炎的作用。AN 还可通过抑制JAK/STATs 激活来抑制炎性反应[21]。因此,本研究进一步探讨AN 在干预银屑病的过程中对血清炎性因子的影响,结果显示与对照组比较,模型组小鼠血清中IL-1β、TNF-α、IL-6 表达水平均显著上调,使用不同浓度AN 干预后,与模型组或NC 组比较,IL-1β、TNF-α、IL-6 表达水平均有不同程度的下降,1.0%、5.0%AN 干预的小鼠,上述炎性因子下降最显著。即0.5%AN 即可有效缓解银屑病的炎性反应,1%、5.0%AN 缓解效果显著。
综上所述,3.0%(成人体使用浓度约0.30%)及以上的AN 可有效缓解银屑病的皮损状况;0.5%(成人体使用浓度约0.06%)AN 即可有效缓解银屑病的炎性反应,1.0%、5.0%(成人体使用浓度约0.16%和0.55%)AN 缓解效果显著。

