原发性干燥综合征继发免疫性血小板减少症的临床特点及危险因素分析
王丽丽,黄鸿影,王 信,赵韵琦,陈琳洁
(蚌埠医科大学第一附属医院 风湿免疫科,安徽 蚌埠 233004)
干燥综合征(Sjögren′s syndrome,SS)是一种多系统受累的慢性炎症性自身免疫性疾病,其特点是外分泌腺的淋巴细胞浸润,最常见的表现是口眼干燥。此外,SS的腺体外损伤也普遍存在,其中血液系统是其受累的系统之一,而血小板减少是较为严重的表现[1-2]。对于原发性干燥综合征(pSS)继发免疫性血小板减少症(ITP)的临床研究,国内外文献多见小样本单中心研究以及病例报道[3-4]。本研究旨在了解pSS继发ITP的发生率、临床及免疫学特征,以提高临床医生对该病的认识。
1 资料与方法
1.1 病例选择
收集蚌埠医科大学第一附属医院2016-2020年pSS病人498例,pSS的诊断基于2002年干燥综合征国际分类(诊断)标准[5]。入选标准:符合pSS的诊断标准;年龄>18岁;病例资料完整。排除标准:(1)合并其他自身免疫病,如系统性红斑狼疮、类风湿关节炎、抗磷脂抗体综合征等;(2)合并其他血液系统疾病,如白血病、淋巴瘤、骨髓增生异常综合征、脾功能亢进等;(3)药物性血小板减少;(4)某些病毒或细菌感染,如人类免疫缺陷病毒(HIV)、丙型肝炎、巨细胞病毒等;(5)骨髓移植、放化疗等。所有继发性ITP病人均符合2011年美国血液病协会(American Society of Hematology,ASH)指南[6]的诊断标准。
1.2 病例分组
根据2011年ASH发布的免疫性血小板减少症循证实践指南[6],将血小板计数(PLT)<100×109/L的病人纳入观察组,其余病人纳入对照组。
1.3 数据收集
收集病人的(1)基本信息:性别、发病年龄、病程等。(2)实验室检查指标:血常规、尿常规、肝功能、肾功能、红细胞沉降率(ESR)、C反应蛋白(CRP)、凝血功能、低蛋白血症界定为血浆总蛋白质<60 g/L,且白蛋白<30 g/L。(3)系统累及情况:发热、盗汗及体质量减轻等全身症状、淋巴结及腺体累及况、关节炎、间质性肺病(ILD)、肾脏受累情况等。(4)免疫学指标:血清自身抗体谱、免疫球蛋白、补体等。(5)疾病活动评分与系统器官受累严重程度评判:所有pSS病人的疾病活动评分标准均按照2010年欧洲抗风湿病联盟(European League Against Rheumatism,EULAR) 制定的pSS疾病活动评分(EULAR Sjögren′s Syndrome Disease Activity Index,ESSDAI)[7];亦参照ESSDAI的有关标准评判系统器官受累严重程度。
1.4 统计学方法
采用t检验、χ2检验和多因素logistic回归分析。
2 结果
2.1 2组一般情况及实验室检查结果比较
498例pSS病人中继发ITP病人89例(17.87%)。2组病人年龄和病程比较差异均无统计学意义(P>0.05),对照组女性构成比(96.5%)较观察组(86.5%)高(P<0.01)。观察组血红蛋白含量、凝血酶原活动度(PT比)和纤维蛋白原(Cfib)水平低于对照组,天冬氨酸氨基转移酶(AST)异常升高病人比例高于对照组,差异均有统计学意义(P<0.05~P<0.01)。而在白细胞计数、血肌酐及尿素氮、低蛋白血症、凝血酶原时间(PT)、D-二聚体等指标2组差异均无统计学意义(P>0.05)(见表1)。

表1 2组病人临床危险因素单因素分析
2.2 2组病人系统累及情况比较
观察组病人关节累及程度和间质性肺病严重程度低于对照组,ESSDAI评分显著高于对照组,差异均有统计学意义(P<0.05~P<0.01);而全身症状、淋巴结累及、腺体累及以及肾脏受累情况2组差异均无统计学意义(P>0.05)(见表2)。
2.3 2组病人免疫学指标比较
2组在ESR、CRP、免疫球蛋白、抗SSA抗体、抗SSB抗体及抗着丝点抗体指标方面差异均无统计学意义(P>0.05);但观察组补体C3和C4水平低于对照组,差异均有统计学意义(P<0.01)(见表3)。
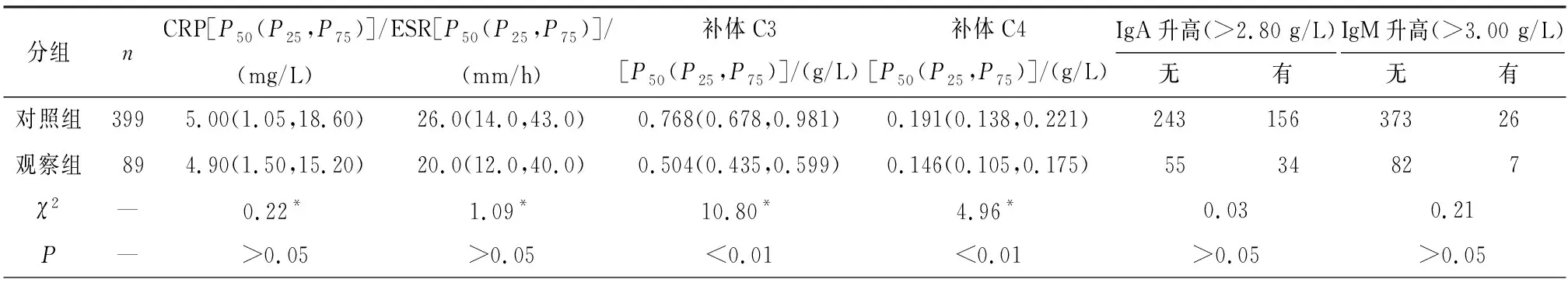
表3 2组病人免疫学指标比较
2.4 多因素logistic回归分析
为了预测pSS继发ITP疾病发生发展的临床危险因素,我们按照前述方法进行了多因素logistic回归分析。其中对AST升高、关节受累和间质性肺病进行赋值。无AST升高赋值为“0”,有AST升高赋值为“1”;无关节受累赋值为“0”,轻度受累赋值为“1”,中重度受累赋值为“2”;无间质性肺病赋值为“0”,有间质性肺病赋值为“1”。其余危险因素均以变量的具体数值纳入回归分析。结果显示:关节受累、间质性肺病、ESSDAI评分、补体C3为pSS继发ITP病例的独立危险因素(见表4)。
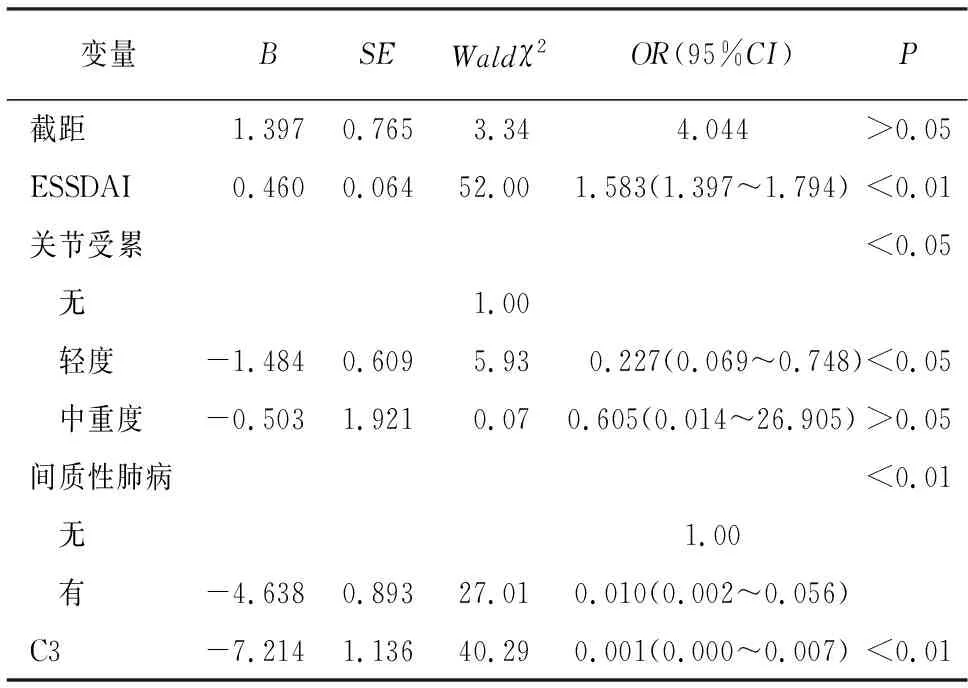
表4 pSS继发ITP相关危险因素分析
3 讨论
继发性ITP是排除原发性ITP,一种免疫介导的成人和儿童的获得性疾病,其特征是血小板破坏增加或血小板生成受损,导致PLT持续性或短暂性减低(PLT<100×109/L)和不同程度的出血风险[8]。自身免疫性疾病、淋巴组织增生性疾病、传染源、输血或药物诱导是其常见继发因素,共占 ITP 病例的20%[9-10]。据文献报道,在欧洲5%~7% pSS病人可发生血小板减少[11],本研究共有89例(17.87%)pSS继发ITP。一项基于中国人群的研究报道,pSS病人继发ITP的患病率为12.03%[12],提示pSS病人继发ITP比率较欧洲病人更高。此外,本研究纳入的病人均为住院病人,病情相对较重,更易具有多系统受累表现(包括血液系统损害)。总之,我们认为继发性ITP在pSS病人中很常见,提示这些病人在病情活动期需要密切监测血小板变化。
本研究发现,继发ITP的pSS病人的关节炎表现较少,多因素回归分析显示关节炎的发生是继发ITP发生发展的保护性因素。作为来自巨核细胞的小型无核细胞,血小板在凝血止血和修复破损的血管等方面的积极作用已经得到了人们的共识。同时,在免疫性疾病的发生发展中,血小板作为连接血栓形成、炎症和免疫连续体的多功能效应细胞[13-14],在调节先天性和适应性免疫等方面的作用也逐渐被认识到[15-16]。BOILARD等17-18研究发现,在血小板耗尽的小鼠模型中,关节炎的发生明显减少,并证实了血小板通过胶原蛋白依赖性微粒(MP)产生并放大关节炎中的炎症。此外,先前也有研究发现一些细胞因子如白细胞介素1(IL-1)等通过血小板介导,促进了体外滑膜细胞及关节间隙促炎介质的表达[19-20]。这些研究都提示了血小板可能是关节炎的发生发展的积极促进者。本研究中,继发ITP的pSS病人关节炎发生率更低,提示了较低计数的血小板可能一定程度上减少了关节炎的发生和发展。然而,更低的关节炎发生率和PLT减少二者的因果关系尚不能明确,具体的机制也需要进一步深入探讨。由于轻度血小板减少一般缺乏特异性症状,因此在临床上对于无关节炎症的pSS病人,我们需要注意监测其PLT,对于继发ITP尽早发现,及时干预。
近期一项基于中国人群的大样本横断面研究提示不伴有ITP的pSS病人表现出更高的间质性肺病患病率[21]。我们的研究与上述研究结果相一致。这提示ITP和间质性肺病的发生和发展可能有相互促进作用。国外有研究[22]证实,在其他自身免疫病如系统性硬化症(SSc)相关间质性肺病(ILD),其主要致病途径包括巨噬细胞迁移和激活、上调转化生长因子β(TGF-β)和干扰素(IFN)调节基因的表达。增加的TGF-β信号转导是导致SSc的血管和肺纤维化特征的重要因素[23]。血小板是体内TGF-β的主要载体,其TGF-β含量是其他细胞的40~100倍[24],且认为其中45%的基础血浆TGF水平来自血小板[25-26]。此外,血小板数量与外周血中TGF-β浓度呈正相关[27-30],证实血小板作为TGF-β的活性载体发挥着重要作用。因此我们猜想,与对照组相比,继发ITP病人可能含有低浓度的TGF-β,这可能是观察组间质性肺病发生率减低的原因之一。然而,国内外文献尚未明确pSS继发ITP与间质性肺病之间的因果联系,二者相关性的潜在机制尚需进一步研究。我们的初步研究结果表明,肺部受累较少的pSS病人更倾向于发生ITP,提示临床上无其他器官受累的病人,更需要密切发生监测血小板减少症的发生。
在临床实践中,我们发现继发ITP的pSS病人常处于疾病的活动期,我们的研究结果证实了这一临床经验。本研究提示pSS继发ITP病人表现出更低的补体C3水平和更高的ESSDAI,这一发现也与之前的研究[12]结果相一致。国内文献[31]报道称,pSS相关的血小板减少症病人由于B细胞中Toll样受体7信号通路(TLR7)上调,导致其下游IL-8和IL-1β表达水平升高,从而引起更强的全身炎症反应,本研究的结果也证实了这一结论,这表明了体液免疫反应紊乱在pSS病人发生血小板破坏中的促进作用。然而,或许有其他自身抗体可能间接参与导致血小板破坏以及T细胞是如何参与ITP的发生发展,仍有待研究。因此在临床工作中,需要临床医生对pSS病人进行积极的疾病活动度评估,并及时控制病人的病情活动,对于预防ITP的发生有一定的积极意义。
多年来,pSS继发ITP一直被忽视,我们对此了解的仍然有限。本研究纳入的病例数较多,初步探讨了pSS继发ITP病人的发生率、临床及实验室指标等特征。但本研究仍存在较多局限性:首先,这是一项单中心的回顾性研究;其次,本研究主要关注病人的临床特征及实验室检查,还需要进一步研究病人的治疗和预后的随访;第三,我们的研究中纳入的病例数主要为住院病人,病人病情可能较重,导致了本研究可能存在选择偏倚。
总之,继发ITP在pSS病人中很常见。我们的研究表明,pSS继发ITP病人表现出更少的间质性肺病和关节炎的发生。补体C3水平的下降及更高的ESSDAI被视为pSS继发ITP的独立危险因素。此外,血小板在关节炎和肺纤维化的发展过程中可能发挥着重要的关键作用,这需要在未来更多的病例研究中去证实。

