血清IL-33和TNF-α活性及外周血淋巴细胞中NF-κB水平与冠心病不同程度病变的相关性分析
鲜 维,谭 鑫,耿嘉逸,邹仕英,杨海晨,康品方,3,张 恒
(1.蚌埠医科大学第一附属医院 心血管内科,安徽 蚌埠 233004;蚌埠医科大学2.公共卫生学院,3.心脑血管病研究中心,安徽 蚌埠 233030)
目前心血管系统疾病已成为城乡居民总死亡因素的首要位置,其中冠心病(coronary heart disease,CHD)是心血管系统中最常见且致死率最高的疾病。CHD是一种位于冠状动脉(冠脉)壁上的以炎症和斑块积累为特征的疾病,这些斑块主要由脂质、钙和炎性细胞组成,并且这些病理改变最终可导致冠脉狭窄乃至供血不足而引起心肌功能障碍甚至死亡[1-4]。尽管已经发现了许多危险因素,如不良饮食、吸烟、高血压、糖尿病、高脂血症、肥胖等,CHD的病因和发病机制仍然尚未完全了解[5-6]。
白细胞介素-33(IL-33)是近年来发现的IL-1细胞因子家族的新成员,具有生物活性,可与靶细胞膜上的生长刺激表达基因2蛋白(ST2)结合形成跨膜复合体,形成IL-33/ST2信号通路,参与Th2活化相关的多种疾病发生与进展[7-9]。IL-33表达于多种组织器官中,而主要表达IL-33的是人类不同器官和组织中的各种内皮细胞,此外,在其他类型细胞,如上皮细胞、平滑肌细胞和纤维母细胞等也有IL-33的表达[10]。目前有研究[11]表明血清IL-33与CHD的发展存在一定的联系。肿瘤坏死因子(tumor necrosis factor,TNF-α)是一个至少由19种细胞因子组成的肽介质家族的成员,具有重要的促炎特性,在先天和适应性免疫、细胞增殖和凋亡过程中发挥关键作用[12]。有研究[13]表明TNF-α在动脉粥样硬化的病理进展中发挥着极为重要的作用,它可以通过促进内皮细胞黏附分子的表达,招募和激活炎症细胞,启动动脉壁内的炎性反应。核因子κB(nuclear factor kappa B,NF-κB)家族转录因子在细胞环境中作为应激源发挥重要作用,并控制重要调控基因的表达,如免疫、炎症、死亡和细胞增殖。NF-κB蛋白位于细胞质中,可被各种细胞刺激激活[14-15]。
目前,IL-33和TNF-α在CHD中的具体致病机制尚不明确,血清中IL-33和TNF-α水平与CHD的相关性也仍待继续研究,本研究拟检测不同病变程度CHD病人血清中IL-33和TNF-α活性水平,明确CHD病人病变程度与IL-33和TNF-α活性水平之间的关系以及外周血淋巴细胞中NF-κB蛋白水平变化在其中的关系,为CHD的临床诊疗提供一些新的思路。
1 资料与方法
1.1 研究对象
收集2019年1月至2020年6月蚌埠医科大学第一附属医院心内科确诊患有CHD的病人共167例,男98例,女69例,年龄(64.05±10.218)岁。所有病人均通过常规12导联心电图或Holter、心脏彩超和冠脉造影等检查明确病情。所有病人收治入院后及时采血完成血常规、生化常规检查并记录血压和体质量指数。CHD病人按照冠脉造影中记录的冠脉各支病变情况,依据Gensini评分[16]将病人分为:轻度病变组(<30分,LS组)84例,中度病变组(30~<60分,MS组)54例,重度病变组(≥60分,HS组)29例。其中有CHD发作症状但行冠脉造影未见明显异常者作为对照组(CON组)共27例。4组一般资料差异均无统计学意义(P>0.05)(见表1),具有可比性。

表1 4组病人入院时基线资料比较
1.2 入选标准
纳入标准:(1)无严重精神系统疾病者;(2)病人及其家属均知晓并自愿接受;(3)有正常认知、书写、沟通能力者。排除标准:既往有心脏瓣膜病、心肌病、急性心肌炎病人,既往有恶性肿瘤、风湿免疫系统疾病或内分泌及代谢性疾病、免疫功能低下、患有神经系统退行性改变疾病、心房颤动及感染性疾病病人[17],不能配合治疗或中途退出者。
1.3 一般资料收集
记录病人的姓名、性别、年龄等基础信息,吸烟饮酒史等一般信息,有无高血压、糖尿病、肝炎等慢性病病史,以及血细胞计数[红细胞、白细胞、血小板、中性粒细胞]、总胆红素、胆固醇及三酰甘油(TG)、高密度脂蛋白(HDL)、总蛋白、C反应蛋白(CRP)、B型脑钠肽(BNP)等相关指标。
1.4 标本采集
收集入院后24 h内肘静脉血(禁食12 h后)5 mL于肝素抗凝试管中,4 ℃,3 000 r/min,5 min离心,吸取上层血清,-80 ℃冰箱中备用;将剩余试管中液体转移至15 mL离心管中,加入等体积PBS混匀后,缓慢加入淋巴细胞分离液,4 ℃,2 000 r/min,20 min离心;缓慢吸出中间白色薄膜状淋巴细胞;加5倍以上体积的PBS洗2次,每次离心1 500 r/min,10 min;细胞沉淀用冻存液保存至液氮中备用。
1.5 血清IL-33和TNF-α活性检测
标本彻底融化后,采用ELISA法,使用上海羽朵生物科技有限公司的人IL-33和TNF-α ELISA试剂盒,分别检测IL-33和TNF-α的吸光度值并计算浓度。
1.6 Western blotting检测NF-κB蛋白表达
严格按照说明书步骤提取外周血淋巴细胞,在提取的细胞中加入适量RIPA裂解液(RIPA∶PMSF=100∶1),冰上裂解30 min,4 ℃,12 000 r/min,10 min离心;取出上层蛋白悬液使用蛋白定量试剂盒(碧云天)进行定量;拟定每孔30 μg进行SDS-PAGE电泳,用PVDF膜4 ℃进行转膜,5%脱脂奶粉封闭后,4 ℃孵育一抗过夜,TBST洗膜4次,每次5 min;室温孵育二抗90 min,洗膜3次,每次10 min,应用ECL进行曝光显影。
1.7 统计学方法
采用t检验、方差分析、q检验、χ2检验和χ2分割检验。
2 结果
2.1 CHD不同样本的临床指标分析
各组间TG、总蛋白、HDL及低密度脂蛋白(LDL)、WBC、淋巴/单核细胞差异均无统计学意义(P>0.05)(见表2)。

表2 各组病人生化指标及血细胞计数比较
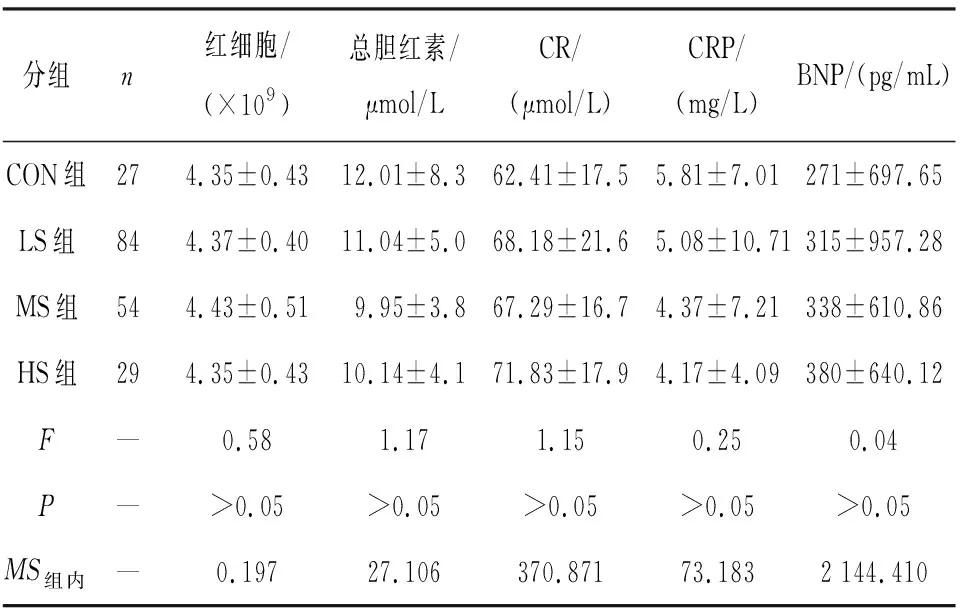
分组n红细胞/(×109)总胆红素/μmol/L CR/(μmol/L)CRP/(mg/L)BNP/(pg/mL)CON组274.35±0.4312.01±8.362.41±17.55.81±7.01271±697.65LS组844.37±0.4011.04±5.068.18±21.65.08±10.71315±957.28MS组544.43±0.519.95±3.867.29±16.74.37±7.21338±610.86HS组294.35±0.4310.14±4.171.83±17.94.17±4.09380±640.12F—0.581.171.150.250.04P—>0.05>0.05>0.05>0.05>0.05MS组内— 0.19727.106370.87173.1832 144.410
2.2 血清IL-33和TNF-α活性水平比较
HS组血清IL-33水平较LS组CON组升高(P<0.05),且随着冠脉病变严重程度加重其含量逐渐升高;血清TNF-α水平也随着冠脉病变严重程度的加重而逐渐升高(P<0.01),且两者之间呈正相关关系(r=0.663,P<0.01)(见表3)。

表3 血清IL-33和TNF-α活性水平在CHD中的变化
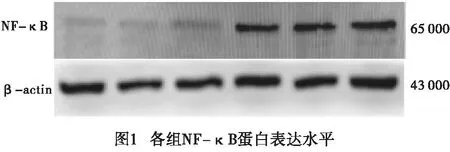
2.3 外周血淋巴细胞中NF-κB蛋白的表达
Western blotting结果显示,与CON组(0.57±0.09)相比,CHD组(0.96±0.05)外周血淋巴细胞中NF-κB蛋白表达增加,差异有统计学意义(t=4.85,P<0.01)(见图1)。
3 讨论
《中国心血管健康与疾病报告2019》指出,中国的心血管疾病患病率和死亡率仍处于上升趋势[8]。据估计,我国现患的心血管疾病人数大约为3.3亿人,其中CHD是心血管疾病中的常见病,患病人数高达1 100万[18],因此,寻找相关的发病机制对CHD的早期预防具有及其重要的意义。
有研究[19]发现根据不同来源信号刺激,IL-33呈现出的促炎或抗炎作用主要具有两种作用模式,一种是作为细胞因子或警示信号的胞外作用模式,另一种是作为转录调节因子的胞内作用模式。还有研究[20]发现IL-33/ST2通路在急性冠脉综合征病人心肌炎性反应进程发挥重要作用,同时该通道与此类病人的远期心肌梗死以及心力衰竭等预后密切相关。SCHMITZ等[21-22]报道IL-33可以激活内皮细胞、促进炎症的发生,同时又可以诱导人的内皮细胞向炎症表型转化,具有显著的促炎、促血栓形成作用,并且在冠脉的斑块处呈高表达状态,它的水平与斑块破裂后不良心血管事件具有紧密的临床联系。同时,MCLAREN等[23]实验发现IL-33还可以通过降低与胆固醇摄取相关的关键基因mRNA表达和增加与胆固醇流出相关的基因表达来减少巨噬细胞泡沫细胞的形成。IL-33在CHD的发生、发展过程中起着的保护作用。在CHD的发生发展过程中,随着冠脉粥样斑块的病变以及狭窄的加重,CHD病人的IL-33水平也随之升高,这可能与病变区域的炎症反应激活、凋亡等机制反应性激活有关,并且随着冠脉病变程度的加重,其炎症状态也加重,凋亡激活等造成的抑制性反馈机制促进IL-33的表达,抑制病变的进一步加重,反映了机体在炎症状态下的自我保护及代偿机制[24-25]。本研究发现,与CON组相比,IL-33的水平随着冠脉病变的严重程度与病变支数的增加而升高,提示了IL-33可能在CHD 的发生发展中发挥了重要的作用。
TNF-α是炎症反应的主要启动因子之一,是损伤等炎性反应时由巨噬细胞、单核细胞、平滑肌细胞、内皮细胞等分泌的多肽类物质,在炎症和代谢中起着重要的作用[26-27]。TNF-α可以通过促进内皮细胞黏附分子的表达,招募和激活炎症细胞,启动动脉壁内的炎症级联,同时它也可以调控血管壁细胞的增殖、坏死和凋亡,促进细胞外基质与血管活性物质的合成、分泌,导致脂代谢异常,进而在CHD的血管损伤和心肌缺血中起着重要作用[28-29]。在本研究中,我们发现随着CHD的病变严重程度的增加,血清TNF-α水平也随之而升高。
NF-κB蛋白可以调节数百个基因的表达,这些基因调控着重要的生理过程,如炎症、免疫、增殖和细胞死亡。由于NF-κB的活性是由许多不同的刺激自发调节的,NF-κB蛋白可以被认为是细胞稳态的调节器[14-15,30]。有研究[31]显示,NF-κB能够通过调控TNF-α从而改变人支气管上皮细胞的炎症状态以及细胞增殖。HELBIG等[32]研究发现,在小鼠骨髓源性树突状细胞中,IL-33可能通过MyD88-IKK2-NF-κB、p38-MK2/3等信号通路,诱导TNF-α的产生。本次研究中发现在CHD病人的外周血淋巴细胞中,NF-κB的表达较冠脉正常者显著增高,同时通过Pearson相关分析发现,IL-33的变化与TNF-α水平呈正相关关系,因此我们推测,IL-33可能与TNF-α相互作用,并通过调控NF-κB的表达参与了CHD的发生、发展。
综上所述,我们观察到IL-33和TNF-α活性水平随着冠脉粥样硬化的病变程度加重而升高,且两者含量变化呈正相关关系,同时外周血淋巴细胞中的NF-κB蛋白可能在CHD的发展中发挥着重要作用,但其中的相关机制尚不明确,仍有待于进一步的研究证实。同时,它们提供了一个可能判断CHD严重程度的指标,并可能促使未来的研究探讨IL-33和TNF-α在CHD病人急性冠脉事件风险中的治疗作用。

