多模态超声影像联合临床指标预测缺血性脑卒中进展价值
董 莉 ,宁荣萍 ,肖琼怡
(1)云南省第三人民医院超声医学影像科;2)急诊内科,云南 昆明 650011)
缺血性脑卒中(ischemic stroke,IS)是脑血管疾病中较为多见类型,其中动脉粥样硬化病变是诱发该病基础,大脑持续缺氧缺血5 min 后,可引起神经细胞出现不可逆损伤,进而引发脑卒中,这是我国三大死亡疾病之一[1-2]。IS 患者发病6 h至1 周内后神经功能缺损持续加重或呈阶梯式加重,称为进展性缺血性脑卒中(progressive ischemic stroke,PIS),颈动脉斑块易损是PIS 发生主要原因[3],而超声是其常用检测方法,是一种安全无创操作的成像技术,可重复、实时探查动脉病灶区域内部结构和相邻部位结构,能准确评估斑块损伤情况[4]。近年也有研究显示,一些特异性、敏感性较高临床指标可有效预测IS,如同型半胱氨酸(homocysteine,Hcy)、尿酸(uric acid,UA),且具有较好的较预测价值[5-6]。但临床有关多模态超声影像与临床指标联合预测IS 的研究少见。基于此,本研究通过收集134 例IS 患者病例资料,创新性探究多模态超声影像联合临床指标预测缺血性脑卒中进展价值。
1 资料与方法
1.1 病例资料
选取2020 年1 月至2022 年10 月云南省第三人民医院收治的134 例IS 患者作为研究对象,患者入院7 d,根据美国国立卫生研究院卒中量表(National Institute tof Heath stroke scale,NIHSS)评分划分为PIS 组(PIS 组,n=20)、非PIS 组(NPIS组,n=114)。纳入标准:符合《中国急性缺血性脑卒中诊治指南2018》[7]诊断标准,经影像学检查确诊;发病1 d 内入院;患者发病后神经系统缺损持续加重,入院15 h~7 d 的NIHSS 较入院后最低测评结果增加≥2 分,判断为PIS;入院1 周内进行颈动脉检查;无神经、内分泌等系统功能障碍。排除标准:急性颅脑外伤或脑出血;存在心功能不全可造成疾病进展;心源性或其他原因栓子来源者;恶性肿瘤;家族遗传史;非动脉硬化因素引起的头颈部血管狭窄或闭塞;肝肾功能衰竭;严重传染性疾病;严重交流障碍。本研究患者均签署知情同意书,并获得云南省第三人民医院伦理委员会审批(伦审2019-006-01)。
1.2 多模态超声影像检测方法
常规超声检查:采用飞利浦EPIQ5 和TOSHIBA Aplio 400 彩色多普勒超声诊断仪进行扫描,先行常规二维超声检查,探头频率为5~12 MHz,取仰卧位,暴露颈部,从颈总动脉开支至颈动脉分叉处,并扫描颈内外动脉的颅外段,观察各动脉走行、形态,及动脉管壁、管腔情况,记录有无动脉形成(斑块厚度>1.5 mm 为粥样硬化斑块形成[8])、斑块性质、回声特征等。
超声造影(contrast-enhanced ultrasound,CEUS):选择声诺维(意大利Bracco)造影剂,经5.0 mL 生理盐水稀释后制成混悬液,肘静脉团注造影剂,采集动态造影图像,保存图形,观察造影剂显影、分布情况。图像经SonoLiver 处理后,由2 位高年资临床医师以双盲法阅片,勾画感兴趣区,观察有无斑块形成、斑块增强模式(1 级:外膜增强,斑块内未见增强;2 级:斑块内少量散在点状增强;3 级:线状增强伸入至斑块内部[9]),经时间-强度变化记录始增时间、峰值时间(time to peak,TTP)、曲线上升支斜率、平均通过时间(mean transit time,MTT)、曲线下面积(AUCTC)、峰值强度(peak intensity,PI)。
实时剪切波弹性成像(shear wave elastopraphy,SWE):采切换SWE 功能,叮嘱患者需屏气,保存5~10 s 动态图像,启动QBOX 功能,勾画感兴趣区域,计算2 侧颈动脉壁平均弹性模量的平均值(MEmean)、最大弹性模量的平均值(MEmax)、最小弹性模量的平均值(MEmin)。
1.3 观察指标
(1)收集2 组临床指标,包括性别、基线NIHSS 评分、年龄、基线老年营养风险指数(geriatric nutritional risk index,GNRI)评分、体重指数(body mass index,BMI)、基线Hcy、发病至入院时间、基线UA、基线白细胞计数(white blood cell count,WBC)、基线C 反 应蛋白(creactive protein,CRP)、吸烟史、急性缺血性脑卒中实验(the trial of org 10172 in acute stroke treatment,TOAST)分型、饮酒史、合并疾病、脑卒中史;(2)比较2 组多模态超声影像表现(颈动脉斑块、颈动脉斑块性质、颈动脉斑块回声特征、颈动脉斑块增强模式)及参数(始增时间、TTP、曲线上升支斜率、MTT、AUCTC、PI、MEmean、MEmax、MEmin);(3)Logistic 分析PIS 发病的影响因素;(4)列线图绘制PIS 发生风险模型,校准曲线、ROC 曲线对该模型进行验证。
1.4 统计学处理
采用EXCEL 2019 收集归纳临床资料,经软件SPSS22.0 处理数据,计量资料行Shapiro-Wilk正态检验、Levene 方差齐性检验,确认呈方差齐性且近似服从呈正态分布以()表示、t检验;计数资料用n(%)表示、χ2检验,等级资料用秩和检验,多因素分析采用Logistic;用R 软件包、rms 程序构建列线图模型,采用校准曲线、ROC曲线验证该列线图模型。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组临床指标比较
2 组年龄、基线GNRI 评分、基线Hcy、基线UA 比较,差异有统计学意义(P<0.05),见表1。
表1 2 组临床指标[()/n(%)](1)Tab.1 Clinical indicators of patients in the two groups [)/n(%)](1)
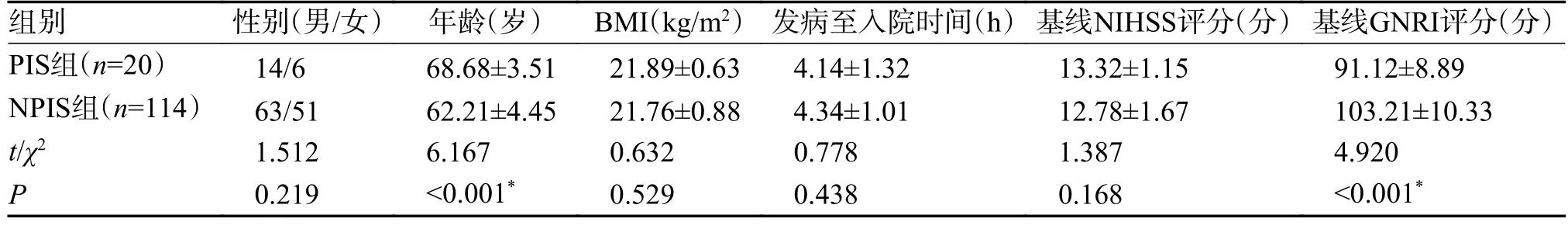
表1 2 组临床指标[()/n(%)](1)Tab.1 Clinical indicators of patients in the two groups [)/n(%)](1)
*P<0.05。
表1 2 组临床指标[()/n(%)](2)Tab.1 Clinical indicators of patients in the two groups [)/n(%)](2)
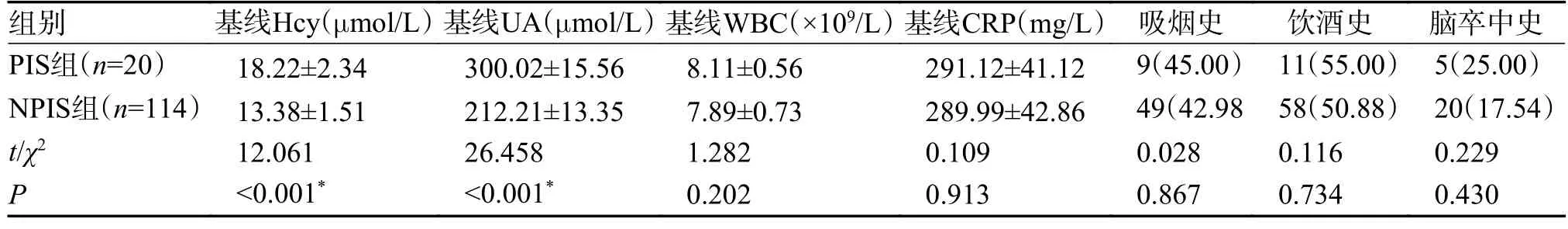
表1 2 组临床指标[()/n(%)](1)Tab.1 Clinical indicators of patients in the two groups [)/n(%)](1)
*P<0.05。
表1 2 组临床指标[()/n(%)](3)Tab.1 Clinical indicators of patients in the two groups [)/n(%)](3)
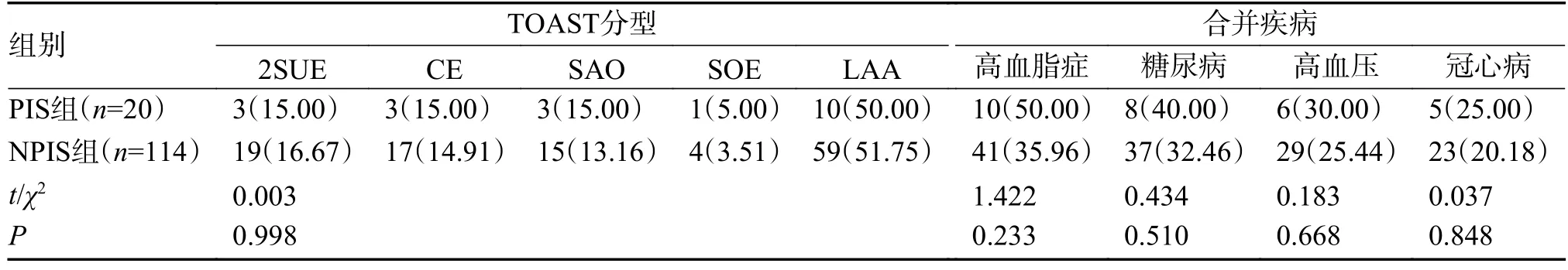
表1 2 组临床指标[()/n(%)](1)Tab.1 Clinical indicators of patients in the two groups [)/n(%)](1)
*P<0.05。
2.2 2 组多模态超声影像表现及参数比较
2 组TTP、PI、AUCTC、颈动脉斑块增强模式、MEmax、MEmin 比较,差异有统计学意义(P<0.001),见表2~表4、图1 和图2。
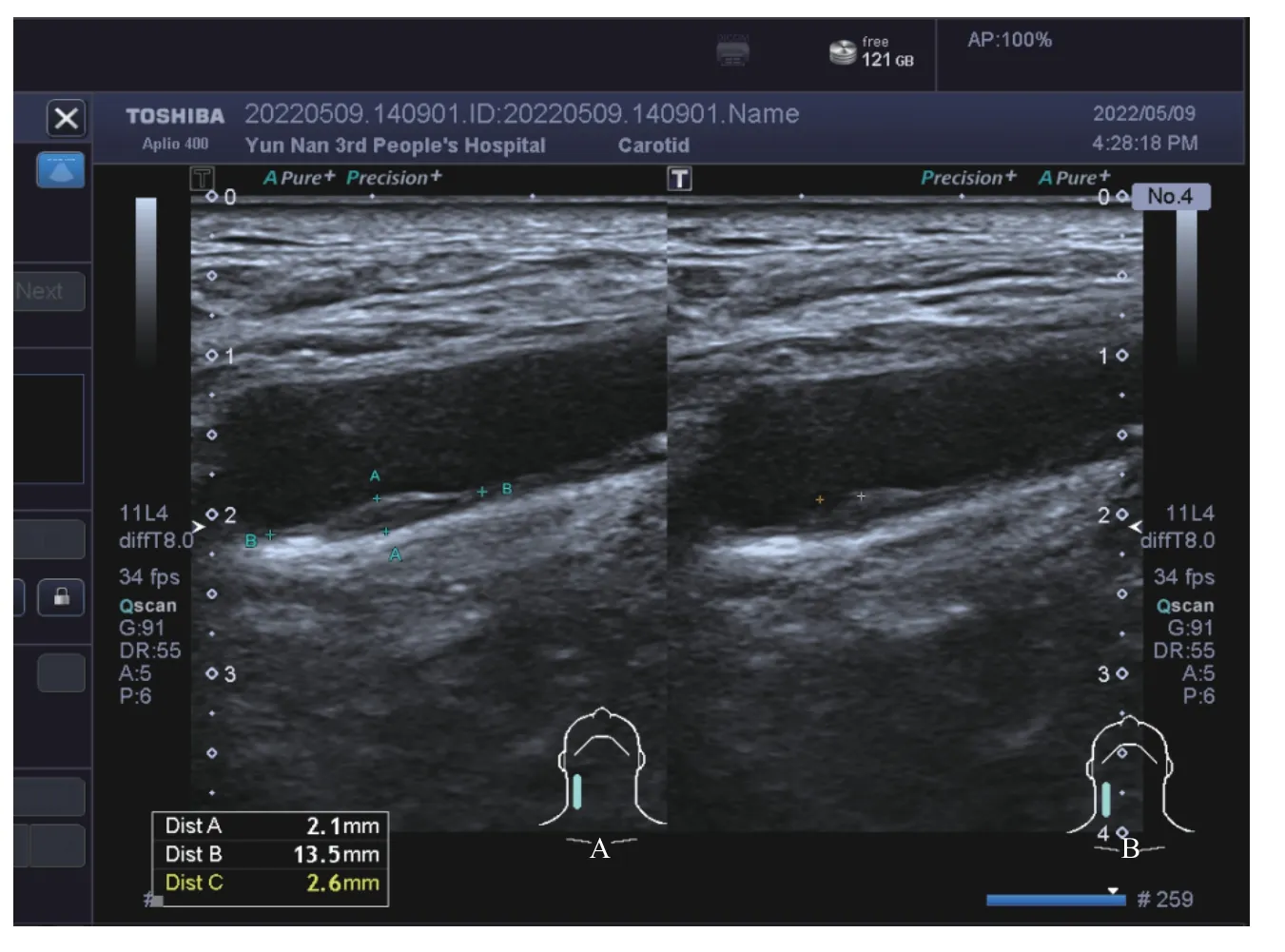
图1 常规超声影像学表现Fig.1 Routine ultrasound imaging findings
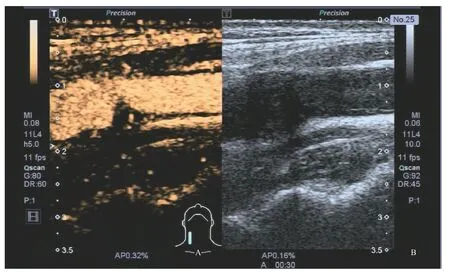
图2 超声造影检查Fig.2 Contrast enhanced ultrasound examination
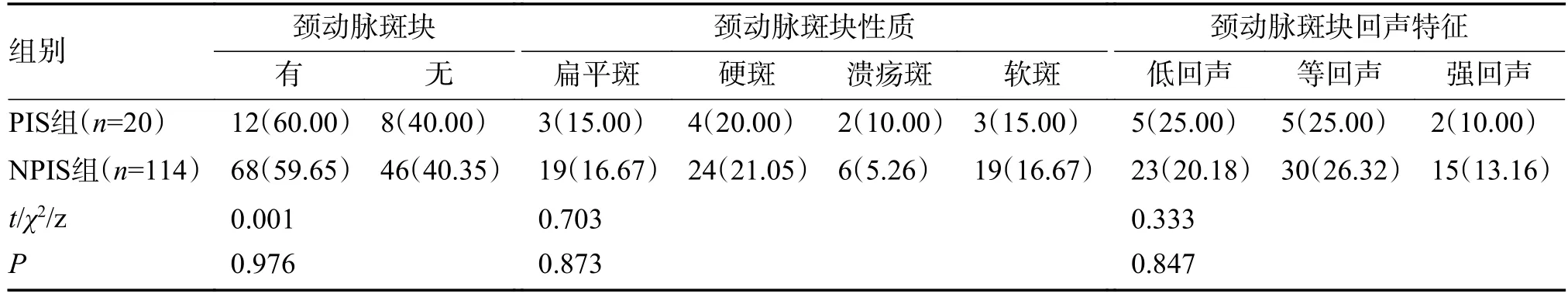
表2 2 组常规超声表现[n(%)]Tab.2 Routine ultrasound manifestations of patients in the two groups[n(%)]
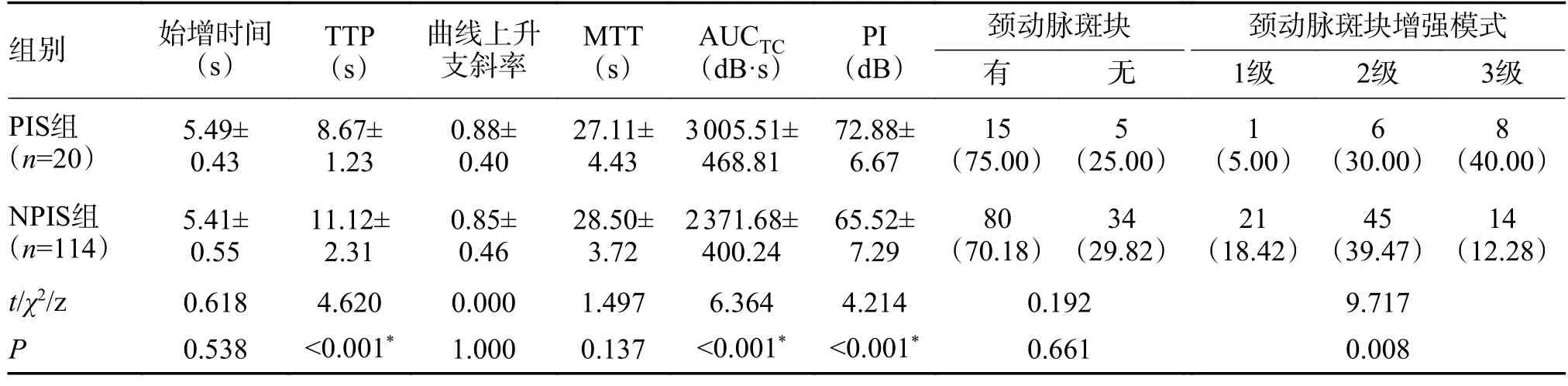
表3 CUES 定量参数[n(%)]Tab.3 CUES quantitative parameters [n(%)]
表4 SWE 定量参数(,kPa)Tab.4 SWE quantitative parameters(,kPa)
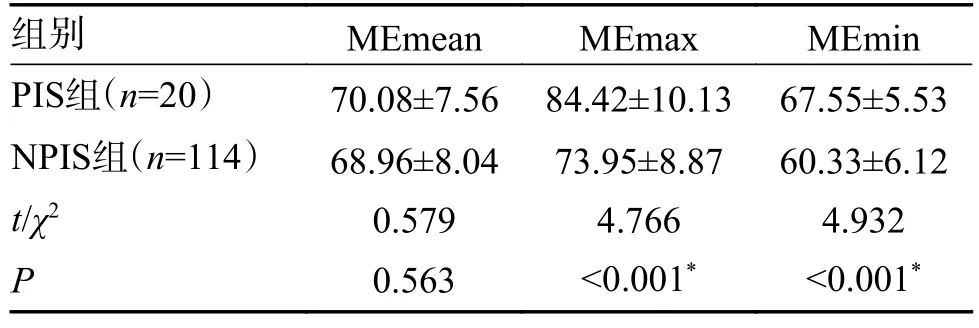
表4 SWE 定量参数(,kPa)Tab.4 SWE quantitative parameters(,kPa)
*P<0.05。
右侧颈总动脉分叉处后壁低回声斑块伴管腔局限性狭窄(面积狭窄率约62%),斑块内脂质及新生血管形成—高度风险斑块。
2.3 PIS 发病多因素分析
以IS 是否进展为因变量(是=1,否=0),表1和表2 具有统计学意义指标作为自变量纳入Logistic 回归方程,结果显示,基线GNRI 评分、基线UA、TTP、PI、AUCTC、颈动脉斑块增强模式、MEmax、MEmin 是PIS 影响因素(P<0.05),见表5。
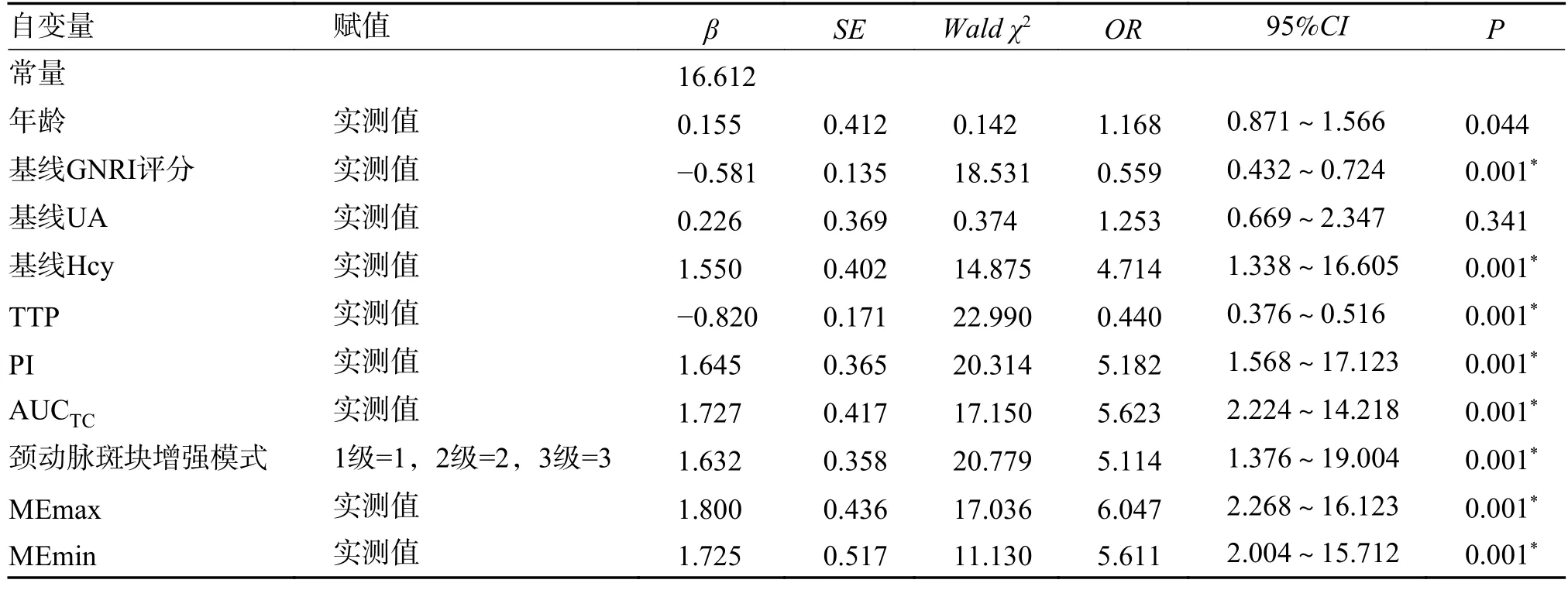
表5 PIS 发病多因素分析Tab.5 Multivariate analysis of PIS incidence
2.4 列线图模型构建与验证
(1)以IS 患者病情是否进展作为结局,结合Logistic 回归分析筛选出的影响因素(基线GNRI评分、基线UA、TTP、PI、AUCTC、颈动脉斑块增强模式、MEmax、MEmin)绘制列线图模型,各影响因素对应列线图上方的Points 数值为该因素得分,各影响因素得分之和对应概率值为PIS 发生风险,见图3;(2)ROC 曲线发现,列线图模型预测PIS 的AUC 为0.862(95%CI0.786~0.939),敏感度及特异度分别为80.00%、78.07%,见图4;(3)校准曲线发现,列线图模型预测PIS 准确度的预测效能与实际吻合较好,见图5。

图3 列线图模型Fig.3 Column line diagram model
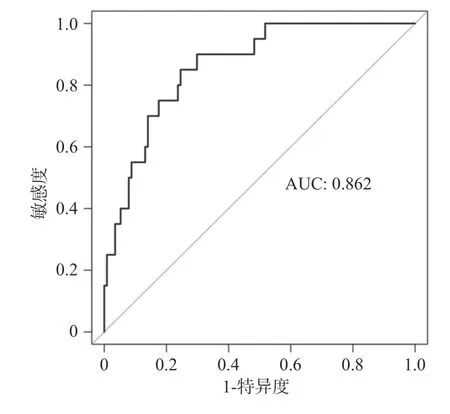
图4 ROC 曲线Fig.4 ROC curve
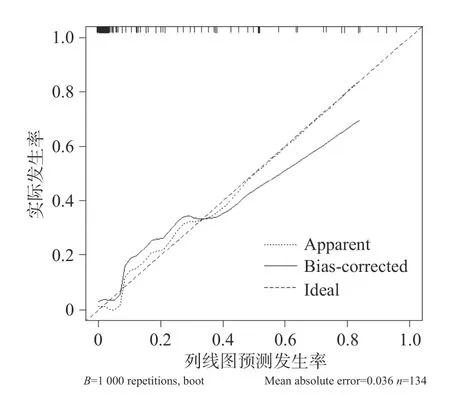
图5 校准曲线Fig.5 Calibration curve
3 讨论
有研究显示,约25%~50%颈动脉粥样硬化斑块脱落或破裂可引起IS 发生,而PIS 约占IS的12%~45%,PIS 预后较差,致残率、致死率极高,可见早期预测PIS 发生,有助于早期识别PIS 高危人群,进而改善预后[10-11]。本研究发现,IS 患者有20 例发展为PIS,发生率为14.93%,远低于吴方玲等[12]研究观点,分析原因可能与颈动脉超微血流成像分级、糖尿病史占比多、纤维蛋白原表达等有关。
本研究单因素分析显示,2 组年龄、基线GNRI 评分、基线Hcy、基线UA 存在明显差异,多因素证实基线GNRI 评分、基线Hcy、基线UA是引起PIS 的影响因素。GNRI 是根据患者生化指标、BMI 客观衡量营养状态,这是较为简单客观信息工具,无需营养专家或患者配合,近年Yamada 等[13]学者对其进行改进,GNRI 评分≥98分不存在营养不良风险。有研究表明,老年患者存在营养不良可增加IS 发生风险,患者器官储备和体内控制减弱,可引起身体机能降低,潜在营养问题凸显出来,进一步延长患者住院时间,加重病情发展[14]。Hcy 是半胱氨酸和蛋氨酸中间代谢产物,正常情况下浓度较大,若Hcy 在体内堆积过高,可增加心脑血管、外周血管疾病发生风险[15];UA 主要来自机体自身代谢、日常饮食摄入,UA 升高可增加痛风、肾炎及心脑血管等疾病发生风险[16]。如张力维[17]、周媛等[18]研究显示,PIS 患者血清Hcy、UA 高于非PIS 患者,提示Hcy、UA 与PIS 疾病发展密切相关,这与本研究观点相似。
常规超声可直观观察动脉壁内膜,判断有无斑块形成、斑块形态及大小、内部回声情况等,但其也存在局限性,不能评估斑块新生血管、血流走向,在评价斑块稳定性临床价值有限[19]。CEUS 凭借血管造影剂技术,可清晰显示有无新生血管,观察组织中灌注情况、微血管密度,有助于评估IS 患者神经功能缺损情况,可弥补常规超声不足,是1 种安全有效成像技术[20]。随着超声检测手段不断发展,SWE 在IS 中动脉粥样硬化稳定性的研究逐渐深入,是当前临床研究热点,原理是利用探头向组织施加应力,收集组织受压前后信号,通过超声成像技术转为彩色图像,可反映动脉壁纵向弹性模量、动脉软硬度[21]。有研究显示,CEUS、SWE 及常规超声可用于检测IS患者颈动脉斑块稳定性,其中CEUS、SWE 特异性较高[22-23]。本研究发现,2 组TTP、PI、AUCTC、颈动脉斑块增强模式、MEmax、MEmin 比较存在明显差异,且Logistic 显示,TTP、PI、AUCTC、颈动脉斑块增强模式、MEmax、MEmin 是PIS 影响因素,表明PIS 患者颈动脉内部血流灌注程度较高、有较多血管生成,且斑块稳定性较差。有研究报道显示,斑块稳定性和血管生成关系密切,血管数量较多与血管壁缺血、通透性、炎性修复有关[24]。新生血管数量多是诱导炎性反应基础,可刺激组织释放较多炎性介质、增加代谢产物,此外,新生血管贯穿斑块内部,进一步加剧炎性反应,导致血管破裂渗漏引起斑块出血,加重患者疾病进展[25]。本研究结合Logistic 筛选出的影响因素绘制列线图,得出PIS 发生风险概率之和,ROC 曲线显示,该模型预测PIS 的AUC 为0.862,敏感度、特异度为80.00%、78.07%;校准曲线发现,该模型预测PIS 准确度的预测效能与实际吻合较好。
综上所述,基线GNRI 评分、基线UA、TTP、PI、AUCTC、颈动脉斑块增强模式、MEmax、MEmin 是PIS 影响因素,基于以上因素绘制列线图具有较好预测效能和准确性。本研究不足之处,病例数过少,可能会影响部分研究数据偏倚性,后续研究中应多中心、多渠道选取样本,扩大样本量进行更为深入研究证实。

